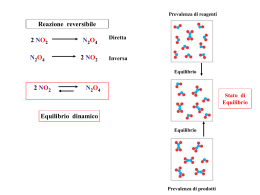
Consideriamo la reazione N2 + 3H2 2 NH3 N2 H2 La reazione è esotermica: l’innalzamento della temperatura la sfavorisce. Se il sistema è chiuso e isolato, la reazione ha una resa di circa il 50%: Perché? A temperature alte l’ammoniaca tende a decomporsi… 2 NH3 N2 + 3H2 Reazione diretta [reagenti] N2 + 3H2 2 NH3 La velocità di reazione diminuisce al diminuire delle concentrazioni dei reagenti tempo reazione inversa [prodotti] 2 NH3 N2 + 3H2 tempo la velocità della reazione inversa aumenta all’aumentare della concentrazione dei prodotti Equilibrio chimico Dopo un certo tempo, la velocità della reazione diretta e di quella inversa si uguagliano [reagenti] Raggiunto l’equilibrio chimico dinamico [prodotti] D’ora in poi le moli di reagenti che scompaiono e che si riformano nel tempo sono uguali teq tempo Equilibrio chimico dinamico • Una reazione si dice all’equilibrio quando le concentrazioni dei reagenti e dei prodotti rimangono costanti nel tempo • Le reazioni, diretta e inversa, non si fermano ma le velocità sono uguali. • La reazione viene rappresentata con una doppia freccia e si dice reversibile REAGENTI PRODOTTI Cinetica delle reazioni N2 + 3H2 2 NH3 2 NH3 N2 + 3H2 Raggiunto l’equilibrio… Vd = Kd [N2][H2]3 Vi = Ki [NH3]2 Quindi… Vd = Vi Divido tutto per… Ki e per [N2][H2 ]3 Quindi… Keq = [N ][H ]3 2 2 Reazione inversa Kd [N2][H2]3 = Ki [NH3]2 Ottengo… Dato che il rapporto tra due costanti è costante … [NH3]2 Reazione diretta [NH3]2 Kd = [N ][H ]3 Ki 2 2 Kd Keq = Ki Situazione generale Data la generica reazione reversibile aA + bB ⇄ cC + dD si avrà… In un sistema isolato, all’equilibrio, il rapporto tra il prodotto delle concentrazioni dei prodotti e il prodotto delle concentrazioni dei reagenti, ognuno elevato al proprio coefficiente stechiometrico, è costante. Legge di azione di massa (Waage e Guldberg - 1864) Legge di azione di massa situazioni possibili Se Keq > 1 la reazione è spostata verso i prodotti. Se Keq = 1 la reazione è al 50%. Se Keq < 1 la reazione è spostata verso i reagenti. Nelle reazioni omogenee in fase gassosa, Come, ad esempio, 2 NO + O2 ↔ 2 NO2 La costante di equilibrio viene espressa in funzione delle pressioni parziali (invece delle concentrazioni) e si indica con Kp. aA(g) + bB(g) ⇄ cC(g) + dD(g) L’equilibrio e la legge di azione di massa valgono in un sistema isolato (non c’è variazione di materia, pressione e temperatura), ma cosa succede se non lo è? Le Chatelier studiò le reazioni reversibili in caso di variazione delle condizioni di reazione giungendo al principio dell’equilibrio mobile (o di Le chatelier). Un sistema all’equilibrio, perturbato da un’azione esterna, reagisce in modo da ridurne o alterarne l’effetto ristabilendo l’equilibrio. Aggiunta di una sostanza (Reagente o Prodotto) Come si può ben notare, l’aggiunta di un reagente «rompe l’equilibrio», ma il sistema tende a variare le velocità di reazione in modo da formare altro prodotto e ristabilire l’equilibrio. Quindi ad un amento della concentrazione del reagente, il sistema reagisce aumentando la concentrazione del prodotto (il rapporto tende a rimanere costante). Ovviamente succederà una cosa inversa nel caso dell’aggiunta di un prodotto Effetto della variazione di pressione L’effetto della variazione di pressione va studiato caso per caso. Normalmente in caso di un sistema omogeneamente gassoso, la pressione favorisce l’incontro delle particelle, quindi entrambe le reazioni (diretta e inversa), ma il risultato finale non è sempre scontato. Consideriamo, ad esempio, la reazione: N2O4 2NO2 La pressione (equivalente alla concentrazione per reazioni in fase liquida), aumenta allo stesso modo per i reagenti e per i prodotti, ma dati i coefficienti (esponenti) differenti, il rapporto varia. Per il principio di Le Chatelier, il sistema reagisce diminuendo i prodotti (numeratore), ristabilendo l’equilibrio L’aumento di temperatura, sposta l’equilibrio verso i prodotti in una reazione endotermica e verso i reagenti in una esotermica Reazioni eterogenee Le reazioni si dicono eterogenee quando i componenti si trovano in fasi diverse. Si ha una reazione eterogenea per esempio quando si libera un gas a partire da un solido o da un liquido (es. Zn + HCl), oppure quando un soluto solido (o gassoso) si scioglie in soluzione liquida (Es. NaCl + H2O oppure CO2 + H2O). Particolari, inoltre, sono le reazioni eterogenee con formazioni di ioni. Il principio di Le Chatelier, oltre a verificarsi nel caso di aggiunta di prodotto o reagente, lo si si verifica anche con l’aggiunta di sostanze differenti, ma che formano almeno uno ione uguale a quelli formati dai componenti della reazione considerata (effetto dello ione comune). Tale ione, infatti, si comporta come se fosse stato aggiunto un componente della reazione. Il cromato d‘argento si scioglie in acqua dissociandosi in Ag2CrO4 ⇄ 2Ag+ + CrO42Agiungendo AgNO3 aggiungeremo ioni Ag+ L’aggiunta di uno ione comune a una soluzione satura di un composto ionico all’equilibrio ne abbassa la solubilità (effetto dello ione comune).
Scaricare