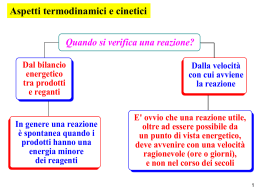
Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE CINETICA CHIMICA Abbiamo visto che la spontaneità delle reazioni chimiche può essere valutata dal punto di vista termodinamico: nel fare questo, non si considera il meccanismo della reazione, ma soltanto l’energia libera (e quindi entalpia e entropia) degli stati iniziale e finale. Le reazioni vanno, però, anche esaminate da un punto di vista cinetico, concentrando l’attenzione sul meccanismo di reazione e sulla velocità con cui una reazione avviene. la velocità di una reazione chimica è la velocità con cui la concentrazione di un certo reagente o prodotto varia nel tempo e si esprime come: velocità = ΔC/Δt cioè è pari alla variazione di concentrazione, ΔC, che si nota nell’intervallo di tempo Δt unità di misura della velocità di reazione: moli/ (l sec) Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE la velocità con cui una reazione ha luogo è tipica di ciascuna reazione Inoltre, per una stessa reazione, si osserva che la velocità viene a dipendere dalla concentrazione (o dalla pressione se parliamo di reazioni in fase gassosa) dei reagenti: per la generica reazione a A + b B c C + d D dove a, b, c e d sono i coefficienti stechiometrici relativi ai reagenti A e B e i prodotti C e D velocità di reazione = costante [A]n [B]m dove n e m non sono i coefficienti stechiometrici a e b; sono dei parametri che si determinano sperimentalmente e che si chiamano ordine di reazione rispetto ad A e rispetto a B (rispettivamente) la costante (indicata con k) è detta costante di velocità ed è tipica di ogni reazione Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Dalla espressione della velocità consegue che: 1) maggiore è la concentrazione dei reagenti, maggiore sarà la velocità di reazione 2) la costante di velocità k è la velocità di reazione quando le concentrazioni dei reagenti sono unitarie – quindi se voglio confrontare la velocità di reazioni diverse vado a paragonare proprio il valore di k da quali fattori dipende il valore di k associato a una certa reazione? Per essere in grado di reagire, i reagenti devono venire in contatto tramite una collisione. Non tutte le collisioni fra molecole portano a una reazione, perché alcune di esse si rivelano inefficaci per far avvenire la reazione chimica. perché ? Per far avvenire la reazione, si devono prima rompere i legami dei reagenti per poi formarne dei nuovi (in realtà in molti casi il meccanismo è concertato). In altre parole i reagenti devono avere un contenuto di energia tale da riuscire a rompere almeno uno dei legami presenti nelle molecole dei reagenti A2 B2 meccanismo di reazione complesso attivato 2 AB Diagramma delle variazioni energetiche che intervengono durante il decorrere della reazione si definisce ENERGIA DI ATTIVAZIONE (Ea) di una certa reazione chimica la minima energia che le particelle devono possedere quando si urtano affinchè la reazione avvenga Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE in molti casi di importanza pratica è necessario accelerare una reazione che altrimenti avverrebbe in tempi troppo lunghi come si può accelerare una reazione ? 1) aumento della temperatura ad una temperatura più elevata, è maggiore l’energia cinetica media delle molecole e quindi è più facile che esse siano dotate dell’energia necessaria a superate l’energia di attivazione T2 T1 questo è vero sempre sia per reazione endotermiche che esotermiche Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE 2) aggiunta di un catalizzatore i catalizzatori sono dei particolari composti chimici che hanno la capacità di aumentare la velocità di una reazione; quando si usa un catalizzatore si verifica un completo cambiamento nel modo in cui la reazione avviene (cioè il meccansimo di reazione cambia); per essere definito in pratica, l’effetto di un catalizzatore consiste tale, però, un catalizzatore si deve ritrovare chimicanell’abbassare l’energia di mente inalterato alla fine della reazione e non deve attivazione della reazione apparire esplicitamente nella equazione chimica che rappresenta la reazione esempio B2 + C BC + B BC + A2 AB + AC AC + B AB + C A2 + B2 2 AB l’equazione globale non è cambiata C non è stato consumato dalla reazione Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE a volte è invece necessario decelerare la reazione 1) riduzione della temperatura ad una temperatura più bassa, l’energia cinetica media delle molecole è minore e la velocità diminuisce 2) aggiunta di un inibitore (catalizzatore al negativo) cambia il meccanismo di reazione comportando un aumento della energia di attivazione la velocità diminuisce Da notare che sia i catalizzatori che gli inibitori possono essere nella stessa fase dei reagenti (e in questo caso si parla di catalisi omogenea) o in una fase diversa (catalisi eterogenea) catalisi enzimatica: alcune proteine ad alta massa molecolare, dette ENZIMI, sono in grado di svolgere un’azione catalitica molto specifica su molte reazioni biochimiche che altrimenti avverrebbero con velocità molto basse; essi svolgono quindi un ruolo essenziale negli organismi viventi es. lattasi lattosio glucosio + galattosio Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Meccanismo di funzionamento di una marmitta catalitica Un esempio importante di catalizzatore è la marmitta catalitica, il cui scopo è convertire alcune specie gassose nocive (prodotte durante la combustione dei carburanti nel motore delle automobili) in specie gassose meno pericolose. Per esempio, CO (monossido di carbonio), NO (monossido di azoto) e piccoli idrocarburi incombusti (che possiamo indicare genericamente con HC) vengono convertiti per ossidazione in CO2, N2 e H2O in presenza di un catalizzatore metallico misto platinorodio ossidazioni catalizzate da Pt 2 CO + O2 → 2 CO2 (HC) + O2 → CO2 + H2O ossidazioni catalizzate da Rh 2 CO + 2 NO → 2 CO2 + N2 (HC) + NO → CO2 + H2O + N2
Scaricare