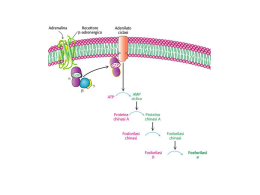
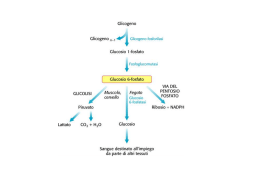
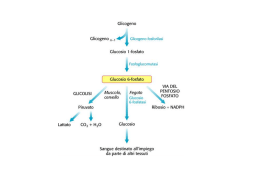
GLICOGENOSINTESI E GLICOGENOLISI OMOPOLISACCARIDE STRUTTURA DEL GLICOGENO GLICOGENO SINTESI Sintesi “de novo” di Glicogeno Enzima Ramificante Enzima Ramificante AMIDO GLICOGENO LISI Glicogeno Fosforilasi ed enzima deramificante Vitamina B6 Enzima Deramificante Nel Fegato il Glucosio 6-P viene defosforilato a Glucosio Regolazione ormonale del metabolismo del glicogeno Il glucosio si lega ad un sito allosterico della glicogeno fosforilasi a epatica e induce una modifica conformazionale che espone il residuo di serina fosforilato all’azione della fosforilasi a fosfatasi (PP1). Questa fosfatasi converte la glicogeno fosforilasi a in fosforilasi b, riducendone l’attività e diminuendo la degradazione del glicogeno in risposta ad un aumento del glucosio ematico. Anche l’insulina agisce indirettamente stimolando PP1 e diminuendo la degradazione del glicogeno. Regolazione allosterica Effetto della GSK3 sull’attività della glicogeno sintasi. La Glicogeno sintasi a ha tre residui di serina che sono fosforilati dalla glicogeno sintasi chinasi 3 (GSK3). Questa fosforilazione converte la glicogeno sintasi nella forma b inattiva. L’azione della GSK3 richiede che essa venga fosforilata (priming) dalla caseina chinase (CKII). L’Insulina induce il passaggio dalla glicogeno sintasi b alla glicogeno sintasi a bloccando l’attività della GSK3 ed attivando una fosfoproteina fosfatasi (PP1 nel muscolo, un’altra fosfatasi nel fegato). Nel muscolo, l’epinefrina attiva delle PKA che fosforilano la glycogen-targeting protein GM (vedi Figura 1540) in un sito che provoca la dissociazione di PP1 dal glicogeno. Il Glucosio 6-P favorisce la defosforilazione della glicogeno sintasi legandosi ad essa e promuovendo una conformazione che è un migliore substrato per PP1. Anche il Glucosio promuove la defosforilazione; il legame del glucosio alla glicogeno fosforilasi a induce un cambio conformazionale che favorisce la sua defosforilazione e trasformazione in glicogeno fosforilasi b, operato dalla PP1 Priming of GSK3 phosphorylation of glycogen synthase. (a) Glycogen synthase kinase 3 first associates with its substrate (glycogen synthase) by interaction between three positively charged residues (Arg96, Arg180, Lys205) and a phosphoserine residue at position +4 in the substrate. This association aligns the active site of the enzyme with a Ser residue at position 0, which it phosphorylates. This creates a new priming site, and the enzyme moves down the protein to phosphorylate the Ser residue at position –4, and then the Ser at –8. Priming of GSK3 phosphorylation of glycogen synthase. GSK3 has a Ser residue near its amino terminus that can be phosphorylated by PKA or PKB (see Figure 15-39). This produces a "pseudosubstrate" region in GSK3 that folds into the priming site and makes the active site inaccessible to another protein substrate, inhibiting GSK3 until the priming phosphoryl group of its pseudosubstrate region is removed by PP1. Other proteins that are substrates for GSK3 also have a priming site at position +4, which must be phosphorylated by another protein kinase before GSK3 can act on them. The path from insulin to GSK3 and glycogen synthase. insulin receptor substrate-1 (IRS-1); phosphatidylinositol 3kinase (PI-3K); phosphatidylinositol 4,5-bisphosphate (PIP2); phosphatidylinositol 3,4,5-trisphosphate (PIP3); protein kinase (PDK-1); protein kinase (PKB); phosphorylated glycogen synthase kinase 3 (GSK3) in its pseudosubstrate region. The inactivation of GSK3 allows phosphoprotein phosphatase 1 (PP1) to dephosphorylate and thus activate glycogen synthase. Glycogen-targeting protein GM CONTROLLO DELLA GLICEMIA Assorbimento intestinale del glucosio Recupero del glucoso dal glicogeno o amido introdotto con la dieta · La -Amilasi è una endoglicosidasi • Essa spezza l’amilopectina o il glicogeno in maltosio, maltotrioso e altri piccoli oligosaccaridi • It is active on either side of a branch point, but activity is reduced near the branch points • Debranching enzyme cleaves "limit dextrins" • Note the 2 activities of the debranching enzyme Biosintesi dell’insulina. Viene operata dalle cellule beta. Si passa dalla pre-proinsulina alla pro-insulina e infine all’insulina che viene espulsa in granuli secretori contenenti anche Zinco ed un peptide C residuo. L’insulina •aumenta l’assunzione di glucosio da parte delle cellule •aumenta la sua utilizzazione diminuisce il processo di gluconeogenesi La regolazione della secrezione di insulina è dovuta •primariamente alla concentrazione di glucosio •secondariamente all’aumento della concentrazione plasmatica di aminoacidi all’aumento del cortisolo, del glucagone di ioni K+ e Ca+ I sensori delle variazioni glicemiche sono le cellule beta Le molecole di glucosio entrate nelle cellule beta vengono demolite ossidativamente con produzione di ATP. L’aumento di ATP induce la chiusura di particolari canali K+ (ATP-sensibili) cui consegue una depolarizzazione ed apertura dei canali ionici Calcio voltaggio dipendenti. A questo segue la liberazione dell’ormone Meccanismo di rilascio dell’insulina
Scaricare