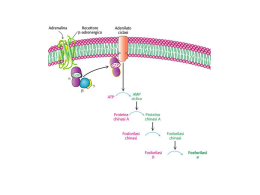
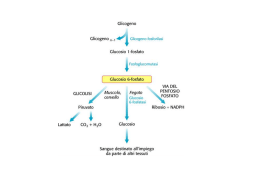
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 30 La demolizione del glicogeno Concetti chiave: • Il glicogeno, la forma di immagazzinamento del glucosio, è un polimero ramificato. • La mobilizzazione del glucosio nel fegato coinvolge una serie di reazioni che dal glicogeno portano a glucosio-1-fosfato, glucosio-6-fosfato e infine a glucosio. Struttura del glicogeno Il glicogeno è un polimero ramificato di residui di glucosio, una forma di riserva di glucosio facilmente mobilizzabile quando è richiesta produzione di energia. I residui di D-glucosio del glicogeno sono legati da legami glicosidici α-1,4 con ramificazioni α-1,6 ogni 8-14 residui. Struttura del glicogeno Il glicogeno si presenta sottoforma di granuli sferoidali con dimensioni di circa 40 nm. Una molecola di glicogeno contiene fino a dodici strati di glucosio con al centro la proteina glicogenina. La superficie del granulo contiene le estremità non riducenti. Struttura del glicogeno Il glicogeno è presente nel citoplasma e la sua molecola è visibile sottoforma di granuli. Localizzazione del glicogeno I due principali siti di riserva del glicogeno sono il fegato (10% del peso) ed il muscolo scheletrico (1-2% del peso). Nel fegato la sintesi e degradazione del glicogeno sono regolate in modo da mantenere il livello ematico di glucosio ai livelli necessari per il fabbisogno dell’intero organismo. Destini del glucosio 6-fosfato La demolizione del glicogeno produce glucosio 6-fosfato che può essere: 1. Impiegato come combustibile per il metabolismo aerobico e anaerobico (ad esempio nel tessuto muscolare); 2. Può essere convertito in glucosio libero nel fegato e successivamente rilasciato nel sangue; 3. Essere trasformato dalla via del pentosio fosfato per generare NADPH o ribosio in molti tessuti. La demolizione del glicogeno La demolizione del glicogeno (glicogenolisi) avviene mediante rimozione sequenziale delle unità di glucosio dalle estremità non riducenti (prive di un gruppo C1-OH e con un gruppo ossidrilico libero sul C4). La demolizione del glicogeno Ogni ramificazione ha un’estremità non riducente per cui la struttura molto ramificata consente la rapida mobilizzazione del glucosio attraverso il rilascio simultaneo di unità di glucosio in corrispondenza delle ramificazioni. La demolizione del glicogeno La glicogenolisi richiede tre enzimi: 1. La glicogeno fosforilasi (o fosforilasi) che catalizza la fosforolisi del glicogeno con la rimozione del residuo di glucosio terminale dall’estremità non riducente di una catena di glicogeno; 2. L’enzima deramificante che rimuove le ramificazioni rendendo le unità di glucosidiche accessibili all’attacco della fosforilasi; 3. La fosfoglucomutasi che trasforma il G1P in G6P. Glicogeno fosforilasi Enzima deramificante Enzima deramificante 2 1 Glicogeno fosforilasi G6P 3 G1P Fosfoglucomutasi La demolizione del glicogeno (1) La glicogeno fosforilasi catalizza la reazione in cui il legame glicosidico α-1-4 viene attaccato dal fosfato inorganico producendo il rilascio di glucosio 1-fosfato. Parte dell’energia del legame glicosidico viene conservata mediante la formazione dell’estere fosforico nel glucosio 1-fosfato. La demolizione del glicogeno (1) La scissione fosforolitica del glicogeno è energeticamente vantaggiosa perché lo zucchero rilasciato è già fosforilato. Una scissione idrolitica produrrebbe glucosio che, per entrare nella via glicolitica, dovrebbe essere fosforilato a spese di molecole di ATP. Meccanismo di reazione della glicogeno fosforilasi La glicogeno fosforilasi, omodimero con subunità identiche formate da tre domini. Nel sito catalitico è presente una molecola di PLP legata alla Lys 680 dell’enzima. Il sito di legame del glicogeno è connesso al sito catalitico da una sottile fessura dove possono accomodarsi 4-5 residui di glucosio permettendo all’enzima di catalizzare la fosforolisi di molti residui senza doversi dissociare (enzima processivo). Dominio N-terminale Dominio C-terminale Meccanismo di reazione della glicogeno fosforilasi • La scissione fosforolitica anziché idrolitica richiede l’esclusione dell’acqua dal sito attivo. • L’intervento del PLP è necessario per escludere l’acqua dal sito attivo. • Il gruppo aldeidico del PLP forma una base di Schiff con un residuo di Lys nel sito attivo della fosforilasi. • Nella fosforilasi il PLP, derivato della vitamina B6, partecipa alla catalisi fungendo da catalizzatore acido-base. • Il gruppo fosforico del PLP agisce infatti di concerto con l’ortofosfato fungendo da donatore ed accettore di un protone. Meccanismo di reazione della glicogeno fosforilasi L’ortofosfato favorisce la scissione del legame glicosidico donando un protone al glucosio in uscita ed accettando un protone dal PLP. Si forma così un carbocatione intermedio che viene attaccato dall’ortofosfato per formare G1P con il concomitante ritorno dell’atomo di H al PLP. La demolizione del glicogeno (2) La fosforilasi non può degradare i legami α-1-6 delle ramificazioni del glicogeno. Intervengono dunque una trasferasi ed una α-1-6-glucosidasi, attività presenti in un enzima bifunzionale, che rimodellano il glicogeno affinché possa continuare ad essere degradato dalla fosforilasi. La demolizione del glicogeno (2) La trasferasi sposta un blocco di tre residui glicosidici dall’estremità di una ramificazione a un’altra. Una α-1-6-glucosidasi (enzima deramificante) idrolizza il legame α1-6-glicosidico. Viene così rilasciata una molecola di glucosio libero che verrà fosforilata dall’esochinasi. La demolizione del glicogeno (3) Il G1P formato dalla scissione fosforolitica del glicogeno viene convertito in G6P dalla fosfoglucomutasi. L’enzima, con meccanismo simile a quello della fosfoglicerato mutasi della glicolisi, cede un gruppo fosforico al substrato e il gruppo fosforico del bisfosfato intermedio viene trasferito all’enzima per ottenere lo stato fosforilato iniziale. Ruolo del fegato nell’omeostasi dei livelli di glucosio Nel muscolo, il G6P può continuare nella via glicolitica o lungo la via del pentoso fosfato. Nel fegato, il G6P è reso disponibile anche per essere usato da altri tessuti. Tuttavia, poiché il G6P non può attraversare la membrana cellulare, il G6P è prima traslocato nel reticolo endoplasmatico (RE) ad opera di G6P traslocasi e poi idrolizzato dalla glucosio-6-fosfatasi (G6Pasi) enzima presente sulla membrana del RE. Le malattie da accumulo di glicogeno Difetti di uno qualsiasi dei componenti del metabolismo del glicogeno provocano le malattie ereditarie da accumulo di glicogeno (glicogenosi) che con produzione di glicogeno anormale per quantità o qualità. Tali patologie portano epatomegalia, ipoglicemia, disturbi renali e vascolari. La sintesi del glicogeno Concetti chiave: • La sintesi del glicogeno nel fegato coinvolge una serie di reazioni che da glucosio portano a glucosio-6-fosfato, UDP-glucosio e, infine, a glicogeno. • L'UDP-glucosio è una molecola attivata. • Il glicogeno viene allungato a partire da un innesco costruito dalla proteina glicogenina su se stessa Le vie opposte di sintesi e di degradazione del glicogeno La sintesi e la demolizione del glicogeno avvengono attraverso vie separate ed opposte. Il processo esoergonico della demolizione del glicogeno è invertito da un processo che usa solo UTP per produrre l’intermedio UDP-glucosio. La sintesi del glicogeno Nell’ UDP-glucosio il gruppo ossidrilico del glucosio è esterificato con l’unità difosfato dell’UDP. Agisce da donatore di glucosio nella biosintesi del glicogeno ed è una forma attivata di glucosio come l’ATP e l’acetil CoA lo sono dell’ortofosfato e dell’acetato. La sintesi del glicogeno Nell’ UDP-glucosio si sintetizza dal glucosio 1-fosfato e dall’uridina trifosfato (UTP) tramite una reazione catalizzata dall’UDPglucosio pirofosforilasi. I gruppi di pirofosfato vengono poi idrolizzati a ortofosfato da una pirofosfatasi inorganica. Tale reazione è irreversibile e favorisce la sintesi di UDP-glucosio. La sintesi del glicogeno La glicogeno sintasi catalizza il trasferimento del glucosio dall’UDP-glucosio ai residui terminali non riducenti del glicogeno formando legami glicosidici α-1,4. La sintesi del glicogeno La glicogeno sintasi può aggiungere residui di glucosio solo ad una catena polisaccaridica che contenga almeno quattro residui per cui richiede un innesco (primer). Tale funzione è svolta dalla glicogenina, una glicosiltrasferasi dimerica in cui ogni subunità catalizza l’aggiunta di otto unità di glucosio all’altra subunità con un processo di autoglicosilazione UDP-glucosio-dipendente. La sintesi del glicogeno La glicogeno sintasi può aggiungere residui di glucosio solo ad una catena polisaccaridica che contenga almeno quattro residui per cui richiede un innesco (primer). Tale funzione è svolta dalla glicogenina, una glicosiltrasferasi dimerica in cui ogni subunità catalizza l’aggiunta di otto unità di glucosio all’altra subunità con un processo di autoglicosilazione UDP-glucosiodipendente. La sintesi del glicogeno Poiché la glicogeno sintasi catalizza solo la sintesi di legami α-1,4, è necessario l’intervento di un enzima ramificante che forma legami α-1,6 che fanno del glicogeno un polimero ramificato. La sintesi del glicogeno L’enzima ramificante rimuove un oligosaccaride di circa sette residui di lunghezza dall’estremità non riducente e crea un legame di tipo α-1,6. Il controllo del metabolismo del glicogeno Concetti chiave: • I processi opposti di demolizione e di sintesi del glicogeno sono regolati reciprocamente da interazioni allosteriche e modificazioni covalenti degli enzimi chiave. • La fosforilazione e la defosforilazione di un enzima come la glicogeno fosforilasi possono modificarne l’attività spostando l'equilibrio tra la conformazione più attiva e quella meno attiva dell'enzima. • Il metabolismo del glicogeno è fondamentalmente sotto il controllo di ormoni quali l'insulina, il glucagone e l'adrenalina. Regolazione della glicogeno fosforilasi La glicogeno fosforilasi è regolata da più effettori allosterici che segnalano lo stato energetico della cellula nonché dalla fosforilazione reversibile che risponde a segnali ormonali quali l’insulina, il glucagone e l’adrenalina. Il controllo per modificazione covalente: la fosforilazione Strutture della fosforilasi a e della fosforilasi b La glicogeno fosforilasi b, generalmente inattiva, viene convertita in fosforilasi a attiva per fosforilazione di una singola serina 14 di ciascuna subunità. Le fosforilasi a e la fosforilasi b sono in equilibrio tra uno stato rilassato (R) ed uno teso (T). Strutture della fosforilasi a e della fosforilasi b La fosforilasi b di solito è inattiva poiché l’equilibrio favorisce lo stato T. La fosforilazione favorisce la struttura dello stato R più attivo della fosforilasi a. Nello stato T i siti catalitici sono parzialmente occlusi. Regolazione della fosforilasi muscolare Nel muscolo il fine ultimo della glicolisi è la produzione di ATP. Nel muscolo a riposo tutto l’enzima è nella forma b inattiva: non c’è necessità di produrre glucosio fino a quando non è richiesta energia. La fosforilasi b muscolare è attiva (stato R) solo in presenza di elevate concentrazioni di AMP (bassa carica energetica), che si lega a un sito di legame per i nucleotidi presente su entrambe le subunità e stabilizza la conformazione della fosforilasi b nello stato R. ATP e glucosio 6-fosfato agiscono da effettori allosterici negativi. Regolazione della fosforilasi epatica Il fegato ha il ruolo di mantenere costante il livello di glucosio nel sangue producendo ed esportando questo metabolita ai tessuti che lo richiedono, e importandolo e conservandolo quando viene introdotto in eccesso con la dieta. La fosforilasi epatica è di norma presente nella forma a. Il legame del glucosio sposta l’equilibrio verso lo stato T e inattiva l’enzima. In tal modo il glicogeno non viene mobilizzato quando il glucosio è già abbondante. Regolazione della glicogeno fosforilasi La cascata che governa l’interconversione enzimatica della glicogeno fosforilasi coinvolge tre enzimi: la fosforilasi chinasi che fosforila la glicogeno fosforilasi; la proteina chinasi (PKA) che fosforila la fosforilasi chinasi; la fosfoproteina fosfatasi-1 (PP1) che defosforila e quindi inattiva sia la gliocogeno fosforilasi a sia la fosforilasi chinasi. Attivazione della fosforilasi chinasi La fosforilasi chinasi, un tetramero (αβγδ βγδ) βγδ 4 è attivata dalla fosforilazione della subunità β mediata da ormoni e dal legame al calcio nella subunità δ (calmodulina). Regolazione della degradazione e sintesi del glicogeno Quale è il segnale che determina la scissione del glicogeno attivando la PKA? Controllo ormonale del metabolismo del glicogeno Il legame dell’ormone al recettore da inizio a una via di trasduzione del segnale che determina la fosforilazione e l’attivazione della glicogeno fosforilasi. Controllo ormonale del metabolismo del glicogeno Il legame dell’adrenalina ai recettori β-adrenergici delle cellule muscolari ed epatiche causa l’aumento di cAMP che promuove la degradazione del glicogeno a G6P necessario per la glicolisi nel muscolo oppure a glucosio libero destinato all’esportazione nel fegato. Il fegato risponde in modo simile al glucagone. Il legame dell’adrenalina ai recettori α-adrenergici sulle cellule epatiche causa un aumento citosolico del [Ca]2+ che favorisce la degradazione del glicogeno. Controllo ormonale del metabolismo del glicogeno Quando il glucosio circolante è abbondante, l’insulina stimola l’assorbimento di glucosio e la sintesi di glicogeno nel muscolo. Il fegato risponde direttamente all’aumento del glucosio incrementando la sintesi di glicogeno. Controllo ormonale del metabolismo del glicogeno Controllo ormonale del metabolismo del glicogeno L’insulina stimola la sintesi di glicogeno attivando un sistema a cascata che conduce alla fosforilazione e all’inattivazione della glicogeno sintasi chinasi prevenendo così la fosforilazione della glicogeno sintasi. Nella sua forma defosforilata la glicogeno sintasi è attiva. Regolazione della degradazione e sintesi del glicogeno Le stesse cascate enzimatiche del cAMP innescate da glucagone e adrenalina che conducono alla degradazione del glicogeno nel fegato e nel muscolo provocano anche l’arresto della sintesi del glicogeno tramite la stessa PKA che inattiva la glicogeno sintasi. Regolazione della degradazione e sintesi del glicogeno Le cascate enzimatiche forniscono un sistema di controllo estremamente sofosticato che modulano le capacità di risposta degli enzimi e amplificano i segnali di regolazione. Quale è il segnale che determina il blocco della scissione del glicogeno provocata dalla PKA? Regolazione della degradazione e sintesi del glicogeno Quale è il segnale che determina il blocco della scissione del glicogeno provocata dalla PKA? Attivazione della fosfoproteina fosfatasi-1 (PP1) La mobilizzazione del glicogeno cessa per azione della proteina fosfatasi 1, enzima inibito dall’adrenalina. La fosforilazione della subunità regolatoria GM ad opera della PKA dissocia la subunità catalitica dai suoi substrati nella particella di glicogeno. La fosforilazione dell’inibitore sempre ad opera della PKA inattiva la subunità catalitica della PP1. Regolazione della degradazione e sintesi del glicogeno La proteina fosfatasi 1 stimola la sintesi del glicogeno e ne impedisce la degradazione. Regolazione della degradazione e sintesi del glicogeno Il glucosio ematico regola il metabolismo del glicogeno epatico. L’infusione di glucosio nel torrente circolatorio determina l’inattivazione della fosforilasi che agisce come sensore cellulare del glucosio, seguita dall’attivazione della glicogeno sintasi. Schema generale del metabolismo del glucosio
Scaricare