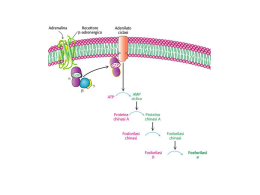
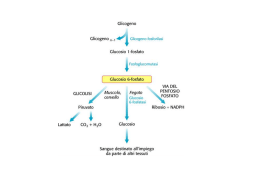
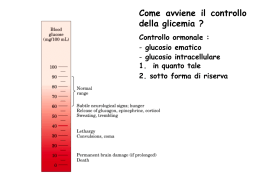
Glicogeno Il glicogeno è il polisaccaride di riserva delle cellule animali (fegato e muscolo!) Polisaccaridi di riserva molto diffusi nel mondo animale/vegetale: mantengono bassa osmolarità nel citosol Amiloso Polimero lineare di glucoso (1 4) Amilopectina Polimero ramificato di glucoso (1 4) e (1 6) Cellulosa Polimero lineare di glucoso (1 4) Glicogeno Polimero ramificato di glucoso: + ramif. dell’amilopectina (1 ramif. ogni 8-12 residui) (1 4) e (1 6) Fegato: glicogeno tot. ~600 kcal Densità > muscolo Glicogeno molto idratato: 1g lega 2 g d’acqua! Trigliceridi tot. ~125.000 kcal (anidri!) Gli enzimi che sintetizzano e demoliscono il glicogeno sono associati ai granuli Muscolo: glicogeno tot. ~1200 kcal Glicogeno-lisi Avviene a partire dalle estremità non riducenti. Glicogenon + Pi Glicogenon-1 + glucoso 1-P glicogeno fosforilasi (fosforil-transferasi) tanto! G1P G6P poco! Pi/G1P 100 fosfoglucomutasi G6P entra nel reticolo endoplasmatico (traslocasi) e viene defosforilato (solo nel fegato!) G6P + H2O glucoso + Pi glucoso 6-fosfato fosfatasi (inducibile) Glucoso rientra nel citosol attraverso trasportatore ad alta capacità ed esce nel sangue. La glicogeno fosforilasi agisce fino a 4 residui da una ramificazione. Poi interviene enzima de-ramificante: bifunzionale transferasi (su ultimi 3 residui) idrolasi su legame (1 6) La G6Pasi è stabilizzata da una proteina (SP) che lega il Ca2+ Glicogeno-sintesi Glicogenon + UDP-glucoso Glicogenon+1 + UDP glicogeno sintasi (glucosil transferasi) Glucosio-1-P + UTP UDP-glucoso + PPi UDP-glucoso pirofosforilasi reazione resa irreversibile dall’idrolisi del PPi a 2Pi Enzima ramificante Trasferisce ultimi 7 residui da una catena su un’altra catena, in posizione (1 6), a distanza di almeno 4 residui da un’altra ramificazione È una transferasi Aumenta i punti di attacco sulla molecola del glicogeno per enzimi che lo sintetizzano e demoliscono velocità turnover glicogeno Glicogenina Proteina di 37 kDa, funziona da primer x la sintesi del glicogeno (-OH di Tyr) Catalizza autoglicosilazione di 8 residui (da UDP-G), poi subentra la La glicogeno sintasi non può legare due residui di glucosio, ma soltanto allungare una catena di glucano già esistente. Infatti, nella prima tappa della sintesi del glicogeno interviene un altro enzima, la tirosina glicosiltransferasi, che attacca un residuo di glucosio al gruppo OH di una Tyr di una proteina detta glicogenina. La glicogenina estende autocataliticamente la catena con residui donati dall’ UDPG ed a questo punto inizia ad agire la glicogeno sintasi. La proteina glicogenina (Mr 37 284) innesca la sintesi del glicogeno legando al gruppo –OH di un residuo di Tyr del polipeptide un residuo di glucosio. La reazione utilizza UDP-glucosio e avviene grazie all’attività autocatalitica protein-tirosina glicosiltransferasica. All’estremità non riducente di questa prima unità glucosidica legata alla glicogenina vengono aggiunti altri 7 residui di glucosio ad opera della glicogenina associata alla glicogeno sintasi A questo punto, è possibile l’azione diretta della glicogeno sintasi che si dissocia dalla glicogenina e sintetizza una catena lineare. Non appena il numero di residui aggiunti lo permette, abbiamo l’azione dell’enzima ramificante che aggiunge una seconda estremità non riducente sulla quale la glicogeno sintasi può lavorare e così via. 11 7 L’enzima ramificante che catalizza questa reazione è piuttosto esigente: - il blocco di circa sette residui deve comprendere l’estremità non riducente e deve provenire da una catena lunga almeno undici residui; . Struttura della glicogeno transferasi - inoltre il nuovo punto di ramificazione deve distare almeno quattro residui dal punto di ramificazione precedente. 4 residui Regolazione del “ciclo del glicogeno” (sintesi-demolizione) Glicogeno fosforilasi Allosterica Covalente Glicogeno sintasi Allosterica Covalente Muscolo AMP ADRENALINA G6P ADRENALINA Fegato GLUCOSO GLUCAGONE INSULINA G6P GLUCAGONE INSULINA Solo nel fegato la [glucoso] intracellulare rispecchia la [glucoso] sangue perché il fegato ha un trasportatore del glucoso ad alta capacità e insulinoindipendente (Glut-2) Nel fegato operano altri meccanismi non ormonali si lega attiva si dissocia Regolazione del metabolismo del glicogeno epatico ad opera del glucosio. L’insulina attiva la proteina fosfatasi 1 Benchè l’insulina sia il principale segnale per la sintesi di glicogeno, il Fegato è sensibile alla concentrazione di glucosio nel sangue e capta o rilascia glucosio a seconda delle necessità. Regolazione coordinata del metabolismo del glicogeno
Scaricare