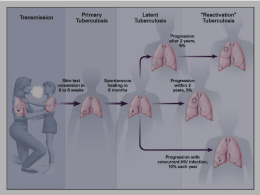
Atlante di Anatomia Fisiopatologia e Clinica Apparato respiratorio CLICCA QUI per acquistare il volume David A. Kaminsky, md Associate Professor Pulmonary and Critical Care Medicine University of Vermont Burlington, Vermont Atlante di Anatomia Fisiopatologia e Clinica Collana diretta da Eugenio Gaudio seconda edizione Apparato respiratorio Edizione italiana a cura di Claudio Terzano Illustrazioni di Frank H. Netter, MD Carlos A.G. Machado, MD John A. Craig, MD James A. Perkins, MS, MFA Kristen Wienandt Marzejon, MS, MFA Tiffany S. DaVanzo, MA, CMI Anita Impagliazzo, MA, CMI Titolo originale dell’opera: THE NETTER COLLECTION OF MEDICAL ILLUSTRATIONS: RESPIRATORY SYSTEM, Volume 3, Second Edition Copyright © 2011 by Saunders, an imprint of Elsevier Inc. All rights reserved. ISBN 978-1-4377-0574-4 This translation is published by arrangement with Elsevier Inc. Tutte le copie devono portare il contrassegno della SIAE Publishing Director: Valeria Brancolini Books & Bespoke Publishing Manager: Tiziano Strambini Acquisition Editor: Alessandra Mutignani Development Editor: Paola Leschiera, Michela Del Zoppo Operations Director: Antonio Boezio Books Team Manager: Paola Sammaritano Books Project Manager: Chiara Cucinella Creative Director: Giorgio Gandolfo Traduzione dalla lingua inglese, per conto di Elsevier Srl, a cura di: Silvia Vivan, Cristina Pigozzi, Valeria Cardano, Serena Fortin, Donatella Laddomada, Isabella Trentin (Trans-Edit Group Srl, Milano) Coordinamento della traduzione: Silvia Vivan, Eliana Tosoni (Trans-Edit Group Srl, Milano) Redazione: Trans-Edit Group Srl, Milano ©Elsevier Srl - Tutti i diritti riservati 2002 - I edizione - Masson SpA 2012 - II edizione ISBN 978-88-214-3249-1 I diritti di traduzione, di memorizzazione elettronica, di riproduzione e adattamento totale o parziale, con qualsiasi mezzo (compresi i microfilm e le copie fotostatiche), sono riservati per tutti i Paesi. Le fotocopie per uso personale del lettore possono essere effettuate nei limiti del 15% di ciascun volume dietro pagamento alla SIAE del compenso previsto dall’art. 68, commi 4 e 5, della legge 22 aprile 1941 n. 633. Le fotocopie effettuate per finalità di carattere professionale, economico o commerciale o comunque per uso diverso da quello personale possono essere effettuate a seguito di specifica autorizzazione rilasciata da CLEARedi, Centro Licenze e Autorizzazioni per le Riproduzioni Editoriali, Corso di Porta Romana 108, 20122 Milano, e-mail [email protected] e sito web www.clearedi.org. La medicina è una scienza in continua evoluzione. La ricerca e l’esperienza clinica ampliano costantemente le nostre conoscenze, soprattutto in relazione alle modalità terapeutiche e alla farmacologia. Qualora il testo faccia riferimento al dosaggio o alla posologia di farmaci, il lettore può essere certo che autori, curatori ed editore hanno fatto il possibile per garantire che tali riferimenti siano conformi allo stato delle conoscenze al momento della pubblicazione del libro. Tuttavia, si consiglia il lettore di leggere attentamente i foglietti illustrativi dei farmaci per verificare personalmente se i dosaggi raccomandati o le controindicazioni specificate differiscano da quanto indicato nel testo. Ciò è particolarmente importante nel caso di farmaci usati raramente o immessi di recente sul mercato. Elsevier Srl Via Paleocapa 7, 20121 Milano Tel. 02.88.184.1 www.elsevier.it Printed in China Finito di stampare nel mese di marzo 2012 presso “1010 Printing International” Limited, Hong Kong CURATORI DELL’EDIZIONE ITALIANA Eugenio Gaudio Professore Ordinario di Anatomia Umana Preside della Facoltà di Medicina e Farmacia Sapienza Università di Roma Presidente della Società Italiana di Anatomia e Istologia ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA C0080.indd v Claudio Terzano Professore di ruolo in Malattie dell’Apparato Respiratorio Direttore della I Scuola di Specializzazione in Malattie dell’Apparato Respiratorio, Sapienza Università di Roma Direttore dell’Unità Operativa Complessa (UOC) Malattie Respiratorie, Umberto I Policlinico di Roma v 2/10/12 4:34:17 PM PRESENTAZIONE DELL’EDIZIONE ITALIANA L a collana di Anatomia, Fisiopatologia e Clinica illustrata dalle famose tavole di Frank H. Netter è diventata negli anni leggendaria, oltre a essere un punto di riferimento per gli studenti, gli studiosi e i professionisti medici. La caratteristica fondamentale delle tavole del Dr. Netter è stata quella di unire felicemente la chiarezza del disegno con la bellezza artistica e la precisione scientifica dello specifico problema medico affrontato. Era pertanto molto attesa e matura la presentazione di una seconda edizione che, assieme alle storiche e immortali tavole di Netter, comprendesse un doveroso aggiornamento dei testi, adeguati al tumultuoso rinnovamento delle informazioni, assieme alla presenza di nuove illustrazioni. Il Dr. Carlos Machado, a volte affiancato da altri autori, si è rivelato il degno successore di Netter, del quale ha saputo ereditare la felice fusione di scienza, arte e chiarezza espositiva: il lettore potrà apprezzarne i pregevoli risultati e la feconda comunicativa. Altra caratteristica chiave dell’opera è stata, ed è rimasta, l’organizzazione sistematica, che prevede l’inserimento delle materie di base in un contesto clinico armonizzando, secondo i più moderni concetti dell’andragogia medica, le nozioni di anatomia, fisiologia e patologia con quelle più squisitamente cliniche. L’opera comprende numerose tabelle riassuntive che illustrano alcuni meccanismi fisiopatologici fondamentali, assieme a nuove tavole che trattano argomenti completamente nuovi rispetto alle precedenti edizioni e a utilissime tabelle di epidemiologia che illustrano in maniera chiara la correlazione fra dati vi C0035.indd vi semeiologici e analitici e la manifestazione clinica delle patologie relative. Molto interessante e utile appare la novità introdotta dalla comparazione tra disegni e imaging diagnostico (RM, TC, angiografia, ecc), così come l’introduzione di nuove procedure chirurgiche e di novità terapeutiche. Alla nuova edizione italiana ha collaborato un board costituito dai più illustri Professori universitari specialisti dei rispettivi settori scientifici, con un coordinamento editoriale che ha garantito omogeneità e uniformità dell’impostazione e della trattazione, assieme alla correttezza della terminologia utilizzata, che si è allineata a quella internazionale. È doveroso in questa sede ricordare le numerose revisioni e integrazioni operate dai curatori italiani: la revisione dell’epidemiologia, riportata da quella statunitense a quella europea e italiana; la revisione di alcune parti della patogenesi, della clinica e della farmacologia clinica; l’aggiunta di nuovi paragrafi, come quello sulla ventilazione meccanica non invasiva, che hanno arricchito e reso ancora più attuale il testo. Sono stato, quindi, particolarmente onorato dalla proposta dell’Editore di curare questa nuova edizione, che, sono certo, troverà un’entusiastica accoglienza da parte del mondo medico italiano, in particolare da parte degli studenti, degli specializzandi e dei professionisti che vogliano in modo agevole, e al contempo scientificamente corretto e aggiornato, inquadrare le basi anatomiche, fisiopatologiche e cliniche delle patologie dell’uomo. Eugenio Gaudio ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 2/10/12 3:31:15 PM PRESENTAZIONE DELL’EDIZIONE AMERICANA M Autoritratto: Il Dr. Frank Netter al lavoro. L’opera in un unico volume, il “Blue book”, che ha aperto la strada alla serie in più volumi della Netter Collection of Medical Illustrations, conosciuta anche con l’affettuoso appellativo di “Green books”. ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA C0040.indd vii edico, artista e docente. Il Dr. Frank H. Netter non soltanto possedeva ciascuna di queste tre distinte vocazioni, ma – cosa più importante – seppe abilmente riunirle. Alla base della sua attività di illustratore c’è sempre stato uno studio meticoloso delle forme del corpo umano, una filosofia da cui non avrebbero potuto prescindere le sue vaste e approfondite conoscenze mediche. “Chiarire un argomento è il motivo e lo scopo dell’illustrazione”, amava ripetere. “Un soggetto, anche se magnificamente dipinto o reso con grande precisione, può essere, come illustrazione medica, di scarso valore se non serve a chiarire qualche concetto di medicina”. Principale missione del Dr. Netter – e suo maggiore successo – fu dunque trovare un compromesso tra la chiarezza raffigurativa e la complessità dei concetti da illustrare, di cui è testimonianza questa collana inaugurata nel 1948 con la pubblicazione della prima collezione completa dei lavori del Dr. Netter in un unico volume. Il successo del progetto, finanziato dalla CIBA Pharmaceuticals, fu tale che nei quarant’anni a seguire la collezione venne ampliata in una collana di otto volumi, ciascuno dedicato a uno specifico apparato del corpo umano. In questa seconda edizione della leggendaria collana siamo lieti di proporre l’intramontabile opera del Dr. Netter in una nuova veste, arricchita con testi aggiornati e immagini radiologiche fornite da luminari e docenti dei più rinomati istituti medici di tutto il mondo e completata con nuove tavole realizzate nell’autentico spirito Netter. Studenti e medici troveranno, raccolte in un elegante volume dalla classica copertina verde, centinaia di tavole originali – il corpo umano illustrato – affiancate dalle più moderne nozioni scientifiche, rigorosamente nell’ineguagliabile stile Netter. Carlos Machado, MD, noto medico e illustratore nonché principale successore del Dr. Netter – a cui è stato affidato il compito di portare avanti questo importante lascito – mostra grande apprezzamento per la serie dei “Green books”: “Il volume sull’apparato genitale ha un valore particolare per chi, come me, nutre una profonda ammirazione per il lavoro del Dr. Netter. In questo volume, infatti, egli dimostra tutta la sua padronanza nella rappresentazione delle texture delle diverse superfici, ciò che mi piace chiamare ‘il ritmo del pennello’, perché è proprio la dimensione, la direzione delle pennellate e l’intervallo che le separa a creare l’illusione della texture: le superfici esterne degli organi, le superfici delle cavità interne e la texture dei parenchimi sono rappresentate in una maniera assolutamente realistica. Questo volume pone le basi, per quel che riguarda lo stile, per i successivi titoli della Netter Collection, ciascuno dei quali rappresenta una mirabile combinazione di capolavori pittorici e accurati contenuti scientifici”. Benché la scienza e l’insegnamento della medicina siano territori in continua evoluzione per quanto riguarda la terminologia, le pratiche e i concetti stessi, alcune cose non cambiano. Un paziente rimane un paziente. Un docente rimane un docente. E le tavole del Dr. Netter – che egli era solito chiamare “disegni”, mai “dipinti” – continuano a essere quel perfetto connubio tra arte e didattica che per oltre mezzo secolo ha guidato la mano dei medici e alimentato la loro immaginazione. La serie originale non sarebbe esistita senza l’impegno di tutti coloro che hanno curato, redatto o in altro modo contribuito ai volumi, né tanto meno senza le straordinarie qualità del Dr. Netter. Per questa seconda edizione desideriamo inoltre esprimere la nostra gratitudine agli autori, ai curatori, ai consulenti e agli artisti che si sono prodigati per fare di queste opere intramontabili uno strumento di riferimento sempre al passo con i tempi, al servizio di specializzandi e medici affermati. Da tutti noi del Netter Publishing Team di Elsevier, un sincero grazie. Il complesso di Carney è caratterizzat o da pigmentazione cutanea a chiazze. È possibile rilevare efelidi pigmentat e e nevi blu sul viso − incluse palpebre, bordi vermigli delle labbra , congiuntive, sclera − nonché su labbra e scrot o Altre caratteristiche del complesso di Carney possono essere: Mixomi: dell’atrio cardiaco, cutanei (ad es. delle palpebre) e mammari Tumori a grandi cellule di Sertoli calcifici Adenomi ipofisari GH-secernenti Schwannomi melanocitici psammomatosi Le ghiandole surrenali affette da PPNAD sono generalmente di dimensioni normali e per la maggior parte sono costellate di noduli neri, marroni o rossi. La maggior parte dei noduli pigmentati ha un diametro inferiore a 4 mm ed è incastonata nella corticale atrofica omolaterale Una nuova esclusiva tavola realizzata da Carlos Machado, MD, per la Netter Collection of Medical Illustrations – Endocrine System, ed. 2. Il Dr. Carlos Machado all’opera. vii 2/10/12 3:34:57 PM CURATORE DELL’EDIZIONE AMERICANA D avid A. Kaminsky, MD, è Professore associato di Pneumologia e medicina critica allo University of Vermont College of Medicine. Dopo la laurea presso la Yale University, si specializza alla University of Massachusetts Medical School e, una volta concluso l’internato in Medicina interna presso il Columbia Presbyterian Medical Center di New York City, viene ammesso alla fellowship clinica in Pneumologia e medicina critica dello University of Colorado Health Sciences Center di Denver. Accede alla facoltà dello University of Vermont College of Medicine nel 1995 e continua a praticare l’attività medica e a dedicarsi alla ricerca e all’insegnamento. Kaminsky è Clinical Director del Pulmonary Function Lab, Program Director del Fellowship Training Program in Pulmonary and Critical Care e Associate Chair dell’Institutional Review Board presso la University of Vermont. Le sue aree di interesse nell’ambito della ricerca includono la fisiologia polmonare, la meccanica polmonare, l’asma e la BPCO. Le sue attività sono finanziate dal National Institutes of Health, dall’American Lung Association, dalla Whittaker Foundation e da altre agenzie. Kaminsky ha pubblicato circa 40 articoli scientifici originali, ha fornito contributi per svariate pubblicazioni e firmato diverse rassegne. Vive con la moglie e i due figli, due gatti e un cane, nei pressi di Burlington, nello stato del Vermont, dove pratica numerose attività all’aperto, tra cui corsa, escursionismo, velismo, canottaggio e hockey su ghiaccio. viii C0045.indd viii ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 2/10/12 3:40:28 PM PREFAZIONE ALL’EDIZIONE AMERICANA L’ invito a curare questa seconda edizione del volume sull’apparato respiratorio – frutto della prima importante revisione da trent’anni a questa parte – della Netter Collection è stato per me un onore. Nei tre decenni trascorsi abbiamo assistito a profondi cambiamenti nel campo della pneumologia. Accettare la curatela di questa edizione significava, dunque, assumersi l’impegno di aggiornarne i contenuti per includere i progressi recenti, preservando al contempo le peculiarità e la valenza artistica dell’approccio di Netter. Le sezioni dedicate all’anatomia e alla fisiologia sono state verificate per confermarne la completezza e la pertinenza, mentre hanno subito una significativa revisione le sezioni relative alle vie aeree, alle malattie parenchimali e pleuriche, al cancro del polmone, alle malattie infettive e alle condizioni tromboemboliche, alle patologie da inalazione, alla sindrome da distress respiratorio acuto, alla farmacoterapia, alla radiologia, alla ventilazione meccanica, al trauma e alla chirurgia. Sono state inoltre introdotte nuove sezioni sull’immunologia e sull’ipertensione polmonare, sulle manifestazioni polmonari della malattia sistemica, sulla medicina del sonno, sull’esame dell’espirato, sull’ecografia endobronchiale e sull’ecografia toracoscopica video-assistita, sulla chirurgia di riduzione del volume ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA C0050.indd ix polmonare e sul trapianto del polmone. Non posso esimermi dall’esprimere la mia gratitudine nei confronti dei numerosi professionisti – esperti di fama mondiale nel loro specifico campo – che hanno accettato di offrire un personale contributo a questa edizione. Senza la loro partecipazione sarebbe stato impossibile traghettare l’opera di Netter nel XXI secolo, offrendo al lettore una trattazione accurata e aggiornata, al passo con le più recenti evoluzioni. È mio desiderio ringraziare, in particolare, quelle persone che, negli anni, sono state per me insegnanti e mentori: Dr. David Badesch, Dr. Jason Bates, Dr. Gerry Davis, Dr. Barry Make, Dr. Ted Marcy, Dr. Polly Parsons, Dr. Charlie Irvin, Dr. Richard Irwin, Dr. Mike Iseman e Dr. Talmadge King. Un ringraziamento speciale, inoltre, va al Dr. Jeffrey Klein, il cui impegno ci ha permesso di arricchire molte sezioni di questo volume con autentiche immagini radiografiche. Da ultimo, mi è gradito dedicare quest’opera a mio nonno, il Dr. Edward Budnitz, che, trasmettendomi il suo amore per la medicina, mi ha spinto a intraprendere la carriera di medico. David A. Kaminsky, MD Burlington, Vermont Novembre 2010 ix 2/10/12 3:44:16 PM L’ARTISTA L (Dalla prima edizione americana) e illustrazioni del Dr. Frank H. Netter sono elogiate così entusiasticamente dai medici di tutto il mondo e da così lungo tempo che l’immagine dell’uomo ha cominciato ad assumere le proporzioni del mito. Come possa avere avuto luogo una trasformazione simile non è cosa difficile da capire. Eppure, il Dr. Netter è una persona normale, come normale è la vita che conduce, ragione per cui egli stesso si trova in un certo qual modo in soggezione rispetto all’immagine che tanto spesso gli viene attribuita. Per aiutarlo a riaffermare la sua realtà di uomo normale, gli abbiamo chiesto di realizzare un ritratto di se stesso al lavoro. Lo schizzo raffigura vari elementi che risulteranno familiari a coloro che hanno visto le fotografie dello studio del Dr. Netter nei precedenti volumi della CIBA Collection of Medical Illustrations o in altre pubblicazioni: l’artista, il tavolo da disegno, le illustrazioni, i pennelli, lo scheletro del corpo umano e il resto dell’armamentario. La differenza sta nello sfondo: lo skyline di New York che prima si intravvedeva fuori dalla finestra dello studio lascia ora il posto al paesaggio soleggiato della Florida meridionale, con le palme e una barca che solca le acque dell’Intracoastal Waterway. Il trasferimento della famiglia Netter al Sud dopo tanti anni di vita nella Grande Mela non cela tuttavia l’intenzione di rallentare il ritmo di un’attività altamente prolifica. Ha certamente implicato un cambiamento di ambiente e di clima, ma la dedizione di Frank Netter a ciò che è infine diventato il lavoro della sua vita rimane quella di sempre. Le giornate iniziano generalmente alle 7, orario in cui il Dr. x C0055.indd x Netter entra in studio per rimanervi, lavorando alacremente, fino alle 14. I pomeriggi sono perlopiù dedicati al golf, al nuoto in mare o in piscina, alla pesca, alla famiglia, agli amici e ad altri diversivi come, perché no, alla riproduzione di un paesaggio o alla creazione di un ritratto per personale diletto. Ma l’attività del Dr. Netter non si esaurisce al tavolo da disegno. Una parte consistente è dedicata allo studio nonché alla lettura e all’osservazione diretta dei medici in clinica, in ospedale o in laboratorio, e a lunghi confronti con i collaboratori. L’attività di illustratore non abbandona i pensieri del Dr. Netter nemmeno durante le ore libere. A queste fasi preliminari segue la realizzazione dei bozzetti a matita, la definizione dei dettagli e del layout dei vari elementi delle illustrazioni, la collocazione di radiografie e micrografie e la scelta delle dimensioni precise e dell’esatta posizione delle legende allo scopo di ottenere il migliore risultato didattico. Solo dopo avere ripetutamente verificato i bozzetti, con particolare attenzione ai dettagli e alla fedeltà, procede con la colorazione della tavola. Per la maggior parte delle illustrazioni utilizza la tecnica ad acquerello, ma in alcuni casi si avvale anche di altri strumenti, tra cui la tempera, il gesso, i colori acrilici o la pittura a olio. Non è il mezzo, a ogni modo, ciò che conta; un buon disegno può essere realizzato con qualsiasi tecnica: era questa l’opinione del Dr. Netter. La sua preferenza per gli acquerelli era semplicemente dovuta al fatto che era la tecnica a lui più familiare, quella utilizzata da più tempo, e che quindi gli consentiva di esprimersi meglio e di lavorare più rapidamente. L’indiscutibile abilità e maestria del Dr. Netter nel campo del disegno figurativo, certamente un dono, non avrebbe comunque portato i risultati che oggi abbiamo l’opportunità di apprezzare senza uno studio e un allenamento continui, non soltanto nel disegno e nella pittura ma anche nella progettazione grafica, nella composizione e nell’impaginazione. Diventare un artista era il sogno di bambino del Dr. Netter, che per realizzarlo frequentò con grande dedizione la National Academy of Design, l’Art Students League of New York e altre scuole di prim’ordine, prendendo anche lezioni private. Con il tempo si fece una reputazione, che gli consentì di intraprendere una carriera da disegnatore pubblicitario negli anni d’oro di tale professione. Successivamente, però, in parte per assecondare un suo maggiore interesse personale e in parte per soddisfare le attese dei familiari che lo spingevano a dedicarsi a “qualcosa di più serio”, decise di mettere da parte l’attività artistica e di iniziare una nuova carriera nel campo della medicina. Ma fu proprio durante gli anni alla scuola di medicina che scoprì, per via dei suoi trascorsi nel mondo della grafica, l’utilità del disegno ai fini dell’apprendimento. Le prime illustrazioni scientifiche, dunque, le realizzò per se stesso; ma non trascorse molto tempo prima che i suoi lavori catturassero l’attenzione dei docenti, i quali cominciarono a commissionargli, nel poco tempo libero che gli restava, la realizzazione di illustrazioni per i loro libri e i loro articoli. Netter si laureò alla School of Medicine e portò a termine l’internato e la specializzazione presso il Bellevue Hospital negli anni più cupi della Grande Depressione. Presto divenne evidente che gli incarichi ricevuti dagli editori e dalle aziende farmaceutiche costituivano, in un momento economico tanto difficile, una fonte di reddito decisamente migliore della carriera medica e così decise di dedicarvisi a tempo pieno. La collaborazione tra il Dr. Netter e la CIBA Pharmaceutical Company ebbe inizio nel 1938 con la creazione di un opuscolo decisamente fuori dal comune: sagomato, a forma di cuore, recava sulla prima e sulla quarta di copertina, rispettivamente, l’immagine della superficie anteriore e posteriore (basale) dell’organo, mentre le pagine interne contenevano alcune sezioni anatomiche del cuore su cui era sovraimpresso un messaggio pubblicitario. La risposta della comunità medica non si fece attendere: all’azienda fu chiesto di produrre l’articolo senza il messaggio pubblicitario. Così vide la luce una serie di progetti illustrati di anatomia e patologia, per i quali la richiesta era talmente forte che nel 1948 fu decisa la pubblicazione del primo volume della CIBA Collection of Medical Illustrations. Altra data importante fu il 1978 che, oltre a coincidere con l’anno di pubblicazione del Volume n. 7, dedicato all’apparato respiratorio, celebrava anche il trentesimo anniversario dell’uscita del primo volume della CIBA Collection of Medical Illustrations, nonché il trentesimo anniversario della pubblicazione del primo elemento della serie CIBA Clinical Symposia. Il Dr. Netter, che ogni anno realizza ben oltre 100 tavole per la CIBA Collection of Medical Illustrations e per i Clinical Symposia, è al momento impegnato nell’illustrazione di un nuovo volume sull’apparato muscoloscheletrico. Molte parole sono state spese in passato sul “genio” di Netter, ma forse l’aspetto più stupefacente non è tanto il suo “genio” quanto piuttosto il modo in cui questo artista, medico e docente ha saputo mettere a frutto le sue doti. La sua opera, già monumentale, non cessa di prolificare. Philip B. Flagler ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 2/10/12 3:47:56 PM INTRODUZIONE ALLA PRIMA EDIZIONE AMERICANA A lla pubblicazione di ogni nuovo volume mi sento come immagino debba sentirsi una donna che ha appena avuto un bambino. Le fatiche e i travagli della lunga gravidanza e il dolore del parto sono alle spalle; non resta che vedere in che modo la propria creatura se la caverà nel mondo. La gestazione di questo volume è stata accompagnata da non pochi problemi. Tra questi, il fatto che negli ultimi anni l’interesse per il sistema respiratorio e le sue patologie non soltanto è cresciuto enormemente ma è andato concentrandosi su aspetti del tutto diversi. Le ragioni sono svariate e hanno a che fare con le notevoli differenze emerse nell’incidenza delle pneumopatie, l’avvento e l’uso più mirato degli antibiotici, i progressi compiuti nel campo della radiologia e nell’interpretazione dei reperti radiologici, lo sviluppo di nuove tecniche diagnostiche come, ad esempio, l’imaging con isotopi radioattivi, il più ampio spazio dato allo studio della fisiologia polmonare e all’applicazione degli esami di funzionalità respiratoria, i progressi nella comprensione della patologia polmonare, il maggiore accesso alla chirurgia toracica e lo sviluppo di metodi per predeterminare l’operabilità quali, ad esempio, la mediastinoscopia, l’elaborazione e il perfezionamento di strumenti tecnici e diagnostici come i dispositivi per la somministrazione di ossigeno e aerosol, i sistemi di ventilazione meccanica, nonché spirometri e suturatrici chirurgiche più efficienti; e infine i cambiamenti occorsi nello stile di vita, nell’ambiente e nell’età media della popolazione. Si consideri, poi, che tutti questi fattori, come altri qui non menzionati, interagiscono fra loro: la notevole riduzione dell’incidenza di tubercolosi polmonare, ad esempio, è riconducibile all’avvento degli antibiotici ma è altresì una conseguenza del miglioramento delle abitudini e degli standard di vita nonché dei progressi compiuti nel campo della diagnosi precoce, fattori che a loro volta possono essere ritenuti responsabili della minore incidenza e morbilità della polmonite pneumococcica. Il risultato è che due malattie che in passato costituivano una forte preoccupazione sanitaria oggi risultano molto meno rilevanti, il che ha consentito di dedicare maggiore tempo e attenzioni ad altre pneumopatie. L’incidenza notevolmente accresciuta del tumore del polmone sembra essere, in larga misura, una conseguenza dei cambiamenti avvenuti nelle abitudini (il fumo, ad esempio), dell’inquinamento ambientale e delle attività occupazionali nonché, con ogni probabilità, dell’innalzamento dell’aspettativa di vita. Ma la capacità di individuare più precocemente un tumore – anche grazie alla maggiore sensibilizzazione pubblica e a tecniche diagnostiche sempre più raffinate – sommata alle aumentate possibilità chirurgiche, ha stimolato l’interesse per l’operabilità, cosa che, a sua volta, ha incoraggiato lo studio della classificazione patologica in relazione alla malignità. Il moltiplicarsi dei casi di bronchite cronica e di enfisema, per quanto in larga parte reale e riconducibile agli stessi fattori eziologici valevoli per il tumore, può essere in una certa misura solo apparente, in quanto correlato al perfezionamento delle tecniche diagnostiche e al migliore impiego degli esami di funzionalità respiratoria. Ma il riconoscimento di determinati fattori eziologici e una più chiara comprensione dei processi patologici sottostanti, sommati alla disponibilità e all’utilizzo di risorse quali agenti per inalazione, dispositivi perfezionati per la somministrazione di ossigeno e per la ventilazione meccanica e il drenaggio posturale, hanno profondamente migliorato la gestione di questi penosi disturbi. Allo stesso modo, anche l’incidenza, oggi relativamente elevata, delle malattie occupazionali potrebbe essere in una certa misura fittizia, per via della migliore conoscenza della patologia e delle maggiori possibilità diagnostiche. L’identificazione delle fonti più comuni di embolia e la più accurata definizione delle ma- ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA C0060.indd xi nifestazioni di ostruzione vascolare polmonare hanno inoltre stimolato l’interesse per l’embolia e l’infarto polmonare. Alla luce di tali esempi – cui se ne potrebbero aggiungere molti altri – e testimonianze dei cambiamenti occorsi nel campo della pneumologia, ho cercato di ricollocare i singoli argomenti nella giusta prospettiva, attribuendo a ciascuno l’esatto peso rispetto al macrosoggetto, in accordo con le concezioni attuali. Nel perseguire tale intento è stato però necessario fare i conti con la disponibilità di spazio. Così come un buon oratore deve essere in grado di trasmettere i concetti fondamentali del suo messaggio nel tempo che gli è accordato affinché il pubblico non si perda in divagazioni superflue e il messaggio arrivi in maniera efficace, l’artista deve saper ritrarre il proprio soggetto nella maniera più incisiva possibile all’interno delle pagine concessegli. In assenza di tali vincoli il volume sarebbe cresciuto a dismisura, perdendo così il proprio equilibrio, o sarebbe diventato a tal punto affollato di minuzie da risultare sconclusionato e tedioso. In entrambi i casi, l’utilità del libro ne sarebbe uscita gravemente compromessa. Come nella preparazione di tutti gli atlanti precedenti, il massimo impegno è stato inevitabilmente profuso nella raccolta, nell’assimilazione e nell’elaborazione delle informazioni necessarie per assicurare una trattazione adeguata di ciascun soggetto, al punto che questo lavoro di studio, approfondimento e analisi è arrivato ad assorbire una quantità di tempo pari, se non superiore, a quella dedicata all’effettiva realizzazione delle tavole. Perché non si può descrivere in maniera efficace un argomento senza averlo anzitutto compreso. Il mio obiettivo è stato illustrare o schematizzare l’essenza di ciascun soggetto evitando tutto ciò che potesse risultare accessorio e irrilevante. In alcuni casi, però, ho incluso argomenti che al momento non sembrano trovare particolari applicazioni pratiche ma che, in futuro, potrebbero fornire importanti spunti in relazione alla patogenesi, alla diagnosi o al trattamento. Devo precisare che tutto ciò è stato estremamente facilitato, anzi reso possibile, dalla viva collaborazione dei numerosi e prestigiosi consulenti che verranno singolarmente menzionati nelle prossime pagine. Mi sia concesso, in questo spazio, di esprimere la mia riconoscenza a ciascuno di loro per il tempo e l’impegno profusi, per le indicazioni che mi hanno fornito e per le conoscenze che mi hanno trasmesso. È inoltre mio desiderio ringraziare tutti coloro che, pur non figurando ufficialmente come consulenti, mi hanno comunque offerto informazioni, consigli e materiale di riferimento. Anche a loro sarà dedicato uno spazio. Un ringraziamento speciale va al Dr. Matthew B. Divertie per la revisione accurata e puntuale del materiale, delle illustrazioni come anche dei testi, e per i numerosi suggerimenti costruttivi. La realizzazione di questo volume ha implicato un’incredibile mole di lavoro logistico per l’assemblaggio e la compilazione del materiale, la combinazione di illustrazioni e testo, il controllo dell’accuratezza grammaticale e dei riferimenti bibliografici, la gestione degli aspetti più squisitamente tipografici e redazionali e una moltitudine di dettagli tecnici e pratici connessi alla pubblicazione. Merita tutta la mia ammirazione la professionalità con cui questi aspetti sono stati gestiti da Philip Flagler e dal suo staff in CIBA, senza dimenticare il contributo di Gina Dingle, Barbara Bekiesz, Kristine Bean e Pierre Lair. Da ultimo, mi è gradito ancora una volta encomiare la CIBA Pharmaceutical Company e i suoi dirigenti per la lungimiranza dimostrata nello sponsorizzare questo progetto e per la libertà di azione che ci hanno concesso. Con tutti i miei sforzi ho cercato di rendere loro onore. Frank H. Netter, MD xi 2/10/12 3:52:47 PM COMITATO SCIENTIFICO Gillian Ainslie, MBChB, MRCP, FRCP Associate Professor and Acting Head Respiratory Clinic, Groote Schuur Hospital University of Cape Town Lung Institute Cape Town, South Africa Koichiro Asano, MD Division of Pulmonary Shinjuku-ku, Tokyo, Japan Eric D. Bateman, MBChB, MD, FRCP, DCH Professor of Respiratory Medicine Respiratory Clinic, Groote Schuur Hospital University of Cape Town Lung Institute Cape Town, South Africa John E. Heffner, MD William M. Garnjobst Chair of Medical Education Pulmonary and Critical Care Medicine Providence Portland Medical Center Oregon Health and Sciences University Portland, Oregon Surinder K. Jindal, MD, FCCP Professor and Head, Department of Pulmonary Medicine Postgraduate Institute of Medical Education and Research Chandigarh, India Santos Guzmán López, MD Jefe del Departamento de Anatomía Universidad Autónoma de Nuevo León Facultad de Medicina Monterrey, Nuevo León, Mexico xii C0065.indd xii ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 2/10/12 3:55:33 PM COLLABORATORI Steven H. Abman, MD Professor Department of Pediatrics, Section of Pulmonology University of Colorado School of Medicine and The Children’s Hospital, Aurora, Colorado Tavole 1.33-1.43 David B. Badesch, MD Professor of Medicine Division of Pulmonary Sciences and Critical Care Medicine and Cardiology Clinical Director, Pulmonary Hypertension Center University of Colorado Denver Aurora, Colorado Tavole 4.114-4.126 Peter J. Barnes, DM, DSc, FRCP, FMedSci, FRS Head of Respiratory Medicine National Heart and Lung Institute Imperial College London, England, UK Tavole 2.22-2.24, 5.1-5.10 Jason H.T. Bates, PhD, DSc Professor of Medicine, Physiology, Biophysics University of Vermont College of Medicine Burlington, Vermont Tavole 2.14-2.21 Kevin K. Brown, MD Professor of Medicine Vice Chairman, Department of Medicine Director, Interstitial Lung Disease Program National Jewish Medical and Research Center Denver, Colorado Tavole 4.157-4.162 Vito Brusasco, MD Professor of Respiratory Medicine University of Genoa Genoa, Italy Tavole 2.8-2.13 Nancy A. Collop, MD Professor of Sleep Medicine and Neurology Director, Emory Sleep Program Emory University Atlanta, Georgia Tavole 4.165-4.166 Bryan Corrin, MD, FRCPath Professor Emeritus of Pathology London University Honorary Senior Clinical Research Fellow National Heart and Lung Institute Imperial College Honorary Consultant Pathologist Royal Brompton Hospital London, England, UK Tavole 1.1-1.16 ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA C0070.indd xiii Gerald S. Davis, MD Professor of Medicine Pulmonary Disease and Critical Care Medicine University of Vermont College of Medicine Fletcher Allen Health Care Burlington, Vermont Tavole 4.103-4.113 Richard S. Irwin, MD Professor of Medicine University of Massachusetts Medical School Chair, Critical Care UMass Memorial Medical Center Worcester, Massachusetts Tavola 4.10 Malcolm M. DeCamp, MD Fowler-McCormick Professor of Surgery Northwestern University Feinberg School of Medicine Chief, Division of Thoracic Surgery Northwestern Memorial Hospital Chicago, Illinois Tavole 3.26, 5.25-5.33 Michael Iseman, MD Professor of Medicine National Jewish Medical and Research Center Denver, Colorado Tavole 4.93-4.102 Raed A. Dweik, MD Director, Pulmonary Vascular Program Department of Pulmonary and Critical Care Medicine, Cleveland Clinic Cleveland, Ohio Tavola 3.20 David Feller-Kopman, MD Director, Interventional Pulmonology Associate Professor of Medicine The Johns Hopkins Hospital Baltimore, Maryland Tavole 3.21-3.25, 5.15-5.17, 5.20-5.23 Alex H. Gifford, MD Fellow, Pulmonary and Critical Care Medicine Dartmouth-Hitchcock Medical Center Lebanon, New Hampshire Tavole 2.25-2.31 Curtis Green, MD Professor of Radiology and Cardiology University of Vermont College of Medicine, Staff Radiologist Fletcher Allen Health Care Burlington, Vermont Tavole 3.4-3.19 Anne Greenough, MD (Cantab), MB BS, DCH, FRCP, FRCPCH Division of Asthma Allergy and Lung Biology, MRC, and Asthma UK Centre in Allergic Mechanisms of Asthma King’s College London Neonatal Centre King’s College Hospital Denmark Hill London, England, UK Tavole 4.1-4.9, 4.144-4.145 Charles G. Irvin, PhD Vice Chairman for Research Department of Medicine Director, Vermont Lung Center Professor, Departments of Medicine and Molecular Physiology and Biophysics University of Vermont College of Medicine Burlington, Vermont Tavole 2.1-2.7 James R. Jett, MD Professor of Medicine National Jewish Medical and Research Center Denver, Colorado Tavole 4.48-4.63 Marc A. Judson, MD Professor of Medicine Division of Pulmonary and Critical Care Medicine Medical University of South Carolina Charleston, South Carolina Tavole 4.155-4.156 David A. Kaminsky, MD Associate Professor Pulmonary and Critical Care Medicine University of Vermont College of Medicine Burlington, Vermont Tavole 3.1-3.3, 5.18 Greg King, MB, ChB, PhD, FRACP Head of Imaging Group The Woolcock Institute of Medical Research Department of Respiratory Medicine Royal North Shore Hospital St. Leonards, Australia Tavole 4.163-4.164 Talmadge E. King, MD Julius R. Krevans Distinguished Professorship in Internal Medicine Chair, Department of Medicine University of California, San Francisco San Francisco, California Tavole 4.147-4.154 Jeffrey Klein, MD Director, Thoracic Radiology Fletcher Allen Health Care Professor University of Vermont College of Medicine Burlington, Vermont Tavole 3.4-3.19 Kevin O. Leslie, MD Professor of Pathology Mayo Clinic Arizona Scottsdale, Arizona Tavole 1.17-1.31 xiii 2/10/12 3:59:42 PM Collaboratori Donald A. Mahler, MD Professor of Medicine Pulmonary and Critical Care Medicine Dartmouth Medical School Dartmouth-Hitchcock Medical Center Lebanon, New Hampshire Tavole 2.25-2.31 Barry Make, MD Professor of Medicine National Jewish Medical and Research Center Denver, Colorado Tavole 5.11-5.14 Theodore W. Marcy, MD, MPH Professor of Medicine Pulmonary Disease and Critical Care Medicine Unit University of Vermont College of Medicine Burlington, Vermont Tavole 4.127-4.128, 5.24 James G. Martin, MD, DSc Director, Meakins Christie Laboratories Professor of Medicine McGill University Montreal, Quebec, Canada Tavola 1.32 Deborah H. McCollister, RN University of Colorado Health Sciences Center Denver, Colorado Tavole 4.114-4.126 Meredith C. McCormack, MD, MHS Assistant Professor of Medicine Division of Pulmonary and Critical Care Medicine Johns Hopkins University Baltimore, Maryland Tavole 4.28-4.42 Ernest Moore, MD Professor and Vice Chairman Department of Surgery University of Colorado Denver Bruce M. Rockwell Distinguished Chair in Trauma Chief of Surgery Denver Health Denver, Colorado Tavole 4.135-4.143 xiv C0070.indd xiv Michael S. Niederman, MD Chairman, Department of Medicine Winthrop-University Hospital Mineola, New York; Professor of Medicine Vice-Chairman, Department of Medicine SUNY at Stony Brook Stony Brook, New York Tavole 4.64-4.83 Paul M. O’Byrne, MB, FRCPI, FRCPC E.J. Moran Campbell Professor and Chair Department of Medicine McMaster University Hamilton, Ontario, Canada Tavole 4.14-4.27 Steven Sahn, MD Professor of Medicine Division of Pulmonary, Critical Care, Allergy, and Sleep Medicine Medical University of South Carolina Charleston, South Carolina Tavole 4.129-4.134 Sanjay Sethi, MD Professor, Department of Medicine Chief, Division of Pulmonary, Critical Care, and Sleep Medicine University at Buffalo, SUNY Section Chief, Division of Pulmonary, Critical Care and Sleep Medicine Western New York VA HealthCare System Buffalo, New York Tavole 4.84-4.92 Polly E. Parsons, MD E.L. Amidon Professor of Medicine Chair, Department of Medicine Director, Pulmonary and Critical Care Medicine University of Vermont College of Medicine Medicine Health Care Service Leader Fletcher Allen Health Care Burlington, Vermont Tavola 4.146 Damon A. Silverman, MD Assistant Professor of Otolaryngology University of Vermont College of Medicine Director, The Vermont Voice Center Fletcher Allen Health Care Burlington, Vermont Tavole 4.11-4.13, 5.19 Elena Pollina, MD Department of Histopathology King’s College Hospital London, England, UK Tavole 4.1-4.9 Robert A. Wise, MD Professor of Medicine and Environmental Health Sciences Division of Pulmonary and Critical Care Medicine Johns Hopkins University Johns Hopkins Asthma and Allergy Center Baltimore, Maryland Tavole 4.28-4.42 Catheryne J. Queen Mycobacterial and Respiratory Diseases Division National Jewish Health Medical and Research Center Denver, Colorado Tavole 4.93-4.102 Margaret Rosenfeld, MD, MPH Medical Director, Pulmonary Function Laboratory Seattle Children’s Associate Professor of Pediatrics University of Washington School of Medicine Seattle, Washington Tavole 4.43-4.47 ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 2/10/12 3:59:42 PM INDICE SEZIONE 1 SEZIONE 2 ANATOMIA ED EMBRIOLOGIA FISIOLOGIA 1.1 1.2 1.3 Fisiologia della respirazione e degli scambi gassosi 1.4 1.5 1.6 1.7 1.8 1.9 1.10 1.11 1.12 1.13 1.14 1.15 1.16 1.17 1.18 1.19 1.20 1.21 1.22 1.23 1.24 1.25 1.26 1.27 1.28 1.29 1.30 1.31 1.32 Apparato respiratorio, 3 Gabbia toracica, 4 Caratteristiche delle coste e articolazioni costo-vertebrali, 5 Parete anteriore del torace, 6 Parete anteriore del torace (Seguito), 7 Parete anteriore del torace: veduta interna, 8 Parete posteriore del torace, 9 Parete posteriore del torace: veduta posteriore, veduta laterale, 10 Nervi e arterie intercostali, 11 Diaframma (veduta dall’alto), 12 Topografia dei polmoni (veduta anteriore), 13 Topografia dei polmoni (veduta posteriore), 14 Faccia mediale dei polmoni, 15 Segmenti bronco-polmonari, 16 Segmenti polmonari in rapporto alle coste, 17 Rapporti della trachea e dei bronchi principali, 18 Arterie bronchiali, 19 Mediastino: veduta laterale destra, 20 Mediastino: veduta laterale sinistra, 21 Innervazione dei polmoni e dell’albero tracheo-bronchiale, 22 Struttura della trachea e dei bronchi maggiori, 23 Vie aeree intrapolmonari, 24 Struttura dei bronchi e dei bronchioli in microscopia ottica, 25 Ultrastruttura dell’epitelio tracheale, bronchiale e bronchiolare, 26 Ghiandole sottomucose bronchiali, 27 Circolazione sanguigna intrapolmonare, 28 Ultrastruttura dell’unità alveolo-capillare: ultrastruttura degli alveoli e dei capillari polmonari, 29 Ultrastruttura dell’unità alveolo-capillare: cellula alveolare di tipo II e strato superficiale attivo, 30 Ultrastruttura dell’unità alveolo-capillare: endotelio dei vasi polmonari, 31 Drenaggio linfatico dei polmoni e della pleura, 32 Drenaggio linfatico dei polmoni e della pleura: distribuzione dei vasi linfatici nei polmoni e nelle pleure, 33 Immunologia polmonare: linfociti, mastociti, eosinofili e neutrofili, 34 Sviluppo dell’apparato respiratorio 1.33 1.34 1.35 1.36 1.37 1.38 1.39 1.40 1.41 1.42 1.43 Sviluppo delle vie respiratorie e della faringe, 35 Apparato respiratorio a 5-6 settimane, 36 Apparato respiratorio a 6-7 settimane, 37 Laringe, albero tracheo-bronchiale e polmoni a 7-10 settimane, 38 Sezione sagittale a 6-7 settimane, 39 Sezione trasversale a 5-8 settimane, 40 Diaframma a 5-6 settimane, 41 Condotto aereo terminale, 42 Rapporti alveolo-capillari all’età di 8 anni, 43 Effetti del surfattante, 44 Fisiologia della circolazione polmonare perinatale, 45 ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA C0075.indd xv 2.1 2.2 2.3 2.4 2.5 2.6 2.7 2.8 2.9 2.10 2.11 2.12 2.13 2.14 2.15 2.16 2.17 2.18 2.19 2.20 2.21 2.22 Muscoli respiratori, 49 Spirometria: volumi polmonari e misurazioni, 50 Determinazione della capacità funzionale residua (CFR), 51 Forze durante la respirazione regolare, 52 Misurazione delle proprietà elastiche del polmone, 53 Forze di superficie nel polmone, 54 Proprietà elastiche dell’apparato respiratorio: polmone e parete toracica, 55 Distribuzione della resistenza delle vie aeree, 56 Regimi del flusso d’aria, 57 Flusso espiratorio, 58 Manovra per la misurazione della capacità vitale nell’espirazione forzata, 59 Lavoro di respirazione, 60 Gradiente di pressione pleurica e volume di chiusura, 61 Distribuzione del flusso sanguigno polmonare, 62 Resistenza vascolare polmonare, 63 Vie di diffusione e passaggio di O2 e CO2, 64 Rapporto sangue-gas durante la ventilazione normale e l’ipoventilazione alveolare, 65 Rapporti ventilazione-perfusione, 66 Shunt, 67 Trasporto dell’ossigeno, 68 Ruolo dei polmoni e dei reni nella regolazione dell’equilibrio acido-base, 69 Risposta a lesioni ossidanti, 70 Metabolismo polmonare 2.23 2.24 Inattivazione delle sostanze vasoattive circolanti, 71 Attivazione dei precursori circolanti delle sostanze vasoattive, 72 Controllo e disturbi della respirazione 2.25 2.26 2.27 2.28 2.29 2.30 2.31 Controllo chimico della respirazione (meccanismo di feedback), 73 Controllo nervoso della respirazione, 74 Risposta respiratoria durante l’esercizio, 75 Effetti dell’altitudine elevata sul meccanismo respiratorio, 76 Iperventilazione e ipoventilazione, 77 Respiro periodico (di Cheyne-Stokes), 78 Localizzazione dei disturbi patologici del controllo della respirazione, 79 SEZIONE 3 PROCEDURE DIAGNOSTICHE 3.1-3.3 Test di funzionalità polmonare, 82 3.7 3.8 3.9 3.10 3.11 3.12 3.13 3.14 3.15 3.16 3.17 3.18 3.19 3.20 Procedure endoscopiche 3.21 3.22 3.23 3.24 3.25 3.26 3.5 3.6 Veduta postero-anteriore (PA) e laterale di un torace normale, 85 Veduta in decubito laterale, 86 Tecnica della tomografia computerizzata (TC) spirale, 87 Fibrobroncoscopia, 102 Vedute broncoscopiche, 103 Nomenclatura dei bronchi periferici, 104 Broncoscopia rigida, 105 Ecografia endobronchiale, 106 Mediastinotomia e mediastinoscopia, 107 SEZIONE 4 MALATTIE E ANATOMIA PATOLOGICA Malattie polmonari congenite 4.1 4.2 4.3 4.4 4.5 4.6 4.7 4.8 4.9 4.10 Deformità congenite della gabbia toracica, 111 Anatomia patologica della cifoscoliosi, 112 Funzionalità polmonare nella cifoscoliosi, 113 Ernia diaframmatica congenita, 114 Fistole tracheo-esofagee e anomalie tracheali, 115 Agenesia, aplasia e ipoplasia polmonari, 116 Cisti polmonari congenite, 117 Sequestro polmonare, 118 Enfisema lobare congenito, 119 Tosse cronica, 120 Lesioni della laringe 4.11 4.12 4.13 Lesioni laringee frequenti, 121 Stenosi laringea e tracheale, 122 Disfunzione delle corde vocali, 123 Asma bronchiale 4.14 4.15 4.16 4.17 4.18 4.19 4.20 4.21 4.22 Esame radiologico dei polmoni 3.4 Albero bronchiale destro come mostrato dai broncogrammi, 88 Albero bronchiale sinistro come mostrato dai broncogrammi, 89 Angiografia polmonare, 90 Immagini PET-TC, 91 Quadri di collasso lobare: polmone destro (secondo Lubert e Krause),92 Quadri di collasso lobare: polmone sinistro (secondo Lubert e Krause), 93 Malattia alveolare e malattia interstiziale, 94 Distribuzione dei noduli polmonari, 95 Malattia alveolare, 96 Quadri radiografici di consolidamento di singoli segmenti polmonari (vedute AP), 97 Nodulo polmonare solitario, 98 Malattie delle vie aeree e della pleura, 99 Anomalie della parete toracica e del mediastino, 100 Analisi dell’espirato, 101 4.23 4.24 4.25 Asma allergico: aspetti clinici, 124 Asma non allergico: aspetti clinici, 125 Fattori precipitanti comuni nell’eziologia dell’asma bronchiale, 126 Ostruzione variabile del flusso d’aria e iperreattività delle vie aeree, 127 Espettorato nell’asma bronchiale, 128 Test cutanei per allergie, 129 Diagnosi differenziale rappresentativa dell’asma bronchiale, 130 Rapporti tra gas e pH del sangue, 131 Fisiopatologia delle vie aeree nell’asma, 132 Meccanismi di ipersensibilità di tipo I (immediata), 133 Patologia dell’asma grave, 134 Principi generali per il trattamento dell’asma allergico, 135 xv 2/10/12 4:27:19 PM Indice 4.26 4.27 Meccanismi d’azione dei farmaci per l’asma, 136 Trattamento d’emergenza dell’asma, 137 Broncopneumopatia cronica ostruttiva 4.28 4.29 4.30 4.31 4.32 4.33 4.34 4.35 4.36 4.37 4.38 4.39 4.40 4.41 4.42 Interrelazioni tra bronchite cronica ed enfisema, 138 Enfisema, 139 Bronchite cronica, 140 Combinazione di bronchite cronica ed enfisema, 141 Cor pulmonale causato dalla BPCO, 142 Broncopneumopatia cronica ostruttiva, 143 Distribuzione anatomica dell’enfisema, 144 Enfisema centrolobulare, 145 Enfisema panlobulare, 146 BPCO: infiammazione, 147 BPCO: squilibrio proteasi-antiproteasi, 148 Funzionalità polmonare nella malattia ostruttiva, 149 Fisiopatologia dell’enfisema: perdita di retrazione elastica e iperinflazione, 150 TC ad alta risoluzione dei polmoni nella BPCO, 151 Riepilogo delle linee guida per il trattamento della BPCO, 152 Bronchiectasie 4.43 4.44 Bronchiectasia bilaterale grave, 153 Bronchiectasia localizzata, 154 Fibrosi cistica 4.45 4.46 4.47 Fisiopatologia e manifestazioni cliniche della fibrosi cistica, 155 Reperti radiografici e anatomici macroscopici del polmone nella fibrosi cistica, 156 Fibrosi cistica: aspetti clinici, 157 Cancro del polmone 4.48 4.49 4.50 4.51 4.52 4.53 4.54 4.55 Classificazione dei carcinomi broncogeni, 158 Stadiazione del cancro del polmone, 159 Carcinoma squamocellulare del polmone, 160 Adenocarcinoma polmonare, 161 Carcinomi del polmone a grandi cellule, 162 Carcinomi del polmone a piccole cellule, 163 Sindrome della vena cava superiore, 164 Tumore e sindrome di Pancoast, 165 Manifestazioni paraneoplastiche e tumori del polmone 4.56 4.57 4.58 4.59 4.60 4.61 4.62 4.63 Manifestazioni endocrine del cancro del polmone, 166 Manifestazioni neuromuscolari e a carico del tessuto connettivo, 167 Altre neoplasie polmonari, 168 Tumori benigni del polmone, 169 Mesotelioma pleurico maligno, 170 Tumori mediastinici: mediastino anteriore, 171 Mediastino posteriore e paravertebrale, 172 Metastasi polmonari, 173 Polmonite 4.64 4.65 4.66 Panoramica sulla polmonite, 174 Polmonite pneumococcica, 175 Polmonite pneumococcica (Seguito), 176 Polmonite da patogeni atipici 4.67 4.68 xvi C0075.indd xvi Polmonite da Mycoplasma, 177 Polmonite da Chlamydia psittaci, 178 4.69 4.70 4.71 4.72 Polmonite Polmonite Polmonite Polmonite da da da da Legionella, 179 Staphylococcus aureus, 180 Haemophilus influenzae, 181 batteri gram-negativi, 182 Polmonite virale acquisita in comunità 4.73 4.74 4.75 4.76 4.77 4.78 4.79 4.80 4.81 4.82 4.83 4.84 4.85 4.86 4.87 4.88 4.89 4.90 4.91 4.92 Virus dell’influenza e relativa epidemiologia, 183 Polmonite da influenza, 184 Polmonite da varicella, 185 Polmonite da citomegalovirus, 186 SARS (grave sindrome respiratoria acuta), 187 Ascesso polmonare, 188 Ascesso polmonare (Seguito), 189 Panoramica sulla polmonite associata a cure mediche, acquisita in ospedale e associata a ventilazione meccanica, 190 Esami in caso di sospetta polmonite acquisita in ospedale, 191 Polmonite nell’ospite compromesso, 192 Polmonite nell’ospite compromesso (Seguito), 193 Actinomicosi, 194 Nocardiosi, 195 Istoplasmosi, 196 Istoplasmosi (Seguito), 197 Coccidioidomicosi, 198 Blastomicosi, 199 Paracoccidioidomicosi, 200 Criptococcosi, 201 Aspergillosi, 202 Tubercolosi 4.93 4.94 4.95 Disseminazione della tubercolosi, 203 Evoluzione del tubercolo, 204 Complesso tubercolare iniziale (primario), 205 4.96 Patologia progressiva, 206 4.97 Malattia cavitaria estesa, 207 4.98 Tubercolosi miliare, 208 4.99 Test alla tubercolina, 209 4.100 Esame dell’espettorato, 210 4.101 Coltura dell’espettorato, 211 4.102 Pneumopatia da micobatteri non tubercolari, 212 Malattie da inalazione di polveri e gas 4.103 Panoramica sulle malattie da inalazione, 213 4.104 Silicosi, 214 4.105 Silicosi (Seguito), 215 4.106 Pneumoconiosi del minatore di carbone, 216 4.107 Asbestosi e malattie asbesto-correlate, 217 4.108 Asbestosi e malattie asbesto-correlate (Seguito), 218 4.109 Berillio, 219 4.110 Pneumoconiosi causata da minerali vari e polveri miste, 220 4.111 Pneumoconiosi causata da minerali vari e polveri miste (Seguito), 221 4.112 Polmonite da ipersensibilità, 222 4.113 Polmonite da ipersensibilità (Seguito), 223 Embolia polmonare e tromboembolia venosa 4.114 Embolia polmonare: fattori predisponenti, 224 4.115 Fonti di emboli polmonari, 225 4.116 Manifestazioni cliniche della trombosi venosa della gamba, 226 4.117 Diagnosi della tromboembolia venosa acuta con ecografia e TC, 227 4.118 Embolia polmonare di grado lieve senza infarto, 228 4.119 Infarto polmonare, 229 4.120 Embolizzazione massiva, 230 4.121 Difese meccaniche contro l’embolia polmonare ed effetti cronici della patologia, 231 4.122 Situazioni specifiche ed emboli polmonari da fonti extravascolari, 232 Ipertensione polmonare 4.123 Sistema di classificazione dell’OMS per l’ipertensione polmonare, 233 4.124 Diagnosi dell’ipertensione polmonare, 234 4.125 Trattamento dell’ipertensione polmonare, 235 4.126 Terapie chirurgiche dell’ipertensione polmonare, 236 Edema polmonare 4.127 Edema polmonare: via del normale riassorbimento del liquido polmonare, 237 4.128 Edema polmonare: alcune eziologie e meccanismi ipotetici, 238 Versamento pleurico 4.129 Fisiopatologia dell’accumulo di liquido pleurico, 239 4.130 Versamento pleurico secondario a cardiopatia, 240 4.131 Polmone non espandibile, 241 4.132 Versamento parapneumonico, 242 4.133 Versamento pleurico nella neoplasia maligna, 243 4.134 Chilotorace, 244 Lesioni toraciche 4.135 Fratture costali e sternali, 245 4.136 Torace flaccido e contusione polmonare, 246 Pneumotorace 4.137 4.138 4.139 4.140 4.141 4.142 4.143 Pneumotorace ipertensivo, 247 Pneumotorace aperto, 248 Emotorace, 249 Lacerazione polmonare, 250 Rottura tracheo-bronchiale, 251 Asfissia traumatica, 252 Lesioni diaframmatiche, 253 Sindrome da distress respiratorio 4.144 Sindrome da distress respiratorio (del neonato), 254 4.145 Sindrome da distress respiratorio (del neonato) (Seguito), 255 4.146 Danno polmonare acuto, 256 Patologie interstiziali 4.147 Polmoniti interstiziali idiopatiche, 257 4.148 Polmoniti interstiziali idiopatiche (Seguito), 258 4.149 Polmoniti interstiziali idiopatiche (Seguito), 259 4.150 Polmonite organizzativa criptogenetica, 260 4.151 Proteinosi alveolare polmonare, 261 4.152 Emosiderosi polmonare idiopatica, 262 4.153 Linfagioleiomiomatosi, 263 4.154 Istiocitosi polmonare a cellule di Langerhans, 264 4.155 Sarcoidosi, 265 4.156 Sarcoidosi (Seguito), 266 4.157 Artrite reumatoide, 267 4.158 Sclerosi sistemica (sclerodermia), 268 4.159 Lupus eritematoso sistemico, 269 ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 2/24/12 1:53:15 PM Indice 4.160 4.161 4.162 4.163 Dermatomiosite e polimiosite, 270 Vasculite polmonare, 271 Polmonite eosinofila, 272 Manifestazioni polmonari di altre patologie, 273 4.164 Manifestazioni polmonari di altre patologie (Seguito), 274 4.165 Medicina del sonno, 275 4.166 Disturbi respiratori durante il sonno, 276 5.9 5.10 5.11 Ossigenoterapia 5.12 5.13 5.14 SEZIONE 5 TERAPIE E PROCEDURE TERAPEUTICHE Farmacologia 5.1 5.2 5.3 5.4 5.5 5.6 5.7 5.8 Broncodilatatori, 278 Metilxantine, 279 Metilxantine: effetti collaterali, 280 Anticolinergici, 281 Corticosteroidi nella terapia per l’asma, 282 Corticosteroidi: uso clinico, 283 Effetti collaterali dei corticosteroidi, 284 Leucotrieni, 285 ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA C0075.indd xvii Antileucotrieni, 286 Soppressori della tosse (agenti antitussivi), 287 Riabilitazione polmonare, 288 Ossigenoterapia nell’insufficienza respiratoria acuta, 289 Metodi di somministrazione dell’ossigeno, 290 Ossigenoterapia nell’insufficienza respiratoria cronica (uso ambulatoriale e domestico), 291 Gestione delle vie aeree 5.15 5.16 5.17 5.18 5.19 5.20 5.21 Introduzione dei tubi di drenaggio nel torace, 292 Metodi di drenaggio del torace, 293 Drenaggio posturale ed esercizi di respirazione, 294 Ostruzione delle vie aeree superiori e manovra di Heimlich, 295 Assicurare una via aerea in emergenza, 296 Intubazione endotracheale, 297 Tracheostomia, 298 5.22 5.23 5.24 5.25 Morbilità nell’intubazione endotracheale e nella tracheostomia, 299 Aspirazione endotracheale, 300 Ventilazione meccanica, 301 Ventilazione meccanica non invasiva (NIV): indicazioni, 302 Chirurgia toraco-polmonare 5.25 5.26 5.27 5.28 5.29 5.30 5.31 5.32 5.33 Resezione e anastomosi della trachea, 302 Rimozione dei tumori mediastinici, 303 Resezione sottolobare e biopsia chirurgica del polmone, 304 Lobectomia, 305 Pneumonectomia, 306 Pneumonectomia (Seguito), 307 Chirurgia toracoscopica video-assistita, 308 Chirurgia di riduzione del volume polmonare, 309 Trapianto polmonare, 310 BIBLIOGRAFIA SELEZIONATA, 311 INDICE ANALITICO, 315 xvii 2/10/12 4:27:19 PM Tavola 4.64 Apparato respiratorio Classificazione delle polmoniti Polmonite lobare PANORAMICA SULLA POLMONITE Le infezioni polmonari possono interessare le vie aeree, il parenchima polmonare o lo spazio pleurico. Esse rappresentano la principale causa di morte dovuta a malattie infettive nel mondo. Nei Paesi industrializzati sono la sesta causa di morte in assoluto. La polmonite è un’infezione delle unità di scambio polmonari dei gas, causata perlopiù da batteri, ma in alcuni casi anche da virus, funghi, parassiti o altri agenti infettivi. Nei soggetti immunocompetenti, la polmonite è caratterizzata da una rapida infiltrazione di liquido e cellule infiammatorie nello spazio alveolare. Quando l’infezione alveolare coinvolge un intero lobo anatomico del polmone viene definita polmonite lobare e alcuni episodi possono portare allo sviluppo di una malattia multilobare con manifestazioni cliniche più gravi. Quando il processo alveolare presenta una distribuzione irregolare e adiacente ai bronchi, senza riempimento dell’intero lobo, si parla invece di broncopolmonite. Le polmoniti sono suddivise in forme tipiche e atipiche, sulla base della presentazione clinica. La sindrome tipica è caratterizzata dalla comparsa improvvisa di febbre alta, brividi, dolore toracico pleuritico e tosse produttiva e può verificarsi soltanto in pazienti con sistema immunitario intatto e se l’infezione è causata da un batterio patogeno come Streptococcus pneumoniae, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, bacilli aerobi gramnegativi o anaerobi. Quando questi organismi infettano soggetti con una risposta immunitaria compromessa, come nel caso di pazienti anziani e debilitati, è possibile che i sintomi classici della polmonite non si manifestino. La polmonite atipica, caratterizzata dai precedenti sintomi a carico dell’apparato respiratorio superiore, febbre senza brividi, tosse non produttiva, cefalea, mialgie e leucocitosi moderata, è spesso il risultato di un’infezione virale, da Mycoplasma pneumoniae, Chlamydophila pneumoniae, Legionella e altri agenti infettivi rari (come nella psittacosi e nella febbre Q). Nella pratica clinica è spesso molto difficile stabilire la causa microbica della polmonite sulla base delle caratteristiche cliniche. Quando un’infezione del parenchima polmonare porta a grave compromissione del tessuto polmonare, possono seguire necrosi tissutale e formazione di cavità: questo tipo di infezione è definita ascesso polmonare e si verifica in genere quando il soggetto aspira nel polmone patogeni con virulenza elevata in assenza di meccanismi di clearance efficaci; tra gli agenti eziologici figurano S. aureus, K. pneumoniae, Escherichia coli e Pseudomonas aeruginosa. L’empiema è, invece, un’infezione dello spazio pleurico caratterizzata da materiale gravemente purulento, provocata in genere dall’estensione extrapolmonare di un’infezione parenchimale; è causata da anaerobi, bacilli gram-negativi, S. aureus e in rari casi anche da tubercolosi (TB). Un altro sistema di classificazione applicato alle polmoniti si basa sul luogo di origine dell’infezione. L’infezione che colpisce pazienti che vivono inseriti nella società viene definita polmonite acquisita in comunità (CAP), mentre si parla di polmonite nosocomiale o polmonite acquisita in ospedale (HAP) quando insorge mentre il paziente è già in ospedale. Quando la HAP si presenta in pazienti che sono stati sottoposti a ventilazione meccanica per almeno 48 ore, viene definita polmonite associata a ventilazione meccanica (VAP). I confini tra CAP e HAP sono diventati progressivamente più imprecisi per via della complessità dei pazienti che vivono fuori dagli ospedali. Quando la polmonite si sviluppa in pazienti alloggiati in case di cura, che eseguono emodialisi cronica o che sono stati ricoverati in ospedale negli ultimi tre mesi, si parla di polmonite associata a cure mediche (HCAP) e, visti i contatti con l’ambiente sanitario, quando arrivano in ospedale questi pazienti potrebbero 174 C0020.indd 174 Broncopolmonite Empiema Ascesso Polmonite acquisita in comunità (CAP) Polmonite acquisita in ospedale (HAP) Polmonite associata a cure mediche (HCAP) Polmonite associata a ventilazione meccanica (VAP) Emodialisi cronica Ospedalizzazione negli ultimi tre mesi Case di cura essere già contaminati da organismi multifarmaco-resistenti. Pertanto, il rapporto tra batteriologia e luogo di origine dell’infezione è il risultato di numerosi fattori, tra cui le comorbilità presenti nel paziente, lo stato delle difese dell’ospite e l’esposizione ambientale ad agenti patogeni specifici. I pazienti che sviluppano polmonite mentre sono sottoposti a terapie immunosoppressive o che hanno un sistema immunitario alterato sono definiti ospiti compromessi e le probabilità di infezione variano a seconda del tipo di immunodeficienza. Negli ultimi anni, le infezioni polmonari da tubercolosi, funghi e parassiti sono tornate a essere infezioni di una certa importanza e frequenza, soprattutto a causa dell’applicazione di terapie immunosoppressive per diverse patologie, in conseguenza della comparsa dell’AIDS e per via del numero crescente di anziani ospiti di strutture di assistenza. ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 2/10/12 3:19:55 PM Tavola 4.65 Malattie e anatomia patologica A. Polmonite lobare; lobo superiore destro. Epatizzazione mista rossa e grigia (stadio di transizione). Essudato fibrinoso pleurico POLMONITE PNEUMOCOCCICA EZIOLOGIA Streptococcus pneumoniae è il patogeno più comunemente associato alla polmonite acquisita in comunità (CAP) in tutte le popolazioni di pazienti, compresi i casi in cui la causa non è identificata per mezzo di esami diagnostici di routine. L’organismo è un diplococco gram-positivo di forma lanceolata con 84 diversi sierotipi, ciascuno dotato di una diversa capsula antigenica polisaccaridica. L’85% delle infezioni è provocato da un gruppo di 23 sierotipi, attualmente inclusi in un vaccino. L’infezione è più comune in inverno e all’inizio della primavera, aspetto che può essere correlato al fatto che il 70% dei pazienti presenta un patologia virale pregressa. I pazienti a rischio sono: anziani, soggetti con asplenia, mieloma multiplo, insufficienza cardiaca congestizia o alcolisti, soggetti che hanno avuto l’influenza e individui con pneumopatia cronica. I soggetti colpiti da un’infezione da HIV sviluppano polmonite pneumococcica con batteriemia con maggiore frequenza rispetto ai soggetti sani della stessa età. PATOGENESI E ANATOMIA PATOLOGICA L’organismo si diffonde da una persona all’altra e l’invasione del parenchima polmonare è preceduta solitamente dalla colonizzazione asintomatica dell’orofaringe. La polmonite si sviluppa quando, in un polmone incapace di contenere l’inoculo aspirato – spesso per via di un’immunodeficienza dell’ospite o dell’acquisizione di un ceppo particolarmente virulento, come i sierotipi I e III – vengono aspirati organismi colonizzanti. Nello pneumococco esistono fattori di virulenza che agevolano l’invasione del polmone, tra cui le proteine A e C presenti sulla superficie del batterio, che favoriscono il legame con l’epitelio delle vie aeree e interferiscono con le difese antibatteriche dell’ospite, e la pneumolisina, che può favorire l’invasione dei tessuti e ostacolare il battito ciliare. La risposta iniziale all’infezione polmonare da pneumococco è una formazione edematica estesa, che riempie il polmone e diffonde l’infezione. In questa fase, la sezione del polmone mostra un colore decisamente violaceo e la presenza di liquido schiumoso. Nelle ore successive, la fibrina e i neutrofili entrano nello spazio alveolare e nell’arco delle 24-48 ore che seguono i batteri si spostano progressivamente a livello endocellulare, dove vengono fagocitati. Il polmone diventa più solido, assumendo una consistenza simile a quella del fegato, ma con congestione capillare, e si sviluppano focolai emorragici che portano a una colorazione rossastra e alla fase di “epatizzazione rossa”. Nei due o più giorni successivi, l’area si schiarisce e si passa alla fase dell’”epatizzazione grigia”. In genere, il polmone recupera l’aspetto normale in 5-10 giorni, ma in alcuni casi i fibroblasti entrano nel lobo, provocando organizzazione e fibrosi. Nella maggior parte dei pazienti, l’infiammazione si estende inizialmente alla pleura determinando un versamento parapneumonico, ma alcuni pazienti possono sviluppare infezioni dello spazio pleurico o empiemi. ASPETTI CLINICI I soggetti precedentemente sani che sviluppano polmonite pneumococcica manifestano i sintomi della “polmonite tipica”, con comparsa improvvisa di febbre alta, brividi, dolore toracico pleuritico, leucocitosi con spostamento a sinistra ed espettorato purulento (o anche sanguinolento e rugginoso). I pazienti anziani con immunodeficienza, spesso causata dalla presenza di comorbilità, possono non presentare questi sintomi classici e manifestare unicamente malessere, dispnea, confusione e difficoltà di recupero. ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA C0020.indd 175 B. Polmonite del lobo superiore destro e di un segmento del lobo inferiore destro C. Espettorato purulento con pneumococchi (colorazione di Gram) Il pattern radiografico classico è quello di un consolidamento lobare, ma può manifestarsi anche broncopolmonite. La batteriemia si manifesta nel 20% dei pazienti ospedalizzati che presentano questa infezione, ma probabilmente non influisce sulla mortalità, anche se può essere associata a una risoluzione clinica ritardata. Le complicanze extrapolmonari, che possono impedire la risposta alla terapia, comprendono meningite, empiema (per distinguerlo dal versamento parapneumonico, complicato e non, è sufficiente eseguire un prelievo del liquido pleurico), artrite, endocardite e ascesso cerebrale. Quando il soggetto non sviluppa nessuna di queste complicanze, il miglioramento clinico si manifesta generalmente entro le 24-48 ore dall’avvio di una terapia antibiotica adeguata. La diagnosi di polmonite pneumococcica può essere confermata dal risultato positivo della coltura ematica, ma è possibile eseguire anche altri test diagnostici, tra cui la colorazione di Gram dell’espettorato, la coltura dell’espettorato e la ricerca dell’antigene urinario. Il valore della colorazione di Gram dell’espettorato eseguita a fini diagnostici e per ottenere indicazioni sulla terapia è controverso perché l’esame non è sempre sensibile o specifico; inoltre, alcuni pazienti non sono in grado di produrre campioni adeguati per la valutazione e la colorazione di Gram è meno efficace se il paziente è stato sottoposto a terapia antibiotica prima del prelievo. La coltura dell’espettorato deve essere interpretata insieme ai risultati della colorazione di Gram. È inoltre disponibile in commercio il test per la ricerca dell’antigene urinario per lo pneumococco. 175 2/10/12 3:19:57 PM Tavola 4.66 Apparato respiratorio D. Alterazioni patologiche nelle zone di lesione pneumonica Tessuto polmonare normale Zona di edema periferico Zona di risoluzione Alveoli pieni di liquido edematoso contenente pneumococchi I macrofagi alveolari sostituiscono i leucociti Zona di consolidamento iniziale Essudato con cellule polimorfonucleate ed eritrociti Artrite settica Zona di consolidamento avanzato Effusione intensa di cellule polimorfonucleate; pneumococchi fagocitati e distrutti E. Complicanze della polmonite pneumococcica Coagulopatia Pericardite purulenta intravascolare (in pazienti con asplenia) Versamento pleurico sterile parapneumonico POLMONITE PNEUMOCOCCICA (Seguito) TERAPIA Le raccomandazioni attuali prevedono un trattamento di almeno 5-7 giorni, purché il paziente sia afebbrile per 48-72 ore e gli altri segni clinici della polmonite si siano risolti. La batteriemia pneumococcica può ritardare la risposta clinica ma di per sé non richiede una terapia prolungata. Negli ultimi anni, alcuni ricercatori hanno misurato i livelli sierici di procalcitonina, reagente di fase acuta sintetizzato dal fegato in risposta a un’infezione batterica, e hanno utilizzato tali parametri per stabilire la durata della terapia. La penicillina rappresenta il farmaco di elezione, ma dalla metà degli anni Novanta la resistenza a questo antibiotico è andata aumentando progressivamente (negli Stati Uniti e in Europa sono stati osservati livelli di resistenza in oltre il 40% di questi organismi). Molti di questi organismi sono resistenti anche ad altri antibiotici comuni (macrolidi, trimetoprim-sulfametoxazolo, alcune cefalosporine e anche chinoloni). In Italia la resistenza dello Streptococcus Pneumoniae alla penicillina è piuttosto bassa (10-15%) rispetto ad altri Paesi quali Francia, Spagna e Stati 176 C0020.indd 176 Uniti. È invece abbastanza elevata (30%) la resistenza ai macrolidi, alle tetracicline e al co-trimossazolo. Non si conosce ancora l’effetto clinico della resistenza su outcome quali ad esempio la mortalità, ma non si esclude che possa aumentare il rischio di morte. PREVENZIONE Il vaccino pneumococcico a base di polisaccaridi capsulari può impedire l’insorgenza della polmonite pneumococcica ed è consigliato per i soggetti a rischio, comprese le persone di età superiore a 65 anni, gli ospiti di istituti o case di cura, pazienti con disfunzioni della milza (splenectomia, malattia a cellule falciformi), con patologie croniche (ad es. cardiopatia, pneumopatia, diabete) e soggetti immunosoppressi (terapia con corticosteroidi, chemioterapia). Gli adulti ricevono il vaccino pneumococcico polisaccaridico 23-valente (PPV), mentre ai bambini è somministrato il vaccino coniugato 7-valente (PCV), dotato di una maggiore immunogenicità. I benefici derivanti dal vaccino PPV sono stati confermati in pazienti immunocompetenti di età superiore a 65 anni, con un’efficacia stimata del 75%, ma ricompresa tra il 65 e l’84% nei pazienti con patologie croniche, incluso diabete mellito, coronaropatia, insufficienza cardiaca congestizia, pneumopatia cronica Endocardite Empiema e asplenia anatomica. Non è stata altrettanto chiaramente definita, invece, la sua efficacia in popolazioni immunodeficienti, come soggetti con malattia a cellule falciformi, insufficienza renale cronica, deficienza di immunoglobulina, malattia di Hodgkin, linfoma, leucemia e mieloma multiplo. Per i pazienti di età superiore a 65 anni a cui è stato somministrato il vaccino più di 5 anni prima e che all’età della prima vaccinazione non avevano ancora compiuto 65 anni è consigliata una singola rivaccinazione. Se la vaccinazione iniziale è stata eseguita dopo i 65 anni, il richiamo è indicato soltanto (dopo 5 anni) se il paziente presenta asplenia anatomica o funzionale oppure una delle condizioni di immunocompromissione elencate sopra. Il vaccino PCV è raccomandato nei bambini sani, mentre non ne è stata ancora dimostrata l’efficacia sugli adulti; tuttavia, ha mostrato di apportare benefici in adulti che vivono con bambini vaccinati, mostrando un effetto di “herd immunity”, ossia una protezione di gruppo. Di recente, alcuni bambini che hanno ricevuto il vaccino PCV 7-valente hanno sviluppato l’infezione da ceppi non inclusi nel vaccino, con conseguente aumento della frequenza di polmoniti necrotizzanti gravi, in particolare del sierotipo 3. Di recente è stato introdotto un nuovo vaccino 13-valente, che è l’evoluzione del PCV 7-valente, in grado di aumentare la copertura dei sierotipi circolanti fino al 45% in più rispetto alla copertura attuale del PCV-7. ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 2/10/12 3:20:02 PM Tavola 4.67 Malattie e anatomia patologica POLMONITE DA MYCOPLASMA Decorso clinico Giorni di malattia 4 POLMONITE Temperatura (°C) DA PATOGENI ATIPICI MYCOPLASMA PNEUMONIAE M. pneumoniae ha un aspetto molto simile a quello di un batterio, è privo di pareti cellulari ed è circondato da una membrana a tre strati (Tavola 4.67). La maggior parte delle infezioni respiratorie causate da M. pneumoniae è di entità minore e si manifesta in forma di bronchite o malattia delle vie respiratorie superiori. Sebbene la polmonite si verifichi soltanto nel 3-10% dei casi di infezione da Mycoplasma, questo organismo resta una causa comune di polmonite, con un leggero aumento dei casi in autunno e in inverno. Colpisce tutti i gruppi di età e, pur essendo più comune nei soggetti sotto i 20 anni, si osserva anche in adulti più anziani. L’infezione respiratoria consegue all’inalazione dell’organismo, che si lega all’epitelio delle vie aeree tramite recettori contenenti acido neuraminico. Successivamente, si innesca una risposta infiammatoria con neutrofili, linfociti e macrofagi, accompagnata da formazione di anticorpi IgM e poi IgG. Alcune delle polmoniti osservate possono essere mediate da una risposta dell’ospite verso l’organismo piuttosto che da una lesione tissutale diretta a opera del patogeno. Fino al 40% dei soggetti infetti presenta immunocomplessi circolanti. Quando si manifesta polmonite, questa è solitamente caratterizzata da tosse secca, febbre, brividi, cefalea e malessere dopo un periodo di incubazione di 2-3 settimane. Le radiografie toraciche mostrano infiltrati interstiziali, solitamente unilaterali e a carico del lobo inferiore, ma che possono essere anche bilaterali e multilobari, sebbene in genere il paziente non appaia tanto malato quanto indicato dal quadro radiografico. In rare occasioni, i pazienti sviluppano malattia grave con insufficienza respiratoria o polmonite necrotizATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA C0020.indd 177 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 30 40,0 39,5 39,0 38,5 38,0 37,5 37,0 Cefalea PATOGENI ATIPICI In passato, il termine atipico era utilizzato per descrivere le caratteristiche cliniche non classiche dell’infezione provocata da determinati organismi, ma oggi è passato a definire un gruppo di organismi comprendente Mycoplasma pneumoniae, Chlamydophila pneumoniae e Legionella spp. La terapia con -lattamici (penicilline e cefalosporine) non si dimostra particolarmente efficace nell’eliminazione di tali patogeni, che devono essere trattati, invece, con un macrolide, una tetraciclina o un chinolone. La loro frequenza nella patogenesi della polmonite acquisita in comunità (CAP) varia a seconda dello studio, ma questi organismi possono essere presenti nel 60% degli episodi di CAP perché agiscono da co-patogeni, insieme ai batteri, nel 40% dei pazienti. In presenza di infezione mista, in particolare da C. pneumoniae e pneumococco, il decorso può essere più complesso rispetto ai casi con infezione da patogeno singolo. Nei pazienti con forme più gravi di CAP, i patogeni atipici possono essere presenti in quasi il 25% dei casi, ma l’organismo responsabile può variare nel tempo. I patogeni atipici sono considerati più diffusi tra i giovani e i soggetti sani; tuttavia, alcuni dati di popolazione hanno dimostrato che sono presenti in pazienti di tutte le età, compresi anziani e soggetti ricoverati in case di cura. Gli studi che evidenziano una frequenza elevata di patogeni atipici si sono avvalsi del metodo diagnostico dei test sierologici, che potrebbero essere meno accurati e specifici rispetto alla coltura e all’identificazione degli antigeni. L’importanza dei patogeni atipici è stata suggerita anche da alcuni studi su pazienti ospedalizzati, compresi pazienti con polmonite pneumococcica di origine batterica, che mostrano un miglioramento del tasso di mortalità con terapie comprendenti un macrolide o un chinolone, agenti che possono essere attivi contro questi organismi. 5 Malessere Tosse Rantoli Radiografia del torace in proiezione postero-anteriore: infiltrati perilari non uniformi, principalmente nel polmone sinistro Radiografie del torace Linfociti (in migliaia) 7,5 Titolo di agglutinine a frigore 5.8 1:4 M. pneumoniae in coltura faringea 1:32 + Titolo di immunofluorescenza indiretta 6,1 8,2 5,5 1:256 + + − 1:320 1:10 Complicanze Colonie di Mycoplasma spp. su agar con colorazione che mostrano il caratteristico aspetto a “uovo fritto” dato dall’ancoraggio nello spessore dell’agar in corrispondenza della zona centrale di ciascuna colonia Test positivo Controllo Miringite bollosa Miocardite Test delle agglutinine a frigore zante, ma la maggior parte dei casi si risolve in 7-10 giorni senza la comparsa di complicanze. Molti pazienti presentano anche manifestazioni extrapolmonari, tra cui sintomi a carico delle vie respiratorie superiori (nel 50% dei soggetti colpiti), compresi mal di gola e mal d’orecchi (con miringite emorragica o bollosa). In almeno il 20% dei pazienti si osserva versamento pleurico, anche se contenuto. Altre manifestazioni comprendono malattie neurologiche Mielite trasversa o altra manifestazione neurologica Anemia emolitica da agglutinine a frigore come meningoencefalite, meningite, mielite trasversa e paralisi dei nervi cranici. Il reperto extrapolmonare più comune è un autoanticorpo IgM, diretto contro l’antigene I degli eritrociti e responsabile dell’agglutinazione a frigore dei globuli rossi. Sebbene il 75% dei pazienti possa presentare questo anticorpo e ottenere risultati positivi al test di Coombs, è raro osservare anemia emolitica autoimmune clinicamente significativa. Altre complicanze sistemiche sono: 177 2/10/12 3:20:08 PM Tavola 4.68 Apparato respiratorio POLMONITE DA CHLAMYDIA PSITTACI Complicanze POLMONITE DA PATOGENI ATIPICI Caratteristiche tipiche Encefalite Febbre (Seguito) miocardite, pericardite, epatite, gastroenterite, eritema multiforme, artralgia, pancreatite, linfadenopatia generalizzata e glomerulonefrite. Le manifestazioni extrapolmonari possono presentarsi fino a 3 settimane dopo i sintomi respiratori. Si sospetta la diagnosi quando si rileva un quadro clinico e radiografico compatibile in un ospite con polmonite e, eventualmente, reperti extrapolmonari. La conferma può essere ottenuta isolando l’organismo in una coltura di secrezioni delle vie respiratorie. La diagnosi sierologica si basa sul riscontro di un aumento fino a quattro volte superiore al numero normale di anticorpi specifici contro M. pneumoniae tramite test di fissazione del complemento, anche se un singolo titolo di 1:64 è indicativo di infezione. La diagnosi è suggerita anche da un titolo di agglutinine a frigore di 1:64. L’infezione è stata individuata anche con il test per la ricerca di anticorpi IgM, metodo che ha permesso ad alcuni ricercatori di stabilire che M. pneumoniae può presentarsi insieme ad agenti batterici in pazienti con CAP. Una volta eseguita la diagnosi, si procede per 10-14 giorni con una terapia a base di macrolide, chinolone o tetraciclina, che possono ridurre la durata e la gravità della malattia. La risoluzione radiografica è generalmente rapida, come per le infezioni da Chlamydia spp., e più rapida di quanto osservato nei casi di Legionella spp. o di polmonite pneumococcica. Tosse secca Rash Epatite Splenomegalia Insufficienza renale Anemia emolitica INFEZIONI DA CHLAMYDIA Come già menzionato, in pazienti di qualsiasi età affetti da CAP è possibile osservare abbastanza frequentemente la presenza di Chlamydia pneumoniae come patogeno primario o co-infettivo (Tavola 4.68). La specie Chlamydia può causare anche una forma meno comune di polmonite, detta psittacosi, secondaria a infezione da Chlamydia psittaci, un agente trasmesso attraverso l’inalazione di escrementi infetti di specie aviarie; l’uccello infettivo non deve essere necessariamente malato per poter trasmettere la malattia. I pazienti con psittacosi manifestano spesso cefalea, febbre alta, splenomegalia e tosse secca, tutte a esordio insidioso dopo un periodo di incubazione di 1-2 settimane. Si può inoltre osservare rash maculare simile a quello della febbre tifoide con bradicardia relativa, oltre ad altri possibili reperti extrapolmonari tra cui epatite, encefalite, anemia emolitica e insufficienza renale. La diagnosi si basa su una storia di contatto compatibile e può essere confermata con test sierologici. Il trattamento prevede la somministrazione di tetraciclina (2-3 g/die) per 14-21 giorni. C. pneumoniae è stato identificato tra le cause comuni di CAP e può provocare polmonite sporadica, ma è stato responsabile anche di forme epidemiche di infezioni respiratorie, tra cui polmoniti in pazienti ricoverati presso case di cura. La malattia non ha caratteristiche specifiche ma provoca spesso laringite e faringite. I pazienti manifestano febbre, brividi, dolore toracico pleuritico, cefalea e tosse e, in alcuni casi, insufficienza respiratoria. La terapia può essere a base di macrolidi, tetracicline o fluorochinoloni, ma la durata è incerta. Questa forma di polmonite, tuttavia, tende a risolversi più rapidamente rispetto ad altre forme di CAP, ad eccezione dei casi in cui è associata a infezione mista da pneumococco. Oltre l’85% dei pazienti raggiunge una risoluzione radiografica completa entro 6 settimane, ma tutti entro un tempo massimo di 12 settimane. LEGIONELLA PNEUMOPHILA Questo piccolo bacillo gram-negativo, a debole colorazione, fu isolato per la prima volta nel 1976 a Filadelfia, dopo un’epidemia che colpì principalmente i partecipanti a un incontro dell’American Legion (Tavola 4.69). Tuttavia, l’agente patogeno non è realmente nuovo e dopo la sua identificazione furono riscontrate prove che ne 178 C0020.indd 178 Micrografia elettronica di C. pneumoniae Chlamydia psittaci attestavano la presenza già prima del 1976. L’infezione, più diffusa in estate e all’inizio dell’autunno, non si trasmette da persona a persona e può avvenire in forma sporadica o epidemica: l’organismo viene trasmesso per diffusione aerea da fonti di acqua infetta, come impianti di condizionamento dell’aria, acqua da bere, rive di laghi e fiumi, rubinetti, saune e soffioni per docce. Quando il sistema idrico di una struttura diventa infetto possono verificarsi epidemie nosocomiali, come è accaduto in alcuni ospedali e case di cura. In Italia e nel mondo la legionellosi rappresenta una malattia sottostimata e risulta difficile individuare la fonte dell’infezione. La letalità della legionellosi, in Italia, è più elevata nelle infezioni nosocomiali (3050%) che in quelle comunitarie (5-15%). Nei pazienti defedati o trattati con ritardo la letalità può raggiungere anche l’80%. L’incidenza della legionellosi in Italia nel 2009 è stata pari a 20 casi per milione di popolazione (1.200 casi in totale). L’80% circa dei casi è stato notificato da Lombardia, Piemonte, Veneto, Emilia-Romagna, Toscana e Lazio. Il maggior numero di casi (308) è stato notificato dalla Lombardia seguita dal Lazio (102 casi). Lombardia (48 casi) e Toscana (13 casi) hanno invece riportato il maggior numero di casi notificati nosocomiali. In Italia le infezioni derivano prevalenteATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 2/10/12 3:20:09 PM Tavola 4.69 Malattie e anatomia patologica POLMONITE DA LEGIONELLA POLMONITE DA PATOGENI ATIPICI (Seguito) mente dalla contaminazione dei sistemi di distribuzione dell’acqua. Tuttavia nel 60% dei casi non si riesce a risalire alla fonte di infezione ambientale, probabilmente a causa delle molteplici occasioni di esposizione. All’ingresso della Legionella nei polmoni segue un periodo di incubazione di 2-10 giorni. In un primo momento, il batterio risiede a livello endocellulare nei macrofagi alveolari, dove si moltiplica dando origine a una risposta infiammatoria che coinvolge neutrofili, linfociti e anticorpi. Poiché per contrastare l’infezione occorre l’attivazione dell’immunità cellulo-mediata, la malattia può verificarsi in ospiti compromessi, in particolare soggetti ospedalizzati sottoposti a terapia con corticosteroidi, e può portare a recidiva in caso di trattamento di durata insufficiente. Attualmente si identificano oltre 46 specie di Legionella e almeno 68 sierotipi, ma il sierogruppo 1 di Legionella pneumophila è il più diagnosticato e può essere individuato mediante ricerca dell’antigene urinario. Un’altra specie che causa spesso la malattia nell’uomo è Legionella micdadei. Nella forma sporadica, le specie Legionella possono essere considerate responsabili del 7-15% dei casi di CAP e costituiscono un fattore critico per i pazienti con forme gravi della malattia. L’incidenza variabile dell’infezione da Legionella tra i pazienti ricoverati in ospedale deriva dalla variabilità geografica e stagionale dei tassi di infezione e dalla disponibilità di esami diagnostici. I metodi sierologici sono meno validi da un punto di vista clinico, data la comparsa talvolta tardiva degli anticorpi specifici a livelli significativi e la necessità di controllare un campione di siero in fase di convalescenza. Per effettuare una diagnosi sierologica è necessario raccogliere titoli acuti e convalescenti, operazione che può richiedere 8-9 settimane. La diagnosi è formulata quando il titolo di anticorpi fluorescenti indiretti quadruplica raggiungendo almeno il livello di 1:64 o quando un singolo titolo convalescente supera il livello di 1:128; tuttavia, quest’ultimo risultato non è sempre specifico di un’infezione acuta. L’organismo può essere ottenuto da colture di secrezioni infette su terreno CYE agar, ma questa procedura richiede la produzione di espettorato da parte del paziente e i risultati sono positivi nel 10-80% dei casi. Un altro metodo diagnostico è la prova di immunofluorescenza diretta (DFA) per individuare la presenza dell’organismo in secrezioni infette. La ricerca dell’antigene urinario è il test diagnostico più accurato per le specie Legionella ma è specifico esclusivamente per le infezioni da sierogruppo 1. Negli ultimi anni, la maggior parte dei casi è stata diagnostica con la ricerca dell’agente urinario, metodo che ha permesso di arrivare a una riduzione del tasso di mortalità da Legionella, derivante probabilmente dalla diagnosi di forme meno gravi rispetto al passato. In futuro, potrebbe diventare disponibile il test della reazione a catena della polimerasi (PCR) in tempo reale su campioni di secrezioni respiratorie. I pazienti con polmonite da Legionella manifestano comunemente febbre alta, brividi, cefalea, mialgie e leucocitosi. Le caratteristiche che possono suggerire la diagnosi sono la presenza di polmonite con precedente diarrea e confusione mentale, iponatriemia, bradicardia relativa e anomalie della funzionalità epatica, ma questa sindrome di legionellosi classica non è in genere presente. I sintomi progrediscono rapidamente e il paziente può manifestare elevata tossicità. È possibile la produzione di espettorato purulento, lo sviluppo di dolore toracico pleuritico e la comparsa di dispnea, ma in genere la colorazione di Gram dell’espettorato evidenzia cellule infiammatorie senza nessun organismo identificabile. La radiografia toracica non è specifica e potrebbe mostrare broncopolmonite, malattia unilaterale o bilaterale, consolidamento lobare o densità arrotondate con cavernizzazione. Il versamento pleurico può verificarsi nel 15% dei casi, mentre l’empiema è raro. Più frequente è la proteinuria e in alcuni pazienti sono state documentate glomerulonefrite e necrosi tubulare acuta. Tra le complicanze della polmonite da ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA C0020.indd 179 Piccoli bacilli intracellulari ed extracellulari pleomorfi e smussi nel polmone di un paziente con legionellosi, evidenziata dalla colorazione Dieterle con impregnazione argentica, 1.500 (da Chandler et al.) Radiografia del torace al 5˚ giorno di malattia di un uomo di 58 anni con legionellosi confermata mediante test sierologici. L’unico coinvolgimento è il consolidamento del lobo inferiore sinistro. Miglioramento clinico entro 2-3 giorni dall’inizio del trattamento con eritromicina. Le alterazioni radiologiche sono perdurate in misura variabile per 2 mesi Legionella spp. evidenziata mediante colorazione specifica con anticorpi fluorescenti Legionella sono stati riportati rari casi di miocardite e disfunzione cerebellare. Non sono stati segnalati casi di infezione interumana. Se si sospetta questa diagnosi, occorre avviare una terapia con macrolide o chinolone; alcuni studi recenti hanno riportato ottimi risultati con l’uso di levofloxacina e moxifloxacina. La terapia con macrolidi viene somministrata generalmente per 14-21 giorni, mentre le terapie con chinoloni si dimostrano efficaci anche con durate inferiori. Nei soggetti fortemente immunocompromessi, è preferibile utilizzare un’associazione fra un fluorochinolonico e l’azitromicina o la claritromicina, visto l’elevato sinergismo d’azione Sezione istologica del polmone (colorazione con ematossilina-eosina) di un caso letale di legionellosi. È presente diffuso essudato intralveolare contenente numerosi grossi macrofagi intra- ed extracellulare di questi due farmaci. Nei casi di resistenza o allergia ai macrolidi e/o ai fluorochinolonici è possibile utilizzare tetracicline, rifampicina, trimetoprim e sulfametoxazolo e imipenem. Pur somministrando terapie efficaci, il calo della febbre può essere lento e picchi elevati potrebbero proseguire anche per una settimana dopo l’inizio del trattamento. La risoluzione radiografica è molto più lenta rispetto ad altre forme di polmonite patogena atipica e polmonite pneumococcica non batterica. Il tasso di mortalità è inferiore al 5% negli ospiti normali, ma può arrivare al 25% per gli ospiti compromessi. 179 2/10/12 3:20:10 PM Tavola 4.70 Apparato respiratorio Polmonite stafilococcica POLMONITE DA STAPHYLOCOCCUS AUREUS Staphylococcus aureus è un batterio gram-positivo necrotizzante che si presenta spesso a grappoli quando viene colorato in tessuti e secrezioni. Può essere responsabile di infezioni in diverse sedi, tra cui i polmoni, e può causare tutte le forme di polmonite, compresa la polmonite acquisita in comunità (CAP), la polmonite associata a cure mediche (HCAP) e la polmonite acquisita in ospedale (HAP). Può provocare infezioni polmonari profonde, ma può anche diffondersi per via ematogena dal polmone verso vari altri siti. Il coinvolgimento polmonare può non soltanto essere il risultato di una polmonite batterica ma avvenire anche secondariamente a una batteriemia sviluppatasi originariamente in diversa sede, compresa un’infezione cutanea o un’endocardite a carico del lato destro del cuore. La virulenza di questo organismo è accresciuta dalla sua capacità di acquisire da altri organismi materiale genetico esogeno (sequenze di inserzione, trasposoni e batteriofagi) responsabile dell’invasione tissutale e dell’acquisizione della resistenza agli antibiotici. La CAP può essere provocata da organismi sensibili agli antibiotici o da ceppi di S. aureus resistenti alla meticillina (MRSA); questi ultimi sono stati osservati in infezioni acquisite sia in comunità sia in ospedale. Polmonite stafilococcica grave che complica un’endocardite, con formazione di ascessi, empiema, vegetazioni sulla valvola tricuspide ed emboli nei rami dell’arteria polmonare Coltura che mostra resistenza alla meticillina (MRSA) EPIDEMIOLOGIA S. aureus non è in genere una causa frequente di CAP ma è sempre stato osservato in pazienti anziani, in soggetti con pneumopatia cronica (fibrosi cistica e bronchiectasie) e nei casi di influenza complicata da polmoniti batteriche. Negli ultimi anni, sono emersi ceppi acquisiti in comunità di S. aureus resistenti alla meticillina (CAMRSA), principalmente in infezioni della pelle e dei tessuti molli ma anche come causa di CAP grave. La frequenza dei casi di CAP secondari a CA-MRSA è ancora relativamente bassa, ma si osservano episodi sporadici e in determinate zone geografiche si raggiunge un tasso elevato, in particolare durante il periodo dell’influenza. L’infezione da CA-MRSA è una patologia clonale, derivante dal clone USA 300 di S. aureus, che si differenzia a livello clinico e batteriologico da quella associata ai ceppi di MRSA responsabili della polmonite nosocomiale. I ceppi CA-MRSA possono infettare soggetti precedentemente sani, di solito come complicanza di precedenti infezioni virali, mentre gli MRSA tendono a colpire soggetti cronicamente malati e debilitati. L’infezione da CA-MRSA è spesso un’infezione necrotizzante che può essere mediata da diverse tossine stafilococciche, compresa la leucocidina o tossina di Panton-Valentine. Stafilococchi e leucociti polimorfonucleati nell’espettorato (colorazione di Gram) Polmonite stafilococcica di fase precoce Polmonite stafilococcica di fase avanzata con ascessi e pneumotorace ASPETTI CLINICI La disseminazione ematogena del polmone, causa di polmonite stafilococcica, può verificarsi in tossicomani con endocardite destra o per effetto di tromboflebiti venose settiche (secondarie a infezione della vena giugulare o da catetere venoso centrale). Nei pazienti con infezione polmonare primaria, la malattia tende a essere grave e spesso bilaterale, multilobare, a rapida progressione e necrotizzante. I pazienti manifestano comparsa improvvisa di febbre, tachipnea e tosse con espettorato purulento, e la condizione può progredire rapidamente fino allo shock settico e all’insufficienza respiratoria. La radiografia può mostrare versamento pleurico, infiltrati cavitari, 180 C0020.indd 180 ascesso polmonare o pneumocele (sequela tardiva di infezione). L’empiema è una complicanza diffusa, ma tra le complicanze extrapolmonari figurano l’endocardite e la meningite. TRATTAMENTO La terapia per organismi sensibili agli antibiotici è la penicillina antistafilococcica (ad es. oxacillina o nafcillina) o una cefalosporina di prima generazione. Per i ceppi MRSA è possibile ricorrere alla vancomicina o alla teicloplanina, ma il linezolid può dimostrarsi un agente più efficace perché penetra meglio nelle sedi respiratorie dell’infezione. Nelle infezioni complicate, come quelle accompagnate da batteriemia o disseminazione a distanza in siti extrapolmonari, la terapia deve proseguire per 4-6 settimane. Non si esclude la possibilità di reinfezione e il tasso di mortalità tende a superare il 30%. Poiché la patogenesi della polmonite da CA-MRSA può essere correlata alla produzione di tossine batteriche, la terapia potrebbe richiedere l’integrazione sia di un agente antibatterico sia di un agente che stimoli la produzione di antitossine (ad es. il linezolid da solo o in associazione a vancomicina e clindamicina). ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 2/10/12 3:20:13 PM Tavola 4.71 Malattie e anatomia patologica Colorazione di Gram POLMONITE DA HAEMOPHILUS INFLUENZAE Questo coccobacillo a bastoncello gram-negativo può presentarsi in forma tipizzabile incapsulata o in forma non tipizzabile non incapsulata, entrambe capaci di provocare polmonite. Gli organismi non tipizzabili sono anche una causa comune di bronchite e rappresentano un colonizzatore frequente nella broncopneumopatia cronica ostruttiva (BPCO). Esistono sette tipi di organismi incapsulati, ma il 95% delle infezioni invasive è riconducibile al tipo B. L’anticorpo opsonizzante IgG (diretto contro il polisaccaride capsulare PRP e gli antigeni di membrana) è necessario per fagocitare gli organismi incapsulati, che sono generalmente più virulenti perché richiedono risposte dell’ospite più elaborate rispetto agli organismi non incapsulati. Tuttavia, numerosi studi hanno dimostrato che negli adulti, in particolare nei soggetti con BPCO, le infezioni da batteri non incapsulati sono più comuni rispetto alle infezioni da organismi incapsulati e che l’anticorpo opsonizzante è necessario anche per controllare i batteri non incapsulati. I pazienti che sviluppano polmonite associata a questo tipo di batteri presentano in genere immunodeficienza (ad es. compromissione dell’immunità umorale o disfunzione fagocitaria locale), ma questo organismo può presentarsi anche in pazienti il cui unico fattore di rischio è il tabagismo. In presenza di polmonite, alcuni pazienti possono sviluppare batteriemia, e ciò avviene più tipicamente nei soggetti con polmonite segmentaria piuttosto che in quelli con broncopolmonite. La percentuale di polmoniti di tipo segmentario è del 15% e fino al 70% di questi casi è associato a batteriemia, condizione che si riscontra invece soltanto nel 25% dei pazienti con broncopolmonite. Il microrganismo incapsulato di tipo B è più diffuso tra i pazienti con polmonite segmentaria rispetto a quelli con broncopolmonite. Nei pazienti affetti da BPCO, infine, la broncopolmonite è più frequente della polmonite segmentaria. I pazienti con polmonite segmentaria mostrano la comparsa improvvisa di febbre e dolore toracico pleuritico, accompagnati da mal di gola. I soggetti affetti da broncopolmonite presentano febbre leggermente più bassa, tachipnea e sintomi costituzionali. La broncopolmonite multilobare a chiazze è il quadro radiografico più comune e altrettanto diffusa è la reazione pleurica, osservata in oltre il 50% dei pazienti con polmonite segmentaria e nel 20% ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA C0020.indd 181 Radiografia Epiglottite circa dei pazienti con broncopolmonite. Le complicanze comprendono: empiema, ascesso polmonare, meningite, artrite, pericardite, epiglottite e otite media (in particolare nei bambini). La terapia tradizionale prevede la somministrazione di ampicillina, alla quale, tuttavia, fino al 40% degli isolati di Haemophilus influenzae non tipizzabili e fino al 50% degli organismi di tipo B risulta oggi resistente a causa della capacità acquisita dal batterio di produrre enzimi -lattamasi. Attualmente, gli antibiotici che si dimostrano efficaci sono le cefalosporine di terza generazione, le associazioni di -lattami e -lattamasi inibitori, macrolidi più recenti (l’azitromicina è più attiva della claritromicina) e fluorochinoloni. È inoltre disponibile un vaccino coniugato contro gli organismi di tipo B (non utilizzato negli adulti a rischio di polmonite), che viene impiegato nei bambini a partire dal secondo mese di vita contro infezioni invasive come la meningite. 181 2/10/12 3:20:17 PM Tavola 4.72 POLMONITE DA BATTERI GRAM-NEGATIVI I batteri gram-negativi enterici sono una causa rara di CAP, ma sono stati osservati nel 10% dei pazienti, in particolare in soggetti con CAP grave ricoverati in terapia intensiva. I batteri gram-negativi documentati quali cause di CAP sono: Klebsiella pneumoniae, Pseudomonas aeruginosa, Enterobacter spp., Escherichia coli, Serratia marcescens e Acinetobacter spp. (particolarmente prevalente in Asia e tra i veterani delle guerre combattute nella regione del golfo Persico). Separando i pazienti con polmonite associata a cure mediche (HCAP) dai pazienti con CAP, è possibile ridurre sensibilmente la frequenza di CAP da batteri gram-negativi perché molti dei fattori di rischio per questi organismi collocano il paziente nella categoria delle HCAP. I fattori di rischio identificati per la contrazione di un’infezione da batteri gram-negativi nella CAP comprendono: comorbilità polmonare (broncopneumopatie croniche ostruttive particolarmente gravi, trattamento con corticosteroidi e bronchiectasie), probabile aspirazione, precedente ricovero ospedaliero e terapia antibiotica antecedente; gli ultimi due fattori sono spesso presenti nei pazienti con HCAP. L’infezione causata da questi organismi può essere comune anche in pazienti ricoverati in case di cura, che vengono comunque classificati nella categoria di HCAP. I pazienti con polmonite da batteri gram-negativi acquisita in comunità hanno un tasso di mortalità più alto rispetto ai pazienti con altre forme di CAP. I batteri gram-negativi sono associati frequentemente a shock settico e iponatriemia e i pazienti possono presentare neoplasie sottostanti, patologie cardio-vascolari e un passato da fumatore. Come si vedrà più avanti, i batteri gram-negativi sono una causa diffusa di polmonite acquisita in ospedale (HAP), in particolare di polmonite associata a ventilazione meccanica (VAP), rendendosi responsabili della patologia nella maggior parte dei pazienti con diagnosi eziologica stabilita. Maggiori informazioni su P. aeruginosa, la cui terapia si avvale della tobramicina e della colistina per via inalatoria nonché della ciprofloxacina nei pazienti ambulatoriali, oppure di una combinazione di un beta-lattamico (ad esempio ceftazidime, piperacillina, ipinenem, meropenem, aztreonam) con un aminoglicoside (tobramicina, amikacina) nelle riacutizzazioni polmonari, sono riportate nella sezione sulla polmonite acquisita in ospedale. Klebsiella pneumoniae è un batterio gram-negativo incapsulato che può causare anche CAP e HAP e ascessi polmonari. È generalmente acquisito per micro- o macroaspirazione da un’orofaringe precedentemente colonizzata. Il quadro istologico è quello di una zona periferica di edema, con consolidamento centrale. Il microrganismo differisce da altri patogeni associati alla CAP perché spesso può provocare polmoniti necrotizzanti con infiltrati cavitari e formazione di ascessi. Questa forma è nota come polmonite di Friedländer, dal nome del medico che la osservò per la prima volta; i soggetti colpiti sono in prevalenza di sesso maschile e generalmente di mezza età o più anziani e la condizione coesistente più comune è l’alcolismo. Quando la CAP è causata da K. pneumoniae, la malattia è in genere a insorgenza improvvisa, con tosse produttiva, dolore toracico pleuritico e collasso cardio-vascolare in pazienti con patologia cronica sottostante. La tosse è solitamente associata a espettorato di consistenza densa e purulento, con presenza di sangue (per effetto di necrosi) oppure di consistenza fluida e con aspetto a “gelatina di lampone”. All’esame obiettivo, il paziente manifesta generalmente segni di tossicità, con febbre alta e tachicardia, ed evidenze di consolidamento lobare. Il reperto radiografico classico, anche se non diffuso né specifico, è rappresentato da una scissura del lobo superiore che sporge, solitamente sul lato destro, e che identifica un consolidamento lobare con rigonfiamento verso il basso causato da denso infiltrato. Le manifestazioni primarie comprendono ascessi polmonari e broncopolmonite, ma l’ascesso polmonare può costituire anche una complicanza della polmonite, insieme a pericardite, meningite ed empiema. L’ascesso polmonare associato a K. pneumoniae differisce dall’ascesso osservato in presenza di batteri anaerobi: la malattia è infatti più acuta, l’espettorato non è di odore fetido, sono presenti cavità multiple ed è frequente un quadro clinico di diabete sottostante. La diagnosi è eseguita con la rilevazione di batteri gram-negativi in colture e colorazioni di Gram dell’espettorato di pazienti con caratteristiche cliniche e fattori di rischio coerenti. La terapia dura solitamente 10-14 giorni, a seconda della risposta clinica, e spesso 182 C0020.indd 182 Colorazione di Gram di espettorato contenente Klebsiella pneumoniae Consolidamento del lobo superiore destro con essudato mucinoso e colloide sulla superficie della sezione e nei bronchi, che provoca il caratteristico espettorato a “gelatina di ribes”. Inizio di formazione di ascessi. Pleurite fibrino-purulenta Colonie di Klebsiella su agar Endo. La crescita è viscosa e traslucida e si presenta filante quando viene manipolata con un’ansa Radiografie PA e laterale del torace; Klebsiella pneumoniae, lobo superiore destro prevede la somministrazione di due farmaci attivi contro l’organismo in modo da assicurare efficacia del trattamento ed evitare il rischio di sviluppare resistenza durante la terapia. Le cefalosporine di terza generazione non devono essere utilizzate in monoterapia perché possono stimolare lo sviluppo di organismi resistenti con -lattamasi cromosomiche indotte. Tra gli antibatterici dimostratisi efficaci figurano un aminoglicoside, una penicillina anti-pseudomonas o cefalosporina di quarta generazione, aztreonam, un carbapenemico o anche un fluorochinolone. In alcuni ospedali, sono state osservate epidemie di infezioni nosocomiali causate da ceppi di K. pneumoniae in grado di produrre carbapenemasi, il cui trattamento si è rivelato difficoltoso e spesso infruttuoso. Acinetobacter baumannii è un microrganismo infettivo molto pericoloso nonché un patogeno nosocomiale di importanza crescente e in grado di adattarsi rapidamente negli ospedali. La caratteristica principale di A. baumannii è la capacità di sopravvivere per periodi prolungati nell’ambiente, fattore che contribuisce alla sua trasmissione durante le epidemie. Nei pazienti ospedalizzati è frequentemente causa di polmoniti gravi spesso associate a VAP, ma anche di infezioni del tratto urinario, endocardite, infezione delle ferite, meningite e setticemia, in particolare negli individui con difese immunitarie compromesse. Il genere Acinetobacter comprende batteri gram-negativi, coccobacilli strettamente aerobi, non mobili, catalasi positivi, ossidasi negativi con temperatura ottimale fra 20 e 30 °C. Tuttavia, affinché possa colonizzare un individuo, il microrganismo necessita di due condizioni: 1) abbassamento delle difese immunitarie dell’individuo ospite; 2) cospicua carica infettante. Acinetobacter baumannii è resistente agli antibiotici e sono molti i casi di morte in concomitanza di infezioni incurabili. Doripenem, imipenem e meropenem sono completamente inattivi nei confronti di A. baumannii. Alcuni autori suggeriscono che la colistina per aerosol possa rappresentare un efficace agente terapeutico nel trattamento delle infezioni da A. baumannii che si riscontrano nelle VAP. Tuttavia è preferibile utilizzare tale modalità di somministrazione esclusivamente in caso di fallimento della terapia endovenosa, soprattutto per prevenire le resistenze e le scarse concentrazioni subterapeutiche del farmaco aerosolizzato a livello alveolare. Altri studi hanno segnalato scarsa suscettibilità alla colistina, spesso considerata come farmaco di ultima istanza. Il razionale della terapia di combinazione nelle infezioni da A. baumannii è quello di ridurre la comparsa di ceppi resistenti e di rafforzare l’efficacia del trattamento. A tal fine sono state valutate le combinazioni rifampicina + imipenem, rifampicina + colistina, rifampicina + tobramicina, imipenem + amikacina, imipenem + tobramicina. Un approccio interessante è rappresentato dalla combinazione di carbapenemici + sulbactam. Un nuovo farmaco, la tigeciclina, ha mostrato una buona risposta clinica anche se le combinazioni di antibiotici (in questo caso tigeciclina + colistina) rappresentano, probabilmente, l’arma principale contro questo genere di infezioni, considerate le iniziali resistenze nei confronti della tigeciclina e della colistina quando utilizzate da sole. In definitiva il trattamento ottimale delle infezioni da A. baumannii dipende dalla suscettibilità, dai principi di farmacocinetica e dal sito di infezione. La tigeciclina ha mostrato sinergismo d’azione con levofloxacina, amikacina, imipenem e colistina. Antagonismo d’azione è stato invece osservato nella combinazione tigeciclina/piperacillina-tazobactam. Sono comunque necessari ulteriori studi clinici controllati per valutare le diverse terapie di combinazione, utili per ottimizzare le caratteristiche farmacocinetiche quale preziosa aggiunta all’armamentario terapeutico. L’igiene delle mani e degli ambienti ospedalieri rappresentano, in ogni caso, azioni importanti per mantenere l’infezione sotto controllo. ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 2/10/12 3:20:19 PM Tavola 4.73 Malattie e anatomia patologica VIRUS DELL’INFLUENZA E RELATIVA EPIDEMIOLOGIA POLMONITE VIRALE ACQUISITA IN COMUNITÀ È difficile stimare la frequenza dei virus quale causa della polmonite acquisita in comunità (CAP) giacché i test sierologici di routine vengono eseguiti su un numero esiguo di pazienti (titoli in fase acuta e in convalescenza) e non vi è la disponibilità di test diagnostici di routine per alcuni patogeni virali. Inoltre, le colture virali delle secrezioni presenti nelle vie respiratorie non sono in genere eseguite o non sono disponibili nel contesto della polmonite. Durante l’autunno e all’inizio della stagione invernale, in tutti i pazienti affetti da CAP è necessario considerare l’influenza quale fattore causativo, poiché tale condizione può portare a una polmonite virale primaria o a una polmonite batterica secondaria. Uno studio accurato condotto su più di 300 pazienti non immunocompromessi con CAP ha indagato la natura delle polmoniti mediante sierologie appaiate e ha rilevato un’origine virale nel 18% dei casi, di cui circa la metà ascrivibile a un’infezione virale pura e l’altra a una polmonite batterica mista. L’influenza (il tipo A più del tipo B), la parainfluenza e l’adenovirus si sono rivelati gli agenti virali più frequentemente identificati. Sebbene l’influenza di tipo A e di tipo B siano le cause più comuni di polmonite virale, queste possono essere prevenute in larga misura grazie alla vaccinazione. Esistono altri virus che possono altresì causare gravi forme di polmonite, come dimostrato dalle recenti esperienze di sindromi respiratorie acute (SARS) che hanno palesato il potenziale epidemico della diffusione da un soggetto all’altro di un’infezione respiratoria virulenta di tipo virale. L’eventualità di una polmonite virale epidemica continua a preoccupare, alimentata dalle attuali minacce poste dall’influenza aviaria e dal bioterrorismo con agenti patogeni quali il vaiolo e l’Ebola. EZIOLOGIA VIRALE Influenza Esistono tre tipi di virus RNA: A, B e C. Il tipo A rappresenta il virus respiratorio più importante su scala mondiale, con i tassi di morbilità e mortalità più elevati (Tavole 4.73 e 4.74), e la malattia a esso associata è di solito più grave. Condizioni molto gravi possono essere indotte anche dall’influenza di tipo B, mentre l’influenza C è una malattia di lieve entità che non ha ricorrenza stagionale. Il virus dell’influenza di tipo A possiede due principali glicoproteine superficiali, l’emoagglutinina (H, con 15 sottotipi) e la neuraminidasi (N, con 9 sottotipi), che possono modificarsi di anno in anno (deriva antigenica) rendendo l’immunità pregressa almeno parzialmente inefficace e facendo quindi comparire la malattia in forma epidemica ogni nuovo anno. Seppure di rado, nel virus dell’influenza A possono verificarsi importanti cambiamenti antigenici in conseguenza dei quali gli individui si trovano ad affrontare un nuovo virus contro cui non sono immunizzati. Ciò porta a pandemie a livello mondiale, con tassi di attacco e di mortalità elevati. Sia la deriva antigenica sia la precaria efficacia dell’immunità rendono questa infezione particolarmente minacciosa per i soggetti affetti da cardiopatie croniche pregresse, per i soggetti anziani, per gli individui con infezione da HIV e per le donne in stato di gravidanza. Il virus ha un periodo di incubazione che va dai 2 ai 4 giorni e viene diffuso per via aerea o attraverso il contatto mucosale con le secrezioni infette. Le epidemie annuali si verificano alla fine dell’autunno e si protraggono fino all’inizio della stagione primaverile e possono essere causate da uno di tre tipi di influenza: influenza A/H3N2, influenza A/H1N1 e influenza B. L’influenza A può coesistere con altre infezioni virali, tra le quali il virus respiratorio sinciziale (RSV) e il virus della parainfluenza, in particolare nei soggetti più anziani. ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA C0020.indd 183 Aspetto al microscopio elettronico del virus dell’influenza A2; filamenti e forme sferiche (10.000) A. Virus in sezione a più forte ingrandimento (300.000) B. C. Virus dell’influenza che invade la membrana corioallantoidea di un embrione di pollo. A. Adesione alla membrana cellulare. B. Fusione del rivestimento virale con la membrana cellulare. C. Penetrazione nel citoplasma della cellula Spicola di emoagglutinina Raffigurazione della gemmazione del virus dell’influenza dalla membrana plasmatica della cellula infetta RNA Spicola di neuraminidasi Polipeptidi Doppio strato lipidico della capsula virale Membrana cellulare Strato proteico Citoplasma cellulare Pandemica Relazione tra l’incidenza dell’influenza e i livelli anticorpali della popolazione* *Modificato da Kilbourne Pandemica Livello anticorpale della popolazione per il virus Livello anticorpale della popolazione per un virus antigenicamente differente Epidemica Epidemica Endemica Incidenza dell’influenza Incidenza dell’influenza 9 10 11 12 13 14 15 16 7 8 Tempo (anni) Si osserva una nuova mutazione del virus antigenicamente differente 1 2 3 4 5 6 Introduzione di virus immunologicamente specifici Varicella-zoster Questo virus a DNA è responsabile della varicella, malattia che si manifesta nei bambini con un esantema virale ma che negli adulti può disseminarsi e causare polmonite virale, specialmente nelle donne in stato di gravidanza (Tavola 4.75). Rispetto ai bambini, gli adulti con varicella sono più predisposti a contrarre malattie disseminate. La maggior parte degli studi ha dimostrato che di solito la varicella comporta una complicanza della gravidanza nel 3° trimestre e che quando l’infezione si verifi ca in questo periodo è più grave e complicata. L’incidenza del coinvolgimento polmonare nella varicella durante la gravidanza varia dal 15 al 30%. Quando la varicella sopravviene durante la gravidanza, non solo colpisce la madre ma può anche portare a una sindrome da varicella congenita caratterizzata da ipoplasia dell’arto, 183 2/10/12 3:20:22 PM Tavola 4.74 Apparato respiratorio POLMONITE DA INFLUENZA Faccia laterale del polmone destro. Intensa iperemia ed edema con aree di consolidamento di colore azzurrognolo Sezione trasversale del polmone. Marcata congestione della mucosa bronchiale. Parenchima emorragico ed edematoso con chiazze di consolidamento ed enfisema Setti alveolari ispessiti da edema e da infiltrati cellulari; capillari congestionati; alveoli pieni di cellule epiteliali desquamate contenenti fibrina, leucociti e macrofagi Sezione del polmone che mostra la presenza di membrane ialine e necrosi delle pareti alveolari Radiografie del torace che rivelano una polmonite da influenza nella fase iniziale (a sinistra) e diversi giorni dopo (a destra) in un paziente con stenosi della mitrale POLMONITE VIRALE ACQUISITA IN COMUNITÀ (Seguito) cicatrizzazione cutanea, coinvolgimento del sistema nervoso centrale e altre lesioni scheletriche. Tale embriopatia è stata documentata in casi di insorgenza dell’infezione nella 26a settimana di gestazione. 184 C0020.indd 184 Citomegalovirus Alla luce dei dati sierologici, fino al 60% degli adulti è stato infettato almeno una volta dal citomegalovirus (CMV), ma nei pazienti immunosoppressi, in particolare in quelli con infezione da HIV, questo virus può causare polmonite nel momento in cui si riattiva da una forma latente di infezione (Tavola 4.76). Nei pazienti affetti da HIV, la forma più frequente di infezione è la retinite, ma può anche sopravvenire la polmonite. Altri patogeni virali La SARS può essere un grave tipo di polmonite virale primaria causata da un coronavirus che spesso porta a insufficienza respiratoria (Tavola 4.77). Altri patogeni virali frequenti comprendono l’RSV (bronchiolite, in particolare nei bambini), il rinovirus, l’adenovirus e i virus della parainfluenza (il comune raffreddore). Le cause insolite della polmonite virale comprendono inoltre l’hantavirus (inalazione di feci di roditori, sindrome da distress respiratorio acuto ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 2/10/12 3:20:27 PM Tavola 4.75 Malattie e anatomia patologica POLMONITE DA VARICELLA POLMONITE VIRALE ACQUISITA IN COMUNITÀ (Seguito) Varicella emorragica [ARDS], neutrofilia, trombocitopenia, ematocrito elevato), il morbillo e le infezioni da herpes simplex (pazienti immunocompromessi). Patogenesi Le infezioni virali delle basse vie respiratorie interessano di solito l’albero tracheo-bronchiale o le piccole vie aeree, ma possono anche determinare polmonite primaria. Il virus si localizza inizialmente sulle cellule epiteliali respiratorie e causa la distruzione delle ciglia e della superficie della tonaca mucosa. La risultante perdita della funzione muco-ciliare può quindi predisporre il paziente a una polmonite batterica secondaria. Se l’infezione raggiunge gli alveoli, possono insorgere emorragia, edema e formazione di membrane ialine, seguite dal quadro fisiopatologico e clinico dell’ARDS. Il sito principale di infezione per il virus dell’influenza, ad esempio, è la mucosa respiratoria, che porta alla desquamazione della stessa con degenerazione cellulare, edema e infiammazione delle vie aeree con proliferazione di cellule mononucleate. Quando l’infezione virale dell’apparato respiratorio inferiore è circoscritta alle sole vie aeree, la radiografia del torace risulta normale, ma può non rivelarsi tale se il paziente ha una polmonite virale primaria, una superinfezione batterica o una polmonite combinata virale-batterica. È lo stato delle difese immunitarie del paziente a determinare il patogeno virale più probabilmente responsabile di provocare un’infezione: i pazienti immunocompromessi affetti da AIDS, tumore maligno o che hanno subito un importante trapianto di organo sono spesso colpiti dal CMV, dal virus varicella-zoster e dal virus herpes simplex. Come menzionato nel paragrafo dedicato al citomegalovirus, questi pazienti si ammalano di solito a causa della riattivazione di un’infezione latente contratta anni prima. Anche i soggetti adulti precedentemente sani possono contrarre un’infezione da virus dell’influenza di tipo A e B, della parainfluenza, adenovirus, virus della SARS e virus RSV. L’influenza può inoltre svilupparsi con una maggiore frequenza e con conseguenze più gravi nei soggetti anziani e debilitati. I bambini privi di immunizzazione sono prevalentemente colpiti dal virus RSV e dalla parainfluenza, virus che possono causare infezioni sia delle vie respiratorie sia del parenchima polmonare. I bambini e le reclute militari tendono a sviluppare polmonite secondaria a infezione da adenovirus e influenza. Polmonite da varicella. Infiltrati nodulari in entrambi i lobi inferiori, più marcati e coalescenti nel lato destro Istologia polmonare a basso ingrandimento. Alveoli pieni di fibrina, liquido ed essudato cellulare A forte ingrandimento: infiltrato di cellule mononucleate nell’interstizio e alveoli rivestiti da fibrina MANIFESTAZIONI CLINICHE Influenza La polmonite virale primaria causata dall’influenza può essere una malattia molto grave con infiltrati diffusi e lesioni parenchimali estese, associate a grave ipossiemia. Tale condizione si può frequentemente osservare nei pazienti con malattie cardio-polmonari sottostanti, immunosoppressione o nelle donne in stato di gravidanza. Tuttavia, molti pazienti affetti da polmonite virale primaria contraggono solamente una lieve polmonite “atipica”, con tosse secca, febbre e un reperto radiografico che si rivela più grave di quanto invece si possa evincere sulla base della sintomatologia. Sebbene il 50% delle infezioni influenzali sia costituito da forme subcliniche, quando la malattia tipica è conclamata ha una durata di 3 giorni ed è caratterizzata da una comparsa improvvisa di febbre, brividi, mialgia grave, malessere e cefalea. Nel momento in cui si riducono i sintomi maggiori, predominano quelli respiratori, caratterizzati da tosse secca e algia sottosternale, che possono persistere per diverse settimane. Quando si sviluppa una polmonite virale, la malattia ha il classico decorso di 3 giorni senza intervallo ed è caratterizzata da tosse (secca o produttiva) e dispnea grave. La radiografia del torace rivela infiltrati bilaterali e la mortalità è elevata. La superinfezione batterica polmonare segue la malattia influenzale ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA C0020.indd 185 Cellula gigante mononucleata con una notevole quantità di liquido alveolare primaria con una pausa di 3-4 giorni, in cui il paziente migliora prima dell’esordio della polmonite. In questo contesto, la polmonite è di solito lobare e i patogeni più frequentemente coinvolti sono lo pneumococco, l’Haemophilus influenzae, gli organismi gram-negativi e lo Staphylococcus aureus. Le altre complicanze respiratorie comprendono la bronchiolite obliterante, il croup, l’iperreattività delle vie respiratorie e la riacutizzazione della bronchite cronica. Le complicanze non respiratorie includono la miocardite e la pericardite, la Pustole emorragiche della pleura sindrome di Guillain-Barré, le convulsioni, l’encefalite, il coma, la mielite trasversa, lo shock tossico e l’insufficienza renale. SARS Clinicamente i sintomi, nei pazienti affetti da SARS, si presentano dopo un periodo di incubazione di 2-11 giorni con febbre, tremore, brividi, tosse secca, dispnea, malessere, cefalea e, frequentemente, polmonite e ARDS. I dati di laboratorio non solo rivelano la presenza 185 2/10/12 3:20:39 PM Tavola 4.76 Apparato respiratorio POLMONITE DA CITOMEGALOVIRUS POLMONITE VIRALE ACQUISITA IN COMUNITÀ (Seguito) di ipossiemia ma evidenziano anche un danno alla funzionalità epatica. Durante la fase epidemica iniziale, è stato osservato che fino al 20% dei casi si è verificato negli operatori sanitari, in particolare nei soggetti esposti agli aerosol prodotti dai pazienti infetti tramite la tosse e la starnutazione, ma può altresì verificarsi durante la ventilazione non invasiva e il processo di intubazione endotracheale. Dal 15 al 20% dei pazienti infetti ha sviluppato insufficienza respiratoria, con coinvolgimento polmonare che di norma ha avuto inizio nel 3° giorno di ricovero, ma l’insufficienza respiratoria di solito non si è presentata fino all’8° giorno. Il tasso di mortalità nei pazienti affetti da SARS ricoverati in unità di terapia intensiva ha superato il 30% e il decesso del paziente era in genere riconducibile a insufficienza d’organo multisistemica e sepsi. Non esiste una terapia specifica, ma alcuni report aneddotici hanno suggerito un beneficio correlato alla somministrazione di dosaggi elevati di steroidi e ribavirina. Varicella La varicella, potenziale causa di polmonite, ha un periodo di incubazione che varia dai 14 ai 18 giorni. A livello clinico, la polmonite da varicella si presenta da 2 a 5 giorni dopo l’esordio di febbre, esantema vescicolare e malessere ed è annunciata dalla comparsa di una sintomatologia polmonare che comprende tosse, dispnea, dolore toracico pleuritico e persino emottisi. In una casistica, tutti i pazienti con polmonite da varicella presentavano ulcerazioni della mucosa orale. La gravità della malattia può variare, da quadri caratterizzati da infiltrati radiografici asintomatici a quadri di insufficienza respiratoria fulminante e di danno polmonare acuto (ALI). Di solito, le radiografie del torace rivelano la presenza di infiltrati interstiziali diffusi, nodulari o miliari che si risolvono nell’arco di 14 giorni a meno che non siano complicati da ALI e da insufficienza respiratoria. La gravità degli infiltrati è stata descritta al suo massimo picco con la crescita in altezza delle eruzioni cutanee. Una sequela tardiva della polmonite da varicella è costituita dalla calcificazione polmonare diffusa. Sezione istologica di una polmonite da citomegalovirus; essudato cellulare e fibrinoso negli alveoli e nell’interstizio polmonare oltre a cellule con inclusioni e desquamazione epiteliale Densità diffuse in entrambi i lobi inferiori Immagine a forte ingrandimento di una cellula con corpo incluso e citomegalia Cellule infettate da citomegalovirus colorate con la tecnica di immunofluorescenza Altre manifestazioni Le principali distinzioni cliniche tra i diversi agenti virali che possono causare la polmonite si rintracciano nel tipo di ospite che contrae l’infezione e nel tipo di manifestazioni extrapolmonari che accompagnano la polmonite. I segni extrapolmonari possono suggerire un agente virale specifico. Il rash può essere osservato nella varicellazoster, nel CMV, nel morbillo e nelle infezioni da enterovirus. L’infezione può essere accompagnata da faringite correlata ad adenovirus, influenza ed enterovirus. L’epatite può essere associata al CMV e alla mononucleosi infettiva (virus di Epstein-Barr). La retinite è frequentemente associata al CMV, ma la polmonite non è caratteristica e i pazienti presentano sintomi come dispnea, tosse secca e infiltrati polmonari bilaterali diffusi associati a ipossiemia. DIAGNOSI La diagnosi di malattia virale può essere clinica oppure può essere confermata da specifici esami di laboratorio. I virus possono essere isolati con tecniche speciali di coltura se i campioni sono raccolti e preparati in maniera adeguata. I tamponi delle alte vie respiratorie, l’espettorato, i lavaggi bronchiali, i tamponi rettali e i campioni di tessuto dovrebbero essere collocati in sistemi di trasporto specifici idealmente nelle prime fasi della malattia, quando la diffusione del virus è ancora rilevante. La broncoscopia rappresenta il metodo più importante per il prelievo di campioni dalle vie respiratorie dei pazienti immunocompromessi, campioni che possono essere sottoposti a coltura su alcune linee di cellule in laboratorio, con la possibilità di rilevare la crescita virale nell’arco di 5-7 giorni. Più recentemente, i metodi di isolamento in coltura rapida hanno permesso di identificare i virus nell’arco di 1-2 giorni. Durante questo procedimento, un campione clinico viene centrifugato su un 186 C0020.indd 186 Cellule di tessuto normale (HeLa) sottoposte a coltura Tessuto sottoposto a coltura che presenta un arrotondamento precoce delle cellule a causa del citomegalovirus monostrato di tessuto di coltura e in seguito macchiato con anticorpi specifici per il virus. Le malattie virali possono anche essere facilmente diagnosticate mediante l’immunofluorescenza o con la prova immunoassorbente legata agli enzimi (ELISA) con l’obiettivo di testare i campioni dei pazienti alla ricerca degli antigeni virali. I test di immunofluorescenza sono disponibili per il virus dell’influenza, della parainfluenza, il virus RSV, l’adenovirus, il morbillo, la rosolia, il coronavirus e il virus dell’herpes. Anche i test ELISA sono di- Tessuto sottoposto a coltura con effetti citopatogeni avanzati da citomegalovirus sponibili per la maggior parte di questi agenti patogeni. La sierologia può essere usata retrospettivamente per diagnosticare un’infezione virale sospetta, ma questa tecnica può risultare difficile se non si sospettano virus specifici e non si esegue una ricerca diretta. Una nuova tecnica, che può essere considerata valida, è l’impiego di sonde genetiche per rilevare specifici DNA o RNA virali. Tale metodica è attualmente disponibile per il CMV, il virus della varicellazoster, l’herpes simplex e l’adenovirus. ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 2/10/12 3:20:44 PM Tavola 4.77 Malattie e anatomia patologica SARS (GRAVE SINDROME RESPIRATORIA ACUTA) Cefalea POLMONITE VIRALE ACQUISITA IN COMUNITÀ (Seguito) Caratteristiche del paziente Febbre Malessere Tosse secca TERAPIA Grazie all’interesse e alle nuove conoscenze acquisite in merito alle infezioni virali si sono rese disponibili alcune terapie specifiche che prevedono l’uso di agenti antivirali. I pazienti con polmonite da herpes simplex e varicella-zoster possono essere trattati con aciclovir. L’influenza A può essere trattata o prevenuta mediante la somministrazione di amantadina 200 mg/die o di rimantadina per via orale, che agisce contro la proteina M2 dell’influenza A, oppure con i nuovi inibitori della neuraminidasi oseltamivir e zanamivir (che sono altresì attivi contro l’influenza B). Il dosaggio di amantadina deve essere ridotto in caso di insufficienza renale, e in una percentuale di soggetti trattati compresa tra il 3 e il 7% si può presentare stato confusionale. La rimantadina, un derivato dell’amantadina, è inoltre efficace per il trattamento di pazienti colpiti dal virus influenzale di tipo A. Questo farmaco può essere somministrato una volta al giorno in virtù della sua emivita prolungata e, rispetto all’amantadina, comporta minori effetti collaterali e sul sistema nervoso centrale. Gli inibitori della neuraminidasi possono essere usati durante l’infezione acuta e comportano una riduzione della durata dei sintomi se somministrati entro le 36-48 ore. La ribavirina è stata usata, per via inalatoria, al fine di trattare pazienti con RSV, SARS e influenza B, mentre i pazienti con infezione da CMV sono stati trattati con successo somministrando l’analogo dell’aciclovir DHPG (ganciclovir), valganciclovir o foscarnet. Tutti i pazienti affetti da polmonite da varicella necessitano di un trattamento aggressivo con agenti antivirali e in diversi casi è stato somministrato aciclovir, un inibitore della DNA polimerasi. Tale farmaco è stato impiegato anche nelle pazienti in stato di gravidanza, dimostrando la sua sicurezza e l’assenza di teratogenicità. Si raccomanda un trattamento della durata di 7 giorni. Alcune piccole casistiche di pazienti hanno suggerito un beneficio derivante da una terapia aggiuntiva a base di corticosteroidi a basso dosaggio. Alle donne che durante la gravidanza sono esposte al virus della varicella è possibile somministrare immunoglobuline specifiche a scopo profilattico. Queste possono attenuare l’embriopatia fetale se somministrate entro le 96 ore dal primo contatto. Tremori Danno alveolare diffuso, macrofagi spumosi e cellule sinciziali polinucleate Ipossiemia Test di aumentata funzionalità epatica Riduzione della conta dei linfociti Coronavirus PREVENZIONE Per prevenire l’influenza è disponibile un vaccino e l’immunizzazione dovrebbe essere eseguita con cadenza annuale su tutti i pazienti ad alto rischio con un vaccino specifico per i ceppi che si prevedono più probabilmente epidemici. Il vaccino che viene in genere utilizzato è chimicamente inattivato e coltivato su uova embrionate di pollo (pertanto non può essere somministrato nei pazienti allergici alle uova). Il vaccino annuale è trivalente, con due ceppi di influenza A (H3N2 e H1N1) e un ceppo di influenza B. Inoltre, per i soggetti di età compresa tra i 5 e i 49 anni è disponibile un vaccino vivo attenuato. Tale vaccino include gli antigeni provenienti dai virus dell’influenza A e B e si è rivelato in genere efficace, ma permangono delle perplessità circa il suo utilizzo nei pazienti con HIV o con immunosoppressione grave a causa della sua forma viva. Il vaccino antinfluenzale per via parenterale dovrebbe essere somministrato con cadenza annuale in autunno inoltrato e all’inizio dell’inverno nei soggetti ad alto rischio, categoria che include quelli ad alto rischio di complicanze (persone che hanno più di 65 anni, pazienti ricoverati in case di cura o in strutture per malati cronici, persone con malattie polmonari o cardiache croniche, pazienti affetti da diabete, insufficienza renale o immunosoppressione, donne che saranno nel 2° o nel 3° trimestre di gravidanza durante la stagione influenzale e bambini di età compresa tra i 6 e i 23 mesi) e gli ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA C0020.indd 187 A C B Decorso della malattia individui che possono trasmettere l’influenza a pazienti ad alto rischio (operatori sanitari che lavorano negli ospedali e nelle case di cura e che sono a contatto con i pazienti ricoverati, coloro che forniscono assistenza sanitaria domiciliare ai pazienti ad alto rischio e coloro che hanno contatti domestici con individui ad alto rischio). Se l’epidemia di influenza si sviluppa in ambiente chiuso (ad es. una casa di cura) tra pazienti non immunizzati, insieme al vaccino si dovrebbe somministrare una terapia antivirale, da proseguire per 2 settimane fino a che il vaccino non comincia ad avere effetto. In questo contesto è possibile somministrare sia amantadina sia inibitori della neuraminidasi, tenendo presente che l’amantadina è attiva solo contro l’influenza A, mentre gli inibitori della neuraminidasi agiscono anche contro l’influenza B. 187 2/10/12 3:20:48 PM Tavola 4.78 ASCESSO Apparato respiratorio POLMONARE Un ascesso polmonare è un processo infettivo necrotizzante di tipo suppurativo localizzato (di solito superiore ai 2 cm di diametro) che colpisce il parenchima polmonare e può essere causato da malattie sia respiratorie sia sistemiche. La maggior parte degli ascessi ha una natura primaria e deriva dalla necrosi correlata a una condizione polmonare pregressa (di solito una polmonite infettiva), sebbene la necrotizzazione e l’infezione secondaria possano essere il risultato di una neoplasia polmonare. Gli ascessi polmonari sono associati a neoplasie in una percentuale compresa tra l’8 e il 18% in qualsiasi gruppo di età, ma nei pazienti con età superiore ai 45 anni il 30% presenta un carcinoma associato. Il carcinoma squamoso primario del polmone è il tumore più comunemente associato alla formazione di un ascesso polmonare. Un ascesso può però derivare anche da un processo sistemico come un’embolia vascolare settica (ad es. correlata a endocardite destra) o può essere una complicanza secondaria di un processo polmonare come un’ostruzione bronchiale (ad es. aspirazione di corpi estranei) o la rottura di un ascesso extrapolmonare all’interno del polmone (ad es. empiema). Sebbene qualsiasi agente patogeno necrotizzante possa essere la causa di un ascesso (ad es. Staphylococcus aureus, Pseudomonas aeruginosa, parassiti o micobatteri), il classico ascesso polmonare è causato da batteri anaerobi. Negli ultimi 40 anni, l’incidenza si è ridotta di 10 volte e il tasso di mortalità è sceso dal 5 al 10%, verosimilmente a causa di una maggiore disponibilità di antibiotici per il trattamento della polmonite. PATOGENESI La maggior parte degli ascessi (circa il 90%) è causata da una flora batterica mista, comprendente batteri anaerobi. Organismi aerobi possono essere presenti nel 50% dei pazienti, ma in molti casi coesistono con gli anaerobi. Di solito, un ascesso si verifica quando è presente materiale oro-gengivale infetto in un ospite che ha una predisposizione ad aspirare tale materiale nel polmone e che non è in grado di evitare una simile eventualità sia a causa di una condizione di stato vegetativo sia a causa dell’esposizione a un grosso inoculo (come nell’aspirazione massiva). Lo stato vegetativo può predisporre all’aspirazione nonché compromettere la clearance, ma l’aspirazione può verificarsi anche nei soggetti con disfunzione oro-faringea o esofagea. I pazienti a rischio sono quelli con una storia di alcolismo, disturbi compulsivi, overdose di stupefacenti, anestesia generale, vomito protratto, disturbi neurologici (ad es. ictus, miastenia grave, sclerosi laterale amiotrofica), diverticoli esofagei e fistola gastro-polmonare. L’aspirazione di materiale orogengivale, specialmente in un paziente con scarsa igiene orale, è patogena, sebbene l’aspirazione di contenuti gastrici non sempre esiti in un’infezione, specialmente quando il materiale aspirato è solo acido. In questi casi, può sopravvenire una polmonite chimica. Dati sugli animali e alcuni dati relativi all’uomo indicano che l’ascesso polmonare si sviluppa dopo 7-14 giorni dall’aspirazione di materiale oro-gengivale infetto nei bronchioli terminali. La localizzazione dell’ascesso è determinata dalla gravità e dalla posizione del corpo al momento dell’aspirazione. Ne consegue che i segmenti basali dei lobi inferiori, i segmenti superiori dei lobi inferiori e i segmenti posteriori dei lobi superiori rappresentano i siti di insorgenza più frequenti dell’ascesso. In generale, il polmone destro è maggiormente coinvolto rispetto al sinistro per via dell’orientamento del suo bronco principale, più allineato alla trachea (Tavola 4.79). Sulla base di questi principi, se un ascesso si verifica in un paziente edentulo (senza anaerobi orali) o in un sito diverso da quelli dettati dalla gravità, dovrebbe subentrare il sospetto di un’ostruzione endobronchiale, di una fistola gastro-polmonare o di un’infezione da organismo non anaerobio (ad es. tubercolosi [TB]). Gli organismi anaerobi che più frequentemente causano un ascesso polmonare sono Peptostreptococcus spp. (un cocco anaerobio gram-positivo), Fusobacterium nucleatum, Fusobacterium 188 C0020.indd 188 Sezione sagittale del polmone con ascesso (cavità nel segmento superiore del lobo inferiore contenente liquido e circondata da tessuto fibroso e chiazze pneumoniche). Si osserva anche un ispessimento pleurico sopra l’ascesso Radiografia toracica frontale che mostra una massa estesa all’altezza del lobo superiore destro con livello idroaereo e una parete spessa Immagine TC assiale della stessa lesione; si osserva ancora un livello idroaereo e una spessa parete circostante che appare più marcata con il contrasto, oltre a delle sacche di aria all’interno della massa indicative di necrosi necrophorum, Porphyromonas spp. (precedentemente classificato nel genere Bacteroides) e Prevotella melaninogenicus (anch’esso precedentemente classificato nel genere Bacteroides). Sebbene la maggior parte dei processi polmonari necrotizzanti sia causata da organismi anaerobi, gli altri patogeni necrotizzanti comprendono Staphylococcus aureus, Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, Streptococcus pyogenes, Pseudomonas pseudomallei (melioidosi), Haemophilus influenzae (specialmente il tipo B), Legionella pneumophila, Nocardia asteroides, Actinomyces e raramente pneumococchi, parassiti (Paragonimus westermani, Entamoeba histolytica), funghi e micobatteri. Nelle aree endemiche l’ascesso polmonare (non putrido) può essere causato da coccidioidomicosi, istoplasmosi e blastomicosi. Nei pazienti defedati gli ascessi polmonari sono di solito causati da specie di Aspergillus, Cryptococcus, Nocardia, Phycomyces, micobatteri atipici (in particolare M. avium-intracellulare o M. kansasii) o da bacilli gram-negativi. ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 2/10/12 3:20:50 PM Tavola 4.79 ASCESSO Malattie e anatomia patologica POLMONARE (Seguito) Il bronco principale destro è più allineato alla trachea rispetto a quello sinistro. Ciò comporta una maggiore probabilità di aspirazione e una maggiore incidenza di ascesso sul lato destro ASPETTI CLINICI Un ascesso polmonare acuto si presenta con una sintomatologia di durata inferiore a 2 settimane e di solito è causato da batteri patogeni aerobi virulenti, sebbene in pazienti con ascessi polmonari cronici (sintomi che perdurano per più di 4-6 settimane) sia più probabile l’eventualità di un cancro sottostante o di un’infezione con un agente anaerobio meno virulento. Nella maggior parte dei pazienti affetti da ascesso polmonare l’esordio è alquanto insidioso, con sintomi che perdurano da almeno 2 settimane al momento della valutazione. Un ascesso polmonare tende ad aprirsi in un bronco e il suo contenuto fuoriesce con l’espettorato, residuando nel polmone una cavità con livello idroaereo. In alcuni casi l’ascesso può svuotarsi nella cavità pleurica, dando luogo a un empiema con fistola bronco-pleurica. Altre volte è possibile osservare una disseminazione del pus nelle vie aeree cui consegue un quadro di polmonite diffusa. I reperti comprendono tosse, espettorato maleodorante che stratifica sedimentando, emottisi (nel 25% dei pazienti), febbre, brividi, sudorazione notturna, anoressia, dolore toracico pleuritico (nel 60% dei pazienti), calo ponderale e ippocratismo. La presenza di espettorato maleodorante o putrido, la cui assenza non esclude la diagnosi, è fortemente indicativa di infezione anaerobia. Anche il calo ponderale è un reperto comune riscontrato nel 60% dei pazienti (con un calo medio compreso tra 7 e 9 kg) che rafforza ulteriormente il sospetto di neoplasia maligna. ESAMI DIAGNOSTICI La coltura dell’espettorato può avere una valenza se mostra la presenza di patogeni non anaerobi ma, poiché il campione deve passare attraverso la cavità oro-faringea, il reperto di patogeni anaerobi (che devono essere specificatamente ricercati) è di modesta utilità. La broncoscopia può essere utile per escludere un’ostruzione endobronchiale e per favorire il drenaggio dell’ascesso. Se l’ascesso è associato a un empiema, come nel 30% di casi, allora può essere utile eseguire una coltura del liquido pleurico. L’esame radiografico è necessario per definire la presenza di una lesione polmonare cavitaria e di solito mostra una lesione cavitaria solitaria dal diametro di 2-4 cm con un livello idroaereo. Quando intorno all’area ascessuale si verifica una flogosi estesa vi è la probabilità di un’infezione. All’esame radiografico, le neoplasie tendono ad avere minori infiltrati nell’area circostante. Le cavità polmonari causate dalla TB si presentano con un aspetto differente e tendono ad avere una parete sottile, senza livelli idroaerei. Talvolta è necessario ricorrere alla TC per distinguere un ascesso polmonare da un empiema, che di solito rimane confinato nello spazio pleurico. Alla TC, un ascesso polmonare appare di norma come una cavità dalle pareti sottili e irregolari senza alcuna compressione polmonare associata, mentre un empiema è caratterizzato da una parete liscia e sottile ed è accompagnata dalla compressione del polmone non coinvolto. Quando un ascesso polmonare viene complicato da una fistola bronco-pleurica può risultare difficile differenziarlo da un empiema. La rilevazione di lesioni cavitarie multiple all’esame radiografico di solito suggerisce una polmonite necrotizzante causata da un organismo non anaerobio virulento e la possibilità di un’embolia polmonare settica. Polmone sinistro Segmento basale posteriore, lobo inferiore Segmento superiore, lobo inferiore Polmone destro Segmento posteriore, lobo superiore Segmento superiore, lobo inferiore Sebbene il polmone sinistro sia meno frequentemente In posizione supina, il segmento posteriore interessato, i segmenti superiore e basale posteriore del lobo superiore destro e il segmento superiore del lobo inferiore sono più vulnerabili su questo lato del lobo inferiore sono più vulnerabili agli ascessi per aspirazione a causa delle influenze gravitazionali Ascessi polmonari multipli in seguito a embolizzazione settica Ascessi localizzati distalmente all’ostruzione bronchiale (in questo caso a causa di un carcinoma) TERAPIA Prima che fossero disponibili gli antibiotici, il trattamento prevedeva terapia di supporto, drenaggio posturale con o senza broncoscopia e, infine, chirurgia. Attualmente, la terapia verte principalmente sulla somministrazione di antibiotici diretti contro gli anaerobi oro-gengivali. Il trattamento antibiotico iniziale è di solito costituito da penicillina o clindamicina per via endovenosa. Sebbene la penicillina rappresenti storicamente la terapia di prima scelta, alcuni studi recenti l’hanno messa a confronto con la clindamicina e hanno rilevato che la clindamicina è associata a minori insuccessi terapeutici ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA C0020.indd 189 e a una più rapida risoluzione dei sintomi. Il metronidazolo non è raccomandato e ha una percentuale di insuccesso che supera il 40%. Di solito la terapia è molto lunga e viene proseguita fino a che non si siano risolti gli infiltrati polmonari o fino a che la lesione residua non si sia ridotta e stabilizzata e la cavità si sia chiusa. Molti pazienti necessitano di un periodo complessivo di terapia antimicrobica che va delle 6 alle 8 settimane. Le complicanze dell’ascesso polmonare comprendono la formazione di un empiema conseguente a una fistola bronco-pleurica, un’emottisi massiva, una rottura spontanea nei segmenti del polmone non interessato e la mancata risoluzione della cavità ascessuale. Sebbene poco frequenti, tali complicanze richiedono spesso una terapia medica prolungata nonché l’intervento chirurgico, con l’introduzione di una sonda per toracostomia nel caso dell’empiema oppure con la resezione polmonare in caso di un’emottisi massiva. L’ascesso polmonare viene trattato chirurgicamente con resezione segmentale o lobectomia. La pneumonectomia è invece indicata nel caso di ascessi multipli o di gangrena polmonare che non rispondono alla terapia medica. 189 2/10/12 3:20:52 PM Tavola 4.80 Apparato respiratorio PANORAMICA SULLA POLMONITE ASSOCIATA A CURE MEDICHE, ACQUISITA IN OSPEDALE E ASSOCIATA A VENTILAZIONE MECCANICA DEFINIZIONI ED EPIDEMIOLOGIA DELLA POLMONITE ASSOCIATA A CURE MEDICHE La polmonite associata a cure mediche (HCAP) è il tipo di polmonite che si osserva nei pazienti che hanno avuto contatti con l’ambiente sanitario prima di sviluppare la malattia e quindi sono a rischio di colonizzazione e infezione con patogeni potenzialmente farmacoresistenti. Questo gruppo comprende i pazienti che sono stati ricoverati in ospedale per almeno 2 giorni nell’arco dei 3 mesi precedenti, i pazienti che provengono da un ospedale, una casa di cura o da una struttura per l’assistenza intensiva, i soggetti che si sottopongono a emodialisi o che sono medicati a domicilio e coloro che hanno contatti con un familiare portatore di patogeni farmaco-resistenti. Poiché la maggior parte di questi pazienti è a rischio di infezione da organismi multifarmaco-resistenti (MDR) gram-negativi e grampositivi, essi non rientrano nella categoria della polmonite acquisita in comunità (CAP) ma sono attualmente definiti come soggetti affetti da HCAP. I fattori di rischio clinico per i patogeni MDR comprendono polmonite grave, stato funzionale carente, antibioticoterapia recente (somministrata negli ultimi 3 mesi), ricovero recente e immunosoppressione (compresa terapia a base di corticosteroidi). È importante riconoscere i pazienti con HCAP in quanto alcuni di essi possono presentare uno spettro di agenti eziologici molto più complesso rispetto ai pazienti con CAP, compreso un tasso di mortalità più elevato, ricoveri più lunghi, maggiore frequenza di aspirazione e una maggiore frequenza di terapie antibiotiche empiriche non adeguate. In questo frangente, i pazienti con HCAP sono paragonabili a quelli affetti da polmonite acquisita in ospedale (HAP). FATTORI DI RISCHIO PER LA POLMONITE ACQUISITA IN OSPEDALE Fattori di rischio specifici per il paziente Immunodepressione Età avanzata Alterazione dei livelli di coscienza Nutrizione parenterale C0020.indd 190 Abuso di alcol Abuso di sostanze stupefacenti Intervento chirurgico recente Esposizione recente agli antibiotici Fattori di rischio per l’infezione con organismo antibiotico-resistente Ricovero prolungato 190 Tabagismo Malnutrizione Fattori di rischio legati alla terapia DEFINIZIONI ED EPIDEMIOLOGIA DELLA POLMONITE ACQUISITA IN OSPEDALE E ASSOCIATA A VENTILAZIONE MECCANICA Nei pazienti critici, la polmonite costituisce la seconda infezione più frequente acquisita nelle unità di terapia intensiva e quella che più probabilmente porta alla morte. Per definizione, la polmonite acquisita in ospedale (HAP), o polmonite nosocomiale, sopravviene dopo che il paziente ha trascorso in ospedale almeno 48 ore e può colpire sia i pazienti intubati e sottoposti a ventilazione meccanica sia quelli che non lo sono. Se il paziente sviluppa la polmonite dopo almeno 48 ore di intubazione si parla di polmonite associata a ventilazione meccanica (VAP). La HAP si presenta con maggiore frequenza in qualsiasi popolazione di pazienti con funzione immunitaria compromessa (per effetto di gravi malattie sottostanti o a causa di una disfunzione immunitaria associata alla terapia) e con una maggiore esposizione dell’apparato respiratorio ai batteri (per aspirazione con o senza la presenza del tubo endotracheale). La VAP è presente in una percentuale di pazienti sottoposti a ventilazione meccanica compresa tra il 20 e il 50%, in funzione dei criteri diagnostici adottati e dei fattori di rischio nella popolazione di pazienti presa in esame. Il rischio di polmonite aumenta parallelamente alla durata della ventilazione meccanica. Il 40% dei casi di VAP è caratterizzato da un esordio precoce (nei primi 5 giorni di ricovero). Oltre alla ventilazione meccanica, altri fattori di rischio per la polmonite nosocomiale sono rappresentati da un’età superiore ai 60 anni, malnutrizione (albumina sierica <2,2 g/dL), un danno polmonare acuto (sindrome da distress respiratorio acuto), coma, ustioni, un intervento chirurgico addominale o toracico recente, un’insufficienza multiorgano, la trasfusione di una quantità di sangue superiore a 4 unità, il trasferimento dall’unità di terapia intensiva, Obesità Malattia cronica sottostante Residenza in casa di cura Malattie croniche Pregressa esposizione agli antibiotici Terapia infusionale domiciliare o medicazioni a domicilio Ricovero recente una terapia antibiotica pregressa, l’aumento del pH gastrico (a opera di agenti bloccanti H2 e antiacidi), un grande volume di aspirazione, l’uso del sondino naso-gastrico (piuttosto che un tubo posizionato nel digiuno o un tubo inserito attraverso la bocca), una pressione inadeguata del tubo endotracheale (per l’aspirazione delle secrezioni orali nelle vie respiratorie inferiori), la sedazione prolungata e la paralisi, l’allettamento protratto del paziente in posizione supina, l’uso dell’alimentazione parenterale piuttosto che di quella enterale e, infine, le ripetute intubazioni. Il tasso di mortalità per i pazienti con HAP può raggiungere una percentuale che va dal 50 al 70% nei pazienti sottoposti a ventilazione meccanica. Inoltre, l’odds ratio di mortalità nei pazienti che contraggono la VAP è quasi il doppio di quello riscontrato nei pazienti che non ne sono colpiti e la presenza della VAP può prolungare la durata del ricovero di almeno 6-7 giorni. I fattori che contribuiscono maggiormente alla mortalità correlata alla VAP sono una terapia antibiotica inappropriata (non efficace contro i patogeni eziologici identificati), la presenza di alcuni organismi farmaco-resistenti ad alto rischio (ad es. Pseudomonas aeruginosa, Acinetobacter spp., o Staphylococcus aureus) e lo sviluppo della malattia in un paziente Emodialisi Immunodepressione sottoposto a terapia medica (piuttosto che chirurgica). Gli altri fattori di rischio legati alla mortalità per HAP comprendono il coma al momento del ricovero, un livello di creatinina >1,5 mg/dL, il trasferimento da un reparto all’unità di terapia intensiva, anomalie radiologiche bilaterali, un’età superiore ai 60 anni, una condizione sottostante che si rivela fatale, lo shock, una terapia antibiotica pregressa, una polmonite da superinfezione, un’insufficienza d’organo multisistemica e un punteggio APACHE in aumento durante la terapia per la polmonite. CAUSA ED ESAMI DIAGNOSTICI Esistono numerosi schemi di classificazione per la HAP che suddividono i pazienti in diverse categorie in base alla predisposizione ai diversi patogeni specifici. Se il paziente è colpito da un’infezione a esordio precoce (entro i primi 5 giorni di ricovero) e non presenta fattori di rischio per i patogeni MDR (ricovero recente, terapia antibiotica recente, presenza di HCAP) sarà più probabilmente colpito da un gruppo di “patogeni di base” che comprendono organismi gram-negativi non resistenti (Escherichia coli, Klebsiella spp., Enterobacter spp., Serratia marcescens ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 2/10/12 3:20:59 PM Tavola 4.81 PANORAMICA SULLA POLMONITE ASSOCIATA A CURE MEDICHE, ACQUISITA IN OSPEDALE E ASSOCIATA A VENTILAZIONE MECCANICA (Seguito) e Proteus spp.), S. aureus sensibile alla meticillina e pneumococco. Al contrario, se il paziente viene colpito da un’infezione a esordio tardivo (dopo 5 o più giorni) o presenta un qualsiasi fattore di rischio per i patogeni MDR, oltre a essere esposto al rischio di infezione con i suddetti patogeni, è considerato anche a rischio di infezione da organismi MDR gram-negativi come P. aeruginosa e Acinetobacter spp. e da microrganismi produttori di -lattamasi a spettro esteso (ESBL) come Klebsiella ed Enterobacter spp. oppure da organismi MDR gram-positivi come lo S. aureus resistente alla meticillina (MRSA). La diagnosi di HAP, in particolare di VAP, è controversa in quanto i criteri diagnostici clinici sono sensibili ma non specifici per l’infezione. Tali criteri comprendono l’individuazione di un infiltrato polmonare nuovo o progressivo oltre ad almeno due delle seguenti condizioni: temperatura <36,0 °C o >38,3 °C, conta leucocitaria superiore ai 10.000/mm3 o <5.000/mm3 ed espettorato purulento. Il peggioramento dell’ossigenazione è un altro reperto clinico frequente nei pazienti affetti da polmonite. Tutti questi reperti, tuttavia, non sono specifici per la polmonite e pertanto devono essere integrati con esami microbiologici per definire la presenza sia della polmonite sia dell’agente eziologico. Sebbene alcuni studi indichino che la gestione clinica può essere migliorata quando le decisioni terapeutiche vengono modulate sulla base dei risultati di esami colturali quantitativi, questo dato non è stato confermato in maniera univoca, oltre al fatto che gli esami colturali quantitativi non vengono usati di routine per stabilire la diagnosi di HAP e di VAP. La terapia, inizialmente empirica, si basa sui patogeni eziologici più probabili e viene di solito impostata con un singolo agente se si prevede la presenza di soli “patogeni di base”, sebbene si debba ricorrere a un regime multifarmaco ad ampio spettro nel caso in cui sussista la possibilità di infezione da patogeni MDR. Non appena i risultati delle colture sono disponibili la terapia verrà calibrata sulla base dell’organismo o degli organismi identificati. Malattie e anatomia patologica ESAMI IN CASO DI SOSPETTA POLMONITE ACQUISITA IN OSPEDALE Radiografie del torace Esami di laboratorio Coltura dell’espettorato e colorazione di Gram Esame broncoscopico RESISTENZA AGLI ANTIBIOTICI Quando un paziente sviluppa la HAP o la VAP, vi è una forte probabilità che l’agente eziologico sarà resistente all’antibiotico. Nei pazienti affetti da VAP, la frequenza può superare il 50% se il paziente è stato ricoverato per almeno 7 giorni e gli sono stati precedentemente somministrati antibiotici. Gli organismi farmaco-resistenti non sono intrinsecamente più virulenti rispetto ai patogeni sensibili ma, poiché spesso non sono previsti, la terapia iniziale può rivelarsi scorretta, fattore che contribuisce all’eccessiva mortalità associata a questi organismi quando sono causa di VAP. Vale comunque la regola che più un determinato antibiotico è usato, maggiore sarà il rischio che si sviluppino fenomeni di resistenza, rendendolo sempre meno efficace. Possono nascere così nuovi ceppi batterici in grado di resistere anche a diversi antibiotici. ORGANISMI GRAM-NEGATIVI MULTIFARMACO-RESISTENTI I pazienti colpiti da VAP contraggono più frequentemente infezioni da organismi gram-negativi, tra i quali P. aeruginosa, Acinetobacter baumannii, K. pneumoniae ed enterobatteri produttori di -lattamasi a spettro esteso (ESBL), tutti organismi che possono essere resistenti agli antibiotici, rendendo quindi difficile la terapia. Di questi, P. aeruginosa è il batterio più frequentemente responsabile dell’insorgenza di VAP, ma A. baumannii mostra una frequenza crescente e in molti ospedali si verificano epidemie causate da enterobatteri produttori di ESBL e batteri K. pneumoniae produttori di carbapenemasi, il che rende l’esposizione a questi patogeni abbastanza rischiosa. ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA C0020.indd 191 Light guid P. aeruginosa è un organismo particolarmente virulento in quanto produce esoenzimi distruttivi ed è resistente a un’ampia gamma di antibiotici. I pazienti presentano spesso colonizzazione delle vie respiratorie superiori (orofaringe) prima che si verifichino la colonizzazione e l’infezione del polmone, ma è possibile assistere anche a una colonizzazione primaria dell’apparato respiratorio inferiore. Nelle unità di terapia intensiva, la polmonite nosocomiale rappresenta la maggiore fonte di preoccupazione, ma P. aeruginosa può anche determinare lo sviluppo di tracheo-bronchite associata a ventilazione meccanica, un’infezione delle vie aeree che può successivamente progredire in polmonite. Questo organismo è inoltre implicato nelle infezioni croniche delle vie respiratorie come le bronchiectasie, associate o meno a fibrosi cistica. La prevalenza di P. aeruginosa quale patogeno nosocomiale è riconducibile al fatto che tale batterio può crescere praticamente in qualsiasi ambiente e produce un’ampia gamma di fattori virulenti che gli permettono di infettare pressoché qualsiasi sito corporeo. Inoltre, è in grado di produrre un biofilm sulla superficie del tubo endotracheale e di persistere a dispetto degli antibiotici e dei meccanismi di difesa dell’ospite. In presenza di una notevole molteplicità di batteri, questi organismi sono in grado di coordinare la loro crescita su un biofilm e superare le difese dell’ospite attraverso un quorum sensing, che viene favorito dal rilascio di sostanze di segnalazione. STAPHYLOCOCCUS AUREUS RESISTENTE ALLA METICILLINA Come si ricorderà, questo organismo è già stato menzionato nelle pagine precedenti quale possibile causa di CAP. Il ceppo di Staphylococcus aureus resistente alla meticillina (MRSA) responsabile della polmonite nosocomiale è differente in quanto possiede una maggiore resistenza agli antibiotici rispetto al ceppo acquisito in comunità ed è più incline a causare un’infezione polmonare. Diversamente dalla polmonite da MRSA acquisita in comunità, questa non è una malattia clonale e i fattori di virulenza batterica non sono così rilevanti. I fattori di rischio clinico più importanti legati all’MRSA in quanto patogeno della polmonite nosocomiale sono le malattie neurologiche acute, l’emodialisi, le malattie cardiache e il trapianto di organo solido. La maggior parte delle polmoniti non è accompagnata da batteriemia, ma quando accade si deve presupporre un’endocardite. I pazienti possono inoltre sviluppare un’infezione metastatica a livello cerebrale, nelle ossa e negli organi solidi che richiede una terapia prolungata (4-6 settimane). 191 2/10/12 3:21:00 PM Tavola 4.82 Apparato respiratorio Splenectomia POLMONITE NELL’OSPITE C0020.indd 192 Anomalia funzionale dei linfociti T Eziologia COMPROMESSO Quando i pazienti con immunodeficienze specifiche correlate a una malattia primaria sottostante (spesso un tumore maligno o un’infezione da HIV) o derivanti da una terapia medica (ad es. immunosoppressione associata a chemioterapia o a trapianto) sviluppano infezioni respiratorie vengono definiti ospiti immunocompromessi (ICH). Negli ultimi anni, le infezioni da HIV hanno prodotto una vasta e importante popolazione di ospiti immunocompromessi suscettibili di sviluppare polmonite. In qualsiasi ospite immunocompromesso, un nuovo infiltrato polmonare può essere di origine infettiva o non infettiva (ad es. reazione avversa a un farmaco, emorragia polmonare o danno polmonare acuto). Per via dell’ampio spettro di patogeni potenziali e della gravità della polmonite negli ospiti immunocompromessi, la terapia empirica è spesso accompagnata da notevoli sforzi destinati alla formulazione di una diagnosi eziologica specifica. La causa di infezione in un ospite immunocompromesso è di solito correlabile al tipo di immunodeficienza (Tavola 4.82). I pazienti con esperienza di splenectomia (compresi quelli con anemia falciforme e autosplenectomia), ad esempio, di solito contraggono un’infezione da batteri incapsulati come pneumococchi, stafilococchi, Haemophilus influenzae e Neisseria meningitidis. I pazienti con neutropenia indotta da chemioterapia possono contrarre un’infezione da Pseudomonas aeruginosa, da altri batteri gram-negativi e da Aspergillus spp. I pazienti che invece presentano un’anomalia funzionale dei linfociti T, come quelli affetti da determinati tipi di linfoma o da HIV, possono contrarre un’infezione da batteri come Listeria monocytogenes, Salmonella spp., Legionella spp., Mycobacterium avium o Mycobacterium tuberculosis, da funghi come Cryptococcus neoformans, Histoplasma capsulatum o Coccidioides immitis, da virus come il CMV e l’herpes simplex, oppure da parassiti come Pneumocystis jiroveci, Toxoplasma gondii o Cryptosporidium spp. Nei pazienti con infezione da HIV, il tipo di infezione che si sviluppa è direttamente correlato alla conta dei linfociti CD4. I soggetti che presentano una disfunzione immunitaria moderata e una conta dei linfociti CD4 >500 per mm3 di solito non sviluppano un’infezione opportunistica e la polmonite che li colpisce è in prevalenza batterica, in particolare pneumococcica. I pazienti con una conta compresa tra 200 e 500 linfociti CD4 per mm3 sono più predisposti a contrarre infezioni di origine batterica o da M. tuberculosis. Nel momento in cui la conta dei CD4 diminuisce ulteriormente, aumenta il rischio di contrarre un’infezione opportunistica e i pazienti con una conta <200 per mm3 corrono un particolare rischio di contrarre un’infezione da organismi come P. jiroveci. Con una conta <100 per mm3 c’è motivo di temere una toxoplasmosi, e al di sotto dei 50 linfociti CD4 per mm3 diventa più probabile un’infezione da CMV, M. avium e Cryptococcus spp. I pazienti immunocompromessi devono essere sottoposti a un accurato esame clinico, con particolare attenzione per lo stato della cute, dell’apparato gastrointestinale, del sistema nervoso centrale, del fondo oculare, del fegato e dei polmoni. In alcuni casi è possibile riscontrare tosse e dispnea, ma i sintomi respiratori possono rivelarsi minimi e l’unico reperto può essere costituito dalla febbre. Alcuni reperti extrapolmonari possono suggerire un agente eziologico che accompagna un difetto immunitario specifico. Le lesioni cutanee possono verificarsi a causa di infezioni da P. aeruginosa, Aspergillus spp., M. tuberculosis, Nocardia spp., varicella-zoster, herpes simplex, Cryptococcus spp. e Blastomyces spp. Il sistema nervoso centrale può contrarre un’infezione da Nocardia spp., pneumococco, H. influenzae, P. aeruginosa, M. tuberculosis, Legionella spp., Aspergillus spp., Cryptococcus spp., Toxoplasma 192 Neutropenia indotta da chemioterapia Batteri come Listeria monocytogenes, Salmonella spp., Legionella spp., Mycobacterium avium o M. tuberculosis A rischio di Batteri incapsulati (ad es. pneumococco, stafilococchi, H. influenzae e N. meningitidis) P. aeruginosa, altri batteri gram-negativi e Aspergillus spp. Funghi come Cryptococcus neoformans, Histoplasma capsulatum, Pneumocystis jirovecii o Coccidioides immitis Virus come il citomegalovirus e l’herpes simplex Parassiti come Toxoplasma gondii o Cryptosporidium spp. Infezione in seguito a trapianto d’organo Trapianto 1 mese Infezioni nosocomiali MRSA VRE Pseudomonas Con PCP e profilassi antivirale Infezioni latenti HSV HIV Aspergillus Candida Senza PCP e profilassi antivirale CMV CMV Pneumocystis Adenovirus Herpes simplex Toxoplasma Influenza EBV Strongyloides Tubercolosi VZV Nocardia Cryptococcus Listeria Con o senza PCP e profilassi antivirale Coccidioidomicosi Legionella spp. Istoplasmosi Zigomicosi 6 mesi Infezioni acquisite in comunità SARS CMV spp., varicella-zoster e CMV. Eventuali anomalie della funzione epatica possono essere causate da infezioni da CMV, Legionella spp. e Nocardia spp., tubercolosi, istoplasmosi, toxoplasmosi e infezioni da Staphylococcus aureus e Pseudomonas aeruginosa. La diarrea può essere causata da Legionella spp., Cryptosporidium spp., CMV o herpes simplex. In seguito a trapianto di organo, i pazienti possono contrarre un’infezione correlata al ricovero, a una condizione di malattia grave Nocardia Herpes simplex Aspergillus Aspergillus Polmonite acquisita in comunità o all’immunosoppressione conseguente al trapianto. Nel primo mese dopo l’intervento chirurgico, le infezioni che colpiscono i pazienti sono causate da batteri nosocomiali e da Candida spp., mentre nel periodo che va da 1 a 6 mesi dopo il trapianto l’infezione è associata all’immunosoppressione e può essere causata da CMV, P. jiroveci, agenti micotici (muffe come Aspergillus spp., zigomicosi e lieviti come Histoplasma spp. e Coccidioides spp.), L. monocytogenes e Legionella spp. Dopo 6 mesi, questi stessi patogeni possono causare ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA 2/10/12 3:21:03 PM Tavola 4.83 Malattie e anatomia patologica CLICCA QUI per acquistare il volume Immunodepressione Terapia steroidea Trapianto Polmonite da Pneumocystis jirovecii POLMONITE NELL’OSPITE COMPROMESSO Cuore Midollo osseo (Seguito) Rene Fattori predisponenti Infezione da HIV infezione nei pazienti fortemente immunocompromessi, sebbene un’infezione virale cronica (ad es. da CMV) possa svilupparsi nei soggetti con una compromissione meno pesante. La radiografia del torace può rivelare caratteristiche specifiche in presenza di determinati patogeni. In caso di malattie batteriche, micotiche e micobatteriche, ad esempio, è possibile osservare lesioni polmonari focali. Infiltrati diffusi si riscontrano invece in presenza di infezioni da P. jiroveci, CMV e Legionella, tubercolosi miliare, polmonite virale e infezioni da Aspergillus spp. e Candida spp. La gestione di solito comprende una terapia empirica basata sui fattori di rischio per patogeni specifici integrata da procedure diagnostiche (spesso broncoscopia o biopsia polmonare a cielo aperto), in particolare nei pazienti non responsivi. Leucemia Linfoma POLMONITE ASSOCIATA A INFEZIONE DA HIV I pazienti con infezione da HIV presentano un’insufficienza funzionale delle cellule T nonché una disfunzione dell’immunità umorale e possono essere infettati da batteri, funghi, virus o parassiti. Le polmoniti più frequenti nei pazienti immunocompromessi colpiti da un’infezione da HIV sono causate da P. jiroveci (Tavola 4.83) e dallo pneumococco. Nell’infezione precoce da HIV con immunosoppressione profonda di solito si osserva un’infezione da P. jiroveci, ma in seguito alla terapia con agenti antiretrovirali le cause più frequenti di infezione respiratoria sono costituite da batteri patogeni. L’infezione da P. jiroveci può essere individuata grazie alla colorazione con argento metenamina o con la colorazione di Giemsa, di solito su campioni di tessuto polmonare o di liquido utilizzato per il lavaggio bronco-alveolare (BAL). Nella maggior parte dei casi, il paziente contrae l’infezione da P. jiroveci da fonti ambientali prima del sopravvenire dell’infezione da HIV e la polmonite ne rappresenta spesso una riattivazione; non si esclude tuttavia la possibilità di una nuova infezione primaria e di una reinfezione. Un numero considerevole di pazienti si presenta con un quadro subacuto caratterizzato da febbre, tosse, dispnea e calo ponderale. Possono inoltre manifestarsi sintomi come dolore toracico, malessere, affaticamento e sudorazione notturna, ma in taluni casi i pazienti possono anche essere asintomatici. La radiografia del torace di solito evidenzia infiltrati bilaterali interstiziali o alveolari diffusi. Talvolta è possibile osservare infiltrati asimmetrici o focali, come anche patologie prevalentemente a carico dei lobi superiori e noduli polmonari solitari. I reperti meno frequenti comprendono pneumotorace e versamento pleurico. In passato sono state documentate patologie localizzate nei lobi superiori e pneumotorace, in particolare quando ai pazienti veniva somministrata pentamidina per via inalatoria come profilassi contro l’infezione da P. jiroveci. La diagnosi di infezione da P. jiroveci viene di solito formulata eseguendo una broncoscopia con BAL o una biopsia transbronchiale. Oltre a una radiografia compatibile, altre caratteristiche cliniche comprendono quadri di leucopenia e linfopenia, alti livelli sierici di lattato deidrogenasi, candidosi orale e un più ampio gradiente alveolo-arterioso di pressione dell’ossigeno. L’infezione da P. jiroveci può coesistere con altre infezioni opportunistiche come il CMV, la toxoplasmosi o le malattie micobatteriche. Somministrando la terapia, si registra un miglioramento più lento nei pazienti con AIDS rispetto che nei pazienti immunocompromessi che hanno contratto un’infezione da P. jiroveci. La febbre può persistere per 7-10 giorni e la sopravvivenza complessiva raggiunge il 90%. La terapia ha ATLANTE DI ANATOMIA, FISIOPATOLOGIA E CLINICA C0020.indd 193 Infiltrati polmonari bilaterali diffusi Infiltrazione interstiziale di linfociti e di plasmacellule con essudato spumoso negli alveoli Colorazione con AgNO3-metenamina che rivela la presenza di Pneumocystis nel polmone (macchie nere) inizio con la somministrazione per via endovenosa di trimetoprimsulfametoxazolo (15-20 mg/kg/die di trimetoprim e 75-100 mg/kg/ die di sulfametoxazolo), ma se il paziente non riesce a tollerare o non risponde alla terapia, allora è necessario instaurare una terapia con agenti alternativi quali pentamidina (4 mg/kg/die) o atovaquone (750 mg per via orale, 3 volte al giorno). Sono stati impiegati anche trimetrexate e pentamidina per aerosol, che tuttavia si sono dimostrati in genere meno efficaci rispetto alla terapia standard. Nella Colorazione con argento di microrganismi con cisti maggior parte dei regimi, la terapia viene protratta per 21 giorni, e se la malattia porta a ipossiemia, con una PaO2 in aria ambiente <60 mmHg, l’aggiunta di corticosteroidi diventa necessaria al fine di migliorare la risposta infiammatoria dell’ospite contro gli organismi nel corso della terapia. Dopo la risoluzione della polmonite, per combattere le infezioni ricorrenti i pazienti devono essere sottoposti a chemioprofilassi, con la somministrazione di trimetoprim-sulfametoxazolo o agenti alternativi. 193 2/10/12 3:21:03 PM
Scaricare