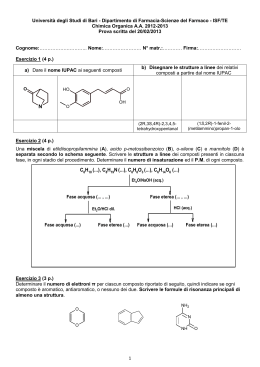
Isomeria Due composti sono isomeri se hanno la stessa formula bruta, ovvero tipo e numero di elementi, ma differiscono nella disposizione reciproca. Tipicamente ciò non altera le caratteristiche chimiche ma quelle fisiche, in particolare il punto di ebollizione e, come vedremo, quelle biologiche. L’isomeria più semplice è quella di posizione, che riguarda sostanzialmente la disposizione lineare o ramificata dei vari “gruppi” che costituiscono la molecola CH3 CH2 butano CH2 CH3 CH3 CH CH3 2-metil-propano CH3 Oppure può riguardare la posizione dei sostituenti (ovvero degli elementi o gruppi chimici che “sostituiscono” un Idrogeno nella catena idrocarburica, come nell’isomeria geometrica Cl Cl C H C C Cl H Cl H cis-1-2-di-cloro-etilene C H trans-1-2-di-cloro-etilene dove le indicazioni cis e trans si riferiscono sostanzialmente alla posizione dei sostituenti (Cl) dalla stessa parte del piano su cui giace la molecola o su piani diversi (“sopra e sotto”). Il doppio legame infatti è rigido, “blocca” la molecola in una conformazione ben precisa e stabile mentre il legame semplice permette la libera rotazione del legame e degli atomi ad essi collegati. Infatti un caso abbastanza comune nei composti biologici è l’isomeria ottica, con composti che hanno un Carbonio anomerico, ovvero legato a 4 elementi o gruppi chimici diversi (vedi il C centrale della L e D gliceraldeide). Nel qual caso tali composti in soluzione acquosa ruotano il piano della luce polarizzata verso destra (indicati come destrogiri o +) o verso sinistra (indicati come levogiri o -) di un angolo specifico. Se nella soluzione sono presenti entrambi gli isomeri nella stessa quantità allora la deviazione della luce verso destra viene annullata dalla deviazione verso sinistra e quindi non c’è deviazione: la miscela si dice racemica. Un caso particolare è dato dalla allotropia, con una diversa disposizione dei legami nello spazio. Caso tipico la situazione diamante-grafite: nel diamante i quattro legami del carbonio (tutti di uguale energia) sono disposti secondo i vertici di un tetraedro e quindi orientati su diversi piani spaziali e con angoli di legame uguali (circa 109°), andando a costruire un “cristallo”, ovvero una struttura che può essere ripetuta (assolutamente uguale) all’infinito per successivo “attacco” di altri atomi di Carbonio, una struttura estremamente rigida e resistente (il massimo nella scala Mohs di durezza). Nella grafite invece il Carbonio ha tre legami uguali angolati a 120° che giacciono su uno stesso piano e un quarto legame, leggermente più debole, che invece si dispone perpendicolarmente al piano della molecola. Tale legame si rompe più facilmente (questo spiega la “scivolosità” della grafite, ovvero i piani scorrono gli uni sugli altri). 1 di 2 ♫ 120° c c c 90° c c c c c c c c c c diamante c c c grafite c 109,5° C La disposizione dei legami nel diamante (una simile situazione si ritrova nel quarzo) spiega anche la sua particolare caratteristica di “brillanza” ovvero quando la luce entra rimane “intrappolata” nel reticolo cristallino, le singole radiazioni vengono deviate con angoli differenti (rifrazione) ed escono scomponendo la luce iniziale nella gamma dei colori dello spettro, determinando la particolare bellezza di tali pietre. Anche una goccia d’acqua possiede la stessa proprietà (vedi arcobaleno) così come qualunque corpo trasparente (aria, vetro, ..) ma nessuno ha un “indice di rifrazione” così elevato. La grafite invece non ha nessuna di queste caratteristiche anzi, per il suo colore scuro, viene, tra l’altro, utilizzata come principale componente della mina delle matite. 2 di 2 ♫
Scaricare