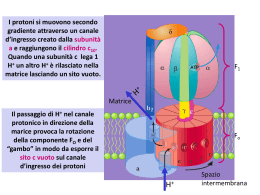
TERMODINAMICA Studio delle variazioni di energia durante una trasformazione L’energia interna di un sistema comprende tutte le forme di energia che possono essere scambiate attraverso processi fisici semplici (non nucleari) o reazioni chimiche E INTERNA = E CINETICA + E POTENZIALE Energia cinetica di traslazione Energia cinetica di rotazione Energia di legame intermolecolare Energia di legame intramolecolare Energia vibrazionale AMBIENTE TRASFORMAZIONE SISTEMA Cosa succede da un punto di vista energetico durante una trasformazione ? L’energia complessiva del sistema e dell’ambiente nel corso di una trasformazione non cambia ergo “L’energia totale dell’universo resta costante” AMBIENTE -q +q -w SISTEMA q = calore + q: l’ambiente cede calore al sistema - q: il sistema cede calore all’ambiente +w w = lavoro - w: l’ambiente compie lavoro sul sistema + w: il sistema compie lavoro sull’ambiente -w James Prescott Joule +q Equivalenza meccanica del calore Lavoro fatto Calorie fornite Energia termica q = m • c • DT massa (moli o g) variazione di temperatura capacità termica (calore specifico) quantità di calore necessaria ad innalzare di 1°C la temperatura di una massa unitaria di sostanza I° principio della termodinamica DE = Q - W La variazione di energia interna di un sistema, DE, in seguito a una trasformazione è uguale al calore assorbito dal sistema, Q, meno il lavoro compiuto dal sistema, W. E 2 E E 1 stato iniziale +q -w DE = E2 – E1 stato iniziale materia energia energia sistema aperto sistema chiuso sistema isolato Entalpia = energia a pressione costante essendo W=P•DV H = E + P•V DH = DE + P•DV DE = Q - P•DV DH = Q - P•DV + P•DV A pressione costante l’entalpia corrisponde al calore di reazione (relazione importante poiché nei sistemi biologici la maggior parte delle reazioni biochimiche avvengono a pressione costante) DH = Q SISTEMA CHIMICO REAGENTI PRODOTTI DH = HPRODOTTI - HREAGENTI Se DH < 0 la reazione è esotermica Se DH > 0 la reazione è endotermica 2HgO 2Hg + O2 N2H4 + H2O2 N2 + 4H20 H H ? N2H4 + H2O2 ? 2Hg + O2 -q ? N2 + 4H20 DH = -153.5 Kcal/mole N2 +q ? 2HgO DH = +43.4 Kcal/mole O2 LEGGE DI HESS : la variazione di entalpia che accompagna una trasformazione non dipende dal cammino percorso per passare dallo stato iniziale a quello finale H DH1 A AB DH1 BC DH2 B DH2 C AC DHTOT = DH1 + DH2 BOMBA CALORIMETRICA Reazione di combustione del glucosio C6H12O6(s) + 6O2(g) 6CO2(g) + 6H2O(l) DT O2 GLUC. CO2 +q H2O q = m • c • DT Anche la cellula è una bomba calorimetrica ma la reazione di combustione del glucosio avviene in decine di tappe. Per la legge di Hess, comunque, la variazione di entalpia è identica a quella ottenibile in un’unica reazione. Il fabisogno calorico giornaliero medio per l’uomo è circa 2500 Kcal/giorno. Questi viene coperto bruciando: Carboidrati (~ 4,5 cal/gr) Acidi grassi (~ 9,0 cal/gr) Proteine (~ 4,5 cal/gr) Volete perdere peso? Facile. Basta fare un po’ di calcoli e …….. qualche sacrificio O2 CO2 H2O FOSFORILAZIONE OSSIDATIVA MITOCONDRIALE O2 + substrati + ADP+Pi H2O + prodotti + ATP MICROCONDENSATORE H+ Fabisogno calorico a riposo/ora = 100 Kcal => 116 Watt H+ H+ membrana isolante eNADH O2 ATP ATP ATP ATP ATP 65 Kg ATP prodotto/giorno
Scaricare