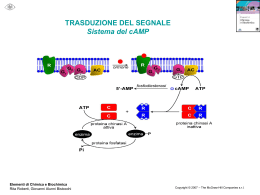
ATP SINTASI o F1-F0 ATPasi o COMPLESSO V Questo complesso si divide in due settori: Il settore Fo, oligomicina sensibile, composto da 3 tipi di subunità altamente idrofobiche, con formula di struttura a1b2c10-12; costituisce il canale protonico. Non ha attività catalitica. Inibito da DCCD (dicicloesil carbodiimide ). Le subunità c della componente F0 sono proteolipidi che formano il canale ionico: essi contengono residui di Acido glutammico o di acido aspartico che possono reagire con la DCCD. Una subunità c modificata dal DCCD non funziona più da canale protonico. F1 Lato N,matrice FO Lato P,sp.interm. Il settore F1, oligomicina insensibile, composto da 5 tipi di subunità diverse, con formula di struttura α3 β3 γ δ ε. Ha attività catalitica,sintetizza ATP. Se staccata da Fo catalizza solo l’idrolisi dell’ATP. Le subunità α3β3 formano un esamero formato da 3 dimeri αβ, che legano con diversa forza i nucleotidi. I siti catalitici si trovano sulle subunità β. F1 La subunità γ insieme alla subunità ε costituisce lo stelo centrale. Ha due domini, uno che attraversa Fo e l’altro che attraversa F1 rompendo la simmetria dell’esamero α3β3 La subunità più piccola (εε) è un inibitore dell’attività catalitica che probabilmente serve da valvola di controllo: impedisce assolutamente alla reazione di procedere quando il gradiente di H+ è basso poichè la reazione si svolgerebbe in senso inverso consumando ATP FO L’ATP sintasi rappresenta il motore molecolare più piccolo al mondo; esso opera una catalisi rotazionale. Nella sua struttura possiamo distinguere una unità mobile, il rotore, costituito dall’anello idrofobico transmembrana formato dalle subunità c e lo stelo γε e una unità immobile costituito dallo statore, cioè da tutto il resto della molecola. Il settore F1 è collegato al settore Fo dalle subunità γb2a Figura 18.27 Stryer . La subunità a del complesso Fo ha due semi canali, uno dal lato citosolico e l’altro dal lato della matrice attraverso cui passano i protoni. ATP SINTASI O COMPLESSO V • Per la continua sintesi di ATP,l’ATP sintasi deve passare da una conformazione che lega saldamente l’ ATP sintetizzato a una che lo rilascia. • Studi chimici e cristallografici sull’ATPsintasi hanno permesso di rivelare le basi strutturali di questa alternanza di funzione Figura 19.22 Nelson e Cox Pur avendo le 3β le stesse sequenze aa assumono conformazioni di volta in volta diverse, in parte a causa dell’associazione di γ che, ruotando in senso antiorario, viene in contatto con una delle 3 β ogni 120°. BOYER stabilì che i tre siti catalitici,posti sulle tre subunità β di F1, catalizzano alternativamente la sintesi di ATP. La tappa limitante è il rilascio dell’ATP. L’affinità per l’ATP viene modificata da una transizione conformazionale favorita dal passaggio di H+ attraverso F0. J.E. WALKER, sulla base di studi cristallografici, dimostrò che ogni subunità β dell’ATP sintasi può assumere 3 diverse conformazioni β ATP (T, tight), β ADP (L, light) e β vuota (O, open). Ogni flusso di 3 protoni induce una rotazione di 120° da: Nelson & Cox
Scaricare