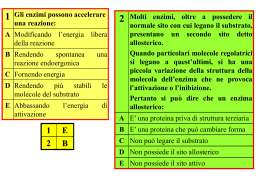
ENZIMI • • • PERCHE’ UNA CONDIZIONI o o o o o • SI DEVONO SODDISFARE TRE I SUBSTRATI DEVONO ENTRARE IN COLLISIONE LA COLLISIONE DEVE AVVENIRE CON ORIENTAMENTO CORRETTO I REAGENTI DEVONO AVERE ENERGIA SUFFICIENTE L’ENEGIA DI ATTIVAZIONE E’ L’ENERGIA NECESSARIA PERCHE’ AVVENGA UNA REAZIONE = DIFFERENZA FRA LO STATO FONDAMENTALE E L’ENERGIA DI TRANSIZIONE TANTO PIU’ L’ENERGIA DI ATTIVAZIONE E’ ALTA, TANTO PIU’ LENTA E’ LA REAZIONE FORMANO UN COMPLESSO ENZIMA-SUBSTRATO CHE RENDE PIU’ STABILE LO STATO DI TRANSIZIONE, RIDUCENDONE L’ENERGIA LE COSTANTI DI EQUILIBRIO DELLE REAZIONI CATALIZZATE NON SUBISCONO VARIAZIONI LE REAZIONI CATALIZZATE AVVENGONO IN “SITI ATTIVI” LA CUI COMPOSIZIONE CHIMICA E CONFORMAZIONE DETERMINANO LA SPECIFICITA’ DELLA REAZIONE o • AVVENGA, GLI ENZIMI SONO I CATALIZZATORI DELLE REAZIONI METABOLICHE RIDUCONO L’ENERGIA DI ATTIVAZIONE DELLE REAZIONI o • REAZIONE NEL SITO ATTIVO DELL’ENZIMA CI SONO (TEORICAMENTE) UN SITO DI LEGAME ED UN SITO CATALITICO LE REAZIONI ENZIMATICHE PROCEDONO IN DUE STADI o o FORMAZIONE RAPIDA DI UN COMPLESSO ENZIMA-SUBSTRATO IL COMPLESSO SI TRASFORMA NEL PRODOTTO DI REAZIONE CHE VIENE RILASCIATO. QUESTA FASE DETERMINA LA VELOCITA’ DI REAZIONE CINETICA ENZIMATICA • LA COSTANTE DI VELOCITA’ DESCRIVE LA REAZIONE o o o • • REAZIONI DI ORDINE ZERO: LA VELOCITA’ DI REAZIONE E’ INDIPENDENTE DALLA CONCENTRAZIONE DEL SUBSTRATO REAZIONI DI PRIMO ORDINE: LA VELOCITA’ DI REAZIONE E’ DIRETTAMENTE PROPORZIONALE ALLA CONCENTRAZIONE DEL SUBSTRATO REAZIONI DI SECONDO ORDINE: LA VELOCITA’ DI REAZIONE E’ DIRETTAMENTE PROPORZIONALE ALLA CONCENTRAZIONE DEI DUE SUBSTRATI OD AL QUADRATO DI UNO Km E’ LA CONCENTRAZIONE DI SUBSTRATO A CUI LA VELOCITA’ E’ UN MEZZO DELLA Vmax, o o INDIPENDENTE DALLA CONCENTRAZIONE DI ENZIMA SI PUO’ CALCOLARE SOLO PER REAZIONI DI PRIMO ORDINE Vmax E’ LA VELOCITA’ IN CONDIZIONI DI SATURAZIONE DI SUBSTRATO o AUMENTANDO LA CONCENTRAZIONE DI SUBSTRATO LA Vmax NON VARIA INIBIZIONE ENZIMATICA INIBIZIONE COMPETITIVA • AUMENTA LA Km • NON VARIA LA Vmax DELLA REAZIONE • UN INIBITORE COMPETITIVO SI LEGA REVERSIBILMENTE ALL’ENZIMA ED IMPEDISCE AL SUBSTRATO DI ACCEDERE AL SITO ATTIVO • PUO’ ESSERE RIMOSSA AUMENTANDO LA CONCENTRAZIONE DI SUBSTRATO INIBIZIONE NON COMPETITIVA • DIMINUISCE LA Vmax • NON VARIA LA Km • PUO’ LEGARSI SIA ALL’ENZIMA LIBERO CHE AL COMPLESSO ENZIMASUBSTRATO • NON PUO’ ESSERE RIMOSSA INIBIZIONE ACOMPETITIVA • DIMINUISCE LA Vmax • DIMINUISCE LA Km • SI LEGA AL COMPLESSO ENZIMA-SUBSTRATO • NON PUO’ ESSERE RIMOSSA INIBIZIONE PER ECCESSO DI SUBSTRATO • SI FORMA UN COMPLESSO ENZIMA-SUBSTRATO-SUBSTRATO INATTIVO O MOLTO MENO ATTIVO EFFETTORI ALLOSTERICI • REGOLANO L’ATTIVITA’ DI ENZIMI ALLOSTERICI, LEGANDOSI AD UN SITO ADIACENTE AL SITO CATALITICO ED INTERFERENDO CON QUESTO. • CI SONO EFFETTORI POSITIVI (RENDONO PIU’ ATTIVO L’ENZIMA) ED EFFETTORI NEGATIVI (INIBISCONO L’ATTIVITA’ ENZIMATICA) PROTEINE PLASMATICHE FUNZIONI • TRASPORTO: o PROTEINE CHE LEGANO MOLECOLE IDROFOBICHE: ALBUMINE ASPECIFICA LIPOPROTEINE COLESTEROLO, TRIGLICERIDI, LIPOSOLUBILI o PROTEINE CHE LEGANO IONI: CERULOPLASMINA RAME TRANSFERRINA FERRO o PROTEINE CHE LEGANO GAS: EMOGLOBINA o PROTEINE CHE LEGANO ORMONI: α1-GLICOPROTEINA CORTICOSTEROIDI α1-GLOBULINA INSULINA • COAGULAZIONE: PROTROMBINA GLOBULINA ANTIEMOFILICA FIBRINOGENO • IMMUNOLOGICA: γ-GLOBULINE • REGOLAZIONE OSMOTICA: ALBUMINA VITAMINE EMOGLOBINA • LA CURVA DI LEGAME EMOGLOBINA-OSSIGENO E’ UNA SIGMOIDE, IL TRATTO RIPIDO DELLA CURVA SI TROVA NELLA PARTE IN CUI LA PRESSIONE PARZIALE DELL’OSSIGENO E’ QUELLA DEI TESSUTI EXTRAPOLMONARI DELL’ORGANISMO o PICCOLE DIMINUZIONI DI TENSIONE DI O2 SI TRADUCONO IN NOTEVOLI AUMENTI DI RILASCIO o PICCOLE DIMINUZIONI DELLA TENSIONE DI OSSIGENO NEI POLMONI (PARTE PIATTA DELLA CURVA) NON PROVOCANO GRANDI DIFFERENZE NELL’AFFINITA’ • L’EMOGLOBINA LEGA L’OSSIGENO DEBOLMENTE A TENSIONI, FORTEMENTE QUANDO LE TENSIONI SONO ALTE BASSE • I SITI DI LEGAME SONO QUATTRO ED IL LEGAME AI QUATTRO SITI E’ DI TIPO COOPERATIVO FATTORI CHE INFLUENZANO IL LEGAME • 2,3 DIFOSFOGLICERATO: AGISCE COME EFFETTORE ALLOSTERICO I LIVELLI SONO QUASI EQUIMOLARI CON L’EMOGLOBINA, IL SUO EFFETTO FACILITA IL RILASCIO DI OSSIGENO NEI TESSUTI EXTRAPOLMONARI (DIMINUISCE L’AFFINITA’ A BASSE TENSIONI) • TEMPERATURA: A TEMPERATURE PIU’ BASSE LA CURVA SI SPOSTA VERSO SINISTRA (MAGGIORE AFFINITA’ A BASSE TENSIONI), ALTE TEMPERATURE FAVORISCONO IL RILASCIO DI O2. CIO’ CONSENTE DI FORNIRE UNA MAGGIORE OSSIGENAZIONE IN CASO DI SFORZO MUSCOLARE O IPERTERMIA. LA TEMPERATURA DELL’ARIA ATMOSFERICA NON PROVOCA INVECE GRANDI VARIAZIONI DI AFFINITA’ • pH: pH BASSI SPOSTANO LA CURVA VERSO DESTRA, CIOE’ FAVORISCONO IL RILASCIO, UN AUMENTATO METABOLISMO COMPORTA AUMENTATA PRODUZIONE DI CO2 E, QUINDI ABBASSAMENTO DI pH, IN QUESTE CONDIZIONI SARA’ FAVORITA L’OSSIGENAZIONE DEI TESSUTI TRASPORTO DEI GAS NEL SANGUE • LE SINGOLE CELLULE DELL’ORGANISMO DIRETTAMENTE CON L’ATMOSFERA NON POSSONO SCAMBIARE GAS • ESIGENZA SUPERFICIE DI SCAMBIO SPECIALIZZATA • SISTEMA CHE PORTI IN CIRCOLO I GAS QUESTO SISTEMA NON SOLO E’ NECESSARIO, MA ANCHE VANTAGGIOSO: • L’OSSIGENO E’ UN OTTIMO AGENTE OSSIDANTE, LA SUA ALTA PRESSIONE PARZIALE NELL’ATMOSFERA COMPORTEREBBE L’OSSIDAZIONE DI MOLTI COMPONENTI CELLULARI (AD ESEMPIO I GRUPPI SULFIDRILICI DI PROTEINE ENZIMATICHE) • VEICOLATO NEL SISTEMA CIRCOLATORIO, L’OSSIGENO HA UNA PRESSIONE PARZIALE MOLTO PIU’ BASSA, CHE LO RENDE MENO DANNOSO • L’ANIDRIDE CARBONICA E’ RELATIVAMENTE CONCENTRATA NELL’ORGANISMO, VIENE DILUITA NELL’ATMOSFERA • LA CONCENTRAZIONE RELATIVAMENTE ALTA NELL’ORGANISMO DELL’ANIDRIDE CARBONICA LA RENDE DISPONIBILE COME COMPONENTE DEL PRINCIPALE SISTEMA TAMPONE FISIOLOGICO • QUESTI DUE GAS VENGONO VEICOLATI DAI POLMONI AGLI ALTRI TESSUTI DAL SANGUE • UNA PARTE LIBERAMENTE SCIOLTA COME GAS, LA PARTE PIU’ IMPORTANTE LEGATA ALL’EMOGLOBINA • LA RELAZIONE RECIPROCA FRA L’AFFINITA’ DELL’EMOGLOBINA PER OSSIGENO E ANIDRIDE CARBONICA, RENDE IL SISTEMA OTTIMALE PER LO SCAMBIO A LIVELLO POLMONARE E TISSUTALE SCHEMA TRASPORTO CO2 TESSUTI CO2 REAZIONI CATABOLICHE H2O + CO2 ANIDRASI CARBONICA H2CO3 ERITROCITA HbO2 HCO3- + H+Hb + O2 HCO3NEL PLASMA AI POLMONI Cl- Cl- O2 ALLE CELLULE PER REAZIONI OSSIDAZIONE AI POLMONI CO2 ESPIRATA NELL’ARIA H2O + CO2 ANIDRASI CARBONICA H2CO3 ERITROCITA HbO2 HCO3- + H+Hb + O2 HCO3- ClCl- O2 INSPIRATO DALL’ARIA LEGGI DELLA TERMODINAMICA PRIMA LEGGE: L’ENERGIA DELL’UNIVERSO SI CONSERVA ¾ DEFINISCE L’ENTALPIA H o IN UN PROCESSO ESOTERMICO, IL CALORE SI SVILUPPA DAL SISTEMA VERSO L’AMBIENTE (ENTALPIA NEGATIVA) o IN UN PROCESSO ENDOTERMICO, IL CALORE E’ ASSORBITO DAL SISTEMA (ENTALPIA POSITIVA) SECONDA LEGGE: L’ENTROPIA DELL’UNIVERSO AUMENTA ¾ DEFINISCE L’ENTROPIA S o QUANDO L’ENTROPIA DEL SISTEMA E’ MASSIMA NON E’ POSSIBILE ALCUNA VARIAZIONE ENERGIA LIBERA G (di GIBBS) ¾ DEFINISCE LA CONDIZIONE DI EQUILIBRIO IN CUI ENTALPIA ED ENTROPIA INTERAGISCONO ∆G = ∆H - T∆S DOVE T E’ LA TEMPERATURA ¾ G NEGATIVO = PROCESSO ESOERGONICO (SPONTANEO) ¾ G POSITIVO = PROCESSO ENDOERGONICO (NON SPONTANEO) ¾ G NULLO = EQUILIBRIO QUANDO ∆H E’ NEGATIVO E T∆S E’ POSITIVO, LE VARIAZIONI DI h E s SONO NELLO STESSO SENSO E FAVORISCONO IL PROCESSO. ∆G E’ FUNZIONE DELLA COSTANTE DI EQUILIBRIO DELLA REAZIONE PROCESSI METABOLICI E ATP NEI PROCESSI METABOLICI LE VARIAZIONI ENERGETICHE SONO SPESSO ACCOPPIATE: L’ENERGIA PRODOTTA DAI PROCESSI SPONTANEI FORNISCE LA FORZA TERMODINAMICA CHE ALIMENTA I NON SPONTANEI SPONTANEO A B NON SPONTANEO C A D B C D NEL METABOLISMO IL FLUSSO DI ENERGIA SI IMPERNIA SU REAZIONI ACCOPPIATE IL CUI COMPOSTO INTERMEDIO E’ ATP LA MAGGIOR PARTE DI QUESTE REAZIONI PREVEDE IL TRASFERIMENTO DI UN GRUPPO FOSFATO DALL’ATP AD UN’ALTRA SOSTANZA, O DA UN METABOLITA AD ALTO CONTENUTO ENERGETICO ALL’ADP , CON FORMAZIONE DI ATP. ANCHE IL TRASFERIMENTO DEL GRUPPO ACILICO E’ IMPORTANTE. IL COENZIMA A (CoA) E’ UN TRASPORTATORE DI GRUPPI ACILICI ATTIVATI. L’ENERGIA LIBERA DI IDROLISI DELL’ ACETIL-CoA SI AVVICINA A QUELLA DELL’ATP. METABOLISMO ENERGETICO: ATP COMBUSTIBILI O2 CO2 Pi H2O CATABOLISMO COENZIMI RIDOTTI ADP ATP LAVORO MECCANICO Pi LAVORO DI TRASPORTO Pi LAVORO BIOSINTETICO Pi METABOLISMO ENERGETICO: FONTI E RISERVE ALIMENTI PROTEINE AMINOACIDI CARBOIDRATI GLUCOSIO LIPIDI MONOSACCARIDI GLICEROLO ACIDI GRASSI β-OSSIDAZIONE GLICOLISI ATP ATP CICLO DI KREBS ATP ATP ATP ATP PROTEINE GLICOGENO RISERVE LIPIDI CATENA RESPIRATORIA • • • • • • RICAVA ENERGIA, SOTTO FORMA DI ATP, DALLA RIOSSIDAZIONE DEI COENZIMI RIDOTTI ACCOPPIA UN SISTEMA OSSIDANTE (OSSIDAZIONE DI NADH + H+ E FADH2) AD UN SISTEMA FOSFORILANTE (ADP + Pi ATP) LA RESA E’ DEL 40%, L’ENERGIA RIMANENTE E’ UTILIZZATA PER L’OMEOSTASI TERMICA 3ATP NADH + H+ FADH2 2ATP LA FORMA ENERGETICA USATA PER LA SINTESI DI ATP E’ IL GRADIENTE PROTONICO TRANSMEMBRANA o o • • MENTRE GLI ELETTRONI PERCORRONO LA CATENA DI TRASPORTO, IN TRE SITI DEPUTATI ALLA CONSERVAZIONE DELL’ENERGIA, PROTONI VENGONO POMPATI FUORI DALLA MATRICE I PROTONI VENGONO RIPOMPATI ALL’INTERNO TRAMITE L’ATP-SINTETASI, CHE UTILIZZA L’ENERGIA DEL FLUSSO PROTONICO PER SINTETIZZARE ATP A PARTIRE DA ADP QUANDO SI E’ IN PRESENZA DI UN AGENTE DISACCOPPIANTE, LA RESA IN ATP E’ MINORE. POICHE’ L’ORGANISMO HA COMUNQUE BISOGNO DI UNA DETERMINATA QUANTITA’ DI ATP, LA CATENA DEVE ESSERE ACCELERATA, CIO’ VUOL DIRE CONSUMARE PIU’ SUBSTRATI E SPRECARE PIU’ CALORE, NE RISULTA DIMAGRIMENTO, IPERVENTILAZIONE E IPERTERMIA RICHIEDE LA PRESENZA DI o o o OSSIGENO COENZIMI RIDOTTI ADP ATP SINTETASI nH MEMBRANA ESTERNA + MEMBRANA INTERNA ADP + Pi ATP SPAZIO INTERMEMBRANA H+ MATRICE Bred Aox OSSIDOREDUTTASI CHE POMPANO PROTONI
Scaricare