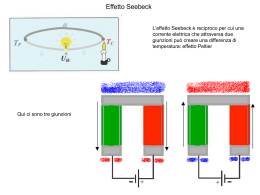
COMPOSTI DI COORDINAZIONE Gli elementi di transizione hanno proprietà che variano relativamente poco andando da sinistra a destra lungo la tavola periodica; hanno inoltre la caratteristica di avere orbitali d incompleti. Per l’accessibilità di svariati stati di ossidazione, molti elementi di transizione hanno proprietà catalitiche. I loro ioni sono spesso colorati (in particolare quelli con un numero dispari di elettroni d) perché, a causa dei numerosi livelli energetici sia pieni che vuoti, ad energie poco diverse, hanno la possibilità di assorbire ed emettere luce visibile. A causa del loro elevato campo elettrico e della presenza di orbitali d incompleti, questi ioni possono dar luogo a composti di coordinazione, o complessi. Uno ione complesso è costituito da un atomo metallico centrale, con carica positiva, che coordina attorno a sé, secondo definite geometrie, un numero definito di molecole polari o di anioni (leganti). Il numero di leganti coordinati va di solito da 2 a 6, ma può arrivare a 12. Il fenomeno della coordinazione cambia il comportamento sia del metallo che del legante. I leganti possono formare uno o più legami con l'atomo centrale e, nel secondo caso si dicono agenti chelanti (per affinità con le chele di molti crostacei). A seconda dei legami che un ligando forma con l'atomo centrale questo si chiama monodentato, bidentato o, in generale, polidentato. Esempi di chelanti sono l'EDTA (etilen-diamminotetraacetato) o l'EN (etilen-diammina). I ligandi come l'acqua o il cloro formano un solo collegamento con l'atomo centrale, e sono quindi detti essere monodentati. L'EDTA è esadentato, il che spiega la grande stabilità di molti dei suoi complessi. La nomenclatura dei complessi Il procedimento di base per denominare un complesso è il seguente: Si scrivono i nomi dei ligandi in ordine alfabetico. 1. I ligandi monodentati che appaiono più volte ricevono un prefisso greco secondo il numero di occorrenze: di-, tri-, tetra-, penta-, or esa-. I ligandi polidentati (per esempio, etilenediamina, ossalato) ricevono i prefissi bis-, tris-, tetrakis-, e così via. 2. Gli anioni finiscono in o. Per esempio: cianuro diventa ciano. 3. Ai ligandi neutri si danno i loro soliti nomi, con qualche eccezione: NH3 diventa amino; H2O diventa aquo; CO diventa carbonile. Si scrive il nome dell'atomo/ione centrale. Se il complesso è un anione, il nome dell'atomo centrale finirà in -ato, e si userà il suo nome latino se disponibile (eccetto per il mercurio). Se lo stato di ossidazione dell'atomo centrale deve essere specificato (quando è uno di vari stati possibili), lo si scrive come numero romano) tra parentesi. Esempi: [NiCl4]2- → ione tetra-cloro-nichelato (II) [CuNH3Cl5]3- → ione amino-penta-cloro-cuprato (II) Geometria di coordinazione Dal numero di coordinazione dipende la geometria del complesso NC 2 Lineare NC 4 Tetraedrica o quadrata planare NC 5 bipiramide trigonale NC 6 ottaedrica Mettendo in soluzione insieme ioni Fe2+ e ioni CN-, si dovrebbe osservare precipitazione dell’idrossido di ferro. In realtà la reazione che avviene è esclusivamente la formazione dello ione complesso esacianoferrato (II): Fe2+ + 6 CN- = [Fe(CN)6] 4La K di equilibrio per la reazione di decomposizione di questo complesso, ossia la K della reazione [Fe(CN)6] 4- = Fe2+ + 6 CNKinst= [CN-]6 [Fe2+]/[Fe(CN)6]4È detta costante di instabilità, Kinst, e nel caso dell’esacianoferrato (II) vale 10-35. la costante della reazione inversa è detta costante di formazione. Ioni complessi di rame Chelati EDTA acido etilendiammino tetracetico Complesso metallico con EDTA Struttura della clorofilla a Struttura della vitamina B12 Struttura dell’eme dell’emoglobina La ruota dei colori
Scaricare