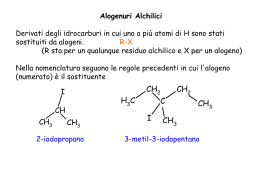
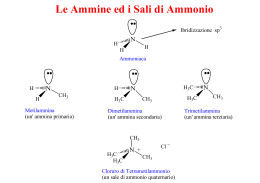
ACCERTAMENTO DI CHIMICA ORGANICA PER I CORSI DI LAUREA IN FARMACIA E DI INFORMAZIONE SCIENTIFICA DEL FARMACO (I Semestre) Bari, 15 novembre 2004 Traccia A 1) Vengono qui sotto riportate varie coppie di strutture di risonanza contribuenti. Individuate, per ciascuna coppia, la struttura più contribuente e spiegate perché. (a) H3C H H3C C O H H C O (b) H H O C O C H H (c) H C O H H C O 2) (a) “Anche se una molecola contiene uno stereocentro tetraedrico non vuol dire che essa debba essere necessariamente chirale” (1) Fornite un esempio che sia di supporto a tale punto di vista. (2) Può una molecola che possiede un piano di simmetria avere uno stereocentro tetraedrico situato su quel piano? Fornite un esempio che sia di supporto alla vostra risposta. (b) Un fiocco di neve ha un asse C6. Quante volte l’orientazione del fiocco di neve diventa indistinguibile dall’orientazione iniziale durante una rotazione completa intorno a tale asse? Di quanti gradi è la rotazione che porta ad una orientazione indistinguibile? 3) La clorurazione radicalica del bromocicloesano porta ad un certo numero di prodotti monoclorurati. (a) Disegnate (utilizzando i cunei o la “convenzione del punto”) tutti gli stereoisomeri (trascurando le conformazioni) prodotti in questa reazione. (b) Quali sono simmetrici, cioè hanno un centro o un piano di simmetria? (c) Quali dovrebbero avere punti di ebollizione differenti? 4) L’1,2-dibromo-1,2-difeniletano è presente sotto forma di due diastereoisomeri; descriveteli utilizzando delle proiezioni di Fischer. Questi vengono sottoposti singolarmente ad una reazione di eliminazione con sodio etossido in etanolo che decorre con un meccanismo E2. Scrivete quali sono i prodotti formatisi in ciascuna reazione e la loro stereochimica relativa. Assumete che soltanto un equivalente di HBr venga eliminato in ciascun caso. 5) (a) La reazione del 3,3-dimetil-1-butino con HCl produce una piccola quantità di 3-cloro2,3-dimetil-1-butene. Spiegate la formazione di tale prodotto. (b) Prevedete i prodotti delle seguenti reazioni: O H H 2O (1) H H CH 2CH3 H (cat.) (2) H O H H CH2CH3 1. OH 2. H 6) Proponete una sintesi del seguente prodotto a partire dal reagente indicato: OH H C C H H3C H H OH CH 3 1 Traccia B 1) La reazione riportata sotto può essere descritta in termini di reazione acido-base. Identificate l’acido e la base di Lewis. Identificare, inoltre, lo stato di ibridazione di ciascun carbonio nella sequenza di reazione. CH3 + H 2C CH2 H3C CH 2 CH 2 2) (a) Il 2,3-pentadiene è chirale ma non asimmetrico. Perché? Giustificate la vostra risposta. (b) Supponiamo di essere stati i primi a isolare un composto nuovo, otticamente attivo, la cui rotazione specifica è +101°. Il composto isolato è l’isomero R oppure S? Giustificate la vostra risposta. 3) Gli inositoli sono prodotti naturali che si trovano in molti organismi viventi. (a) Usando la “convenzione del punto” o i cunei, scrivete tutti gli inositoli possibili di cui è data la formula generale qui sotto. (b) Quali sono quelli che non possono avere attività ottica? H OH HO H H OH HO OH H H HO H 4) (a) Quali prodotti si formano e con che meccanismo (sostituzione o eliminazione) nelle seguenti reazioni? (1) Metil ioduro e sodio cianuro in etanolo; (2) 2-bromo-3-metilbutano in etanolo a caldo; (b) Quali prodotti si ottengono quando il 2-cloro-2-metilpentano va incontro ad eliminazione E1? Indicare i nomi, la stereochimica e le quantità relative. 5) (a) Quando il trans-2-metilcicloesanolo (A) è sottoposto ad una disidratazione acido catalizzata, il principale prodotto è l’1-metilcicloesene. Al contrario, quando il trans-1bromo-2-metilcicloesano (B) è sottoposto a deidroalogenazione, il principale prodotto risulta essere il 3-metilcicloesene. Giustificate queste osservazioni. CH3 CH3 OH CH3 HA calore A CH3 Br B EtO EtOH calore (b) In presenza di una soluzione acquosa di un acido diluito, l’1-metossicicloesene (un membro di quella classe di composti chiamati eteri vinilici) è trasformato in cicloesanone. Suggerite un meccanismo per questa trasformazione. 6) (a) Proponete una sintesi dell’esanale a partire dall’1-esene. (b) Che prodotto si ottiene trattando l’ (R)-3-metil-1-pentene prima con magnesio perftalato e poi con H3O+/H2O? 2 Traccia C 1) Il radicale metilico, CH3•, ha un carbonio senza un ottetto esterno di elettroni, ma non è un acido di Lewis. Date una spiegazione. Qual è lo stato di ibridazione del carbonio in questo radicale “quasi planare”? Qual è la carica formale su questo carbonio? 2) (a) Esistono 6 isomeri per il dimetilciclobutano. Scrivete i nomi e le loro strutture ed identificate quelle chirali. (b) Che cosa si intende per eccesso enantiomerico? 3) Il micaminosio è strutturalmente connesso all’antibiotico Magnamycin. Sulla base della rappresentazione riportata sotto, disegnate la sua conformazione preferita. Assegnate una configurazione assoluta a ciascun stereocentro. OH (H3 C)2N OH O HO CH3 4) (a) Quali prodotti si ottengono quando il 3-iodo-2-metileptano e l’1-cloro-1metilcicloesano vanno incontro ad eliminazione E1? Indicare i nomi, la stereochimica e le quantità relative. (b) Quale reazione SN2 vi aspettereste per ciascuna coppia (1) o (2)? Quale tra le due reazioni potrebbe avvenire più velocemente in un solvente protico? ( 1) CH3CH 2CH2Cl + CH3CH 2O oppure (2) H 3CH2CH2Cl + CH 3CH2OH 5) (a) Suggerite un meccanismo per la seguente trasformazione: CH3 OH CH3 H2SO4 CH3 calore H 3C H 3C CH3 (b) Trovate il reagente mancante e suggerite una sua preparazione: ? Cl CH 2CH3 6) Proponete una sintesi del 5-nonanolo utilizzando unicamente come materiale di partenza l’1-pentene ed ogni reagente necessario: ? OH 3 Traccia D 1) (a) Sistemare i seguenti composti in ordine di decrescente acidità. Quali sono le corrispondenti basi coniugate? CH3CH2NH2 , CH3 CH2OH, CH3OCH3 ,H 3CHC CH2 , H3CC CH ,CH 3CH2OH2 (b) Sistemare i seguenti composti in ordine di crescente basicità: CH 3NH , CH3O , H3CC C , CH3CH2 , H 3CHC CH 2) (a) Delineate uno schema per risolvere i due enantiomeri del (±)-2-amminobutano. Usate ogni reagente necessario. (b) Le seguenti strutture sono coppie di enantiomeri o sono strutture identiche? (a) HO H3C H CH2CH3 H H3C Cl CH2CH3 OH (b) H CH3 CH2 CH3 H H3CH2 C Cl CH3 3) La bromurazione radicalica di A, otticamente attivo, produce vari dibromuri, alcuni dei quali sono otticamente inattivi. Disegnati tutti i possibili prodotti di bromurazione indicando quelli otticamente attivi. Nelle molecole dissimmetriche assegnate anche la configurazione assoluta agli stereocentri. Br A H 4) (a) Dovendo trasformare il terz-butil cloruro in 2-metilpropene, quali condizioni sperimentali scegliereste per favorire l’eliminazione? Se invece voleste trasformare il terzbutil cloruro in terz-butil metil etere, quali condizioni scegliereste al fine di avere la resa più alta in etere? (b) Disegnare il profilo energetico relativo alla reazione di eliminazione E2 cui va incontro il 2-bromo-2,3-dimetilbutano quando trattato con sodio terz-butossido; indicate anche la natura del prodotto finale. Come si può preparare questo alcolato? 5) (a) Le aloidrine possono essere sintetizzate per trattamento di epossidi con HX. (1) Come sintetizzereste il 2-clorociclopentanolo a partire dal ciclopentene? (2) Che stereochimica vi aspettereste per questo prodotto? cis- o trans? 4 (b) La seguente reazione si è rivelata un metodo di preparazione insoddisfacente di A, perchè il prodotto principale è risultato essere B. Proponete un plausibile meccanismo per la formazione di B. OH CH2 H3C OH CH3 H 3C HBr A Br (in assenza di luce) H3C B O CH3 6) Assegnate le strutture per A-E: EtO /EtOH Br B (C6H13)3B H2O2, OH BH3:THF A (C6H12) (prodotto maggioritario) C (C6H14O) PCC CH2Cl2 D 1. MeLi E 2. H3O 5 Traccia E 1) L’acido mostrato sotto è noto come acido squarico ed è un acido diprotico (pKa1 = 0.5, pKa2 = 3.5). Studi strutturali indicano che la specie dianionica, ottenuta per perdita di entrambi i protoni, è altamente simmetrica con lunghezze di legame C-C uguali, come pure uguali lunghezze di legame C-O. Date una spiegazione plausibile in termini di risonanza. O OH O OH 2) (a) Scrivete tutti i possibili stereoisomeri dell’1,3,4-triidrossiciclopentano. (b) Assegnate la configurazione assoluta (R o S) ai carboni 3 e 4 in ciascun stereoisomero. (c) Indicate quale stereoisomero è chirale. (d) Indicate se il carbonio 1 può essere considerato uno stereocentro in ciascun stereoisomero. 3) Quale termine delle seguenti coppie di composti vi aspettereste abbia il più grande calore di combustione? (a) cis- o trans-1,2-dimetilcicloesano?, (b) cis o trans-1,3dimetilcicloesano?, (c) cis o trans-1,4-dimetilcicloesano? Giustificate le vostre risposte. Ciascun termine delle precedenti coppie può essere considerata una molecola chirale? 4) (a) Dalla reazione di eliminazione E1 del 3-bromo-2,3-dimetilpentano si formano 3 alcheni. Indicare i loro nomi e le loro percentuali relative. Quali di questi presentano isomeria geometrica? Giustificate la vostra risposta. (b) Scrivete il prodotto della seguente reazione indicando la sua stereochimica: H3C CH3OH + HS H3CH 2C C Br 50 °C H 5) (a) Proponete un meccanismo per la seguente trasformazione: CH3 Ph C CH3 C H CH 2 TsOH cat. Ph CH3 H3C CH3 (b) Quali sono i reagenti necessari per realizzare le seguenti trasformazioni? H3C OH H3C OH ? ? H3C SCH 2CH3 H3C SCH 2CH3 6 6) Assegnate le strutture per A-E: Metilciclobutano Br2 h! A (C5H9Br) C (C5 H10O) TsCl EtONa B (C5H 8) EtOH, 55 °C D (C 12H16 SO3) OH 1. BH3:THF 2. H2O2, OH E (C5H10 O) OH Che relazione di stereoisomeria esiste tra C e E ? 7
Scaricare