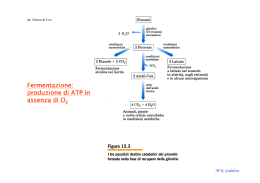
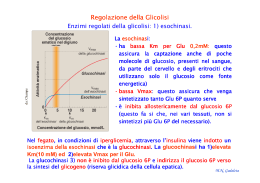
Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA N. 18 ENZIMI VI: Regolazione enzimatica REGOLAZIONE ENZIMATICA Come viene regolato il flusso di molecole che si trasformano in altre molecole all’interno di una cellula vivente, data la straordinaria complessità delle interrelazioni metaboliche ? da: Berg J.M. et al. (V ed.) M.N. Gadaleta E. coli costruisce tutte le molecole ad esso necessarie: proteine, lipidi, acidi nucleici, a partire da: glucosio, NH3, H2O e sali minerali attraverso una intricata rete metabolica. Nella rete metabolica ci sono punti in cui una molecola può essere substrato di più enzimi. Per es. nell’uomo il glucosio presente negli alimenti può essere convertito in: glicogeno GLUCOSIO lipidi amminoacidi non essenziali CO2 e H2O attraverso 4 diverse vie metaboliche. Ogni via metabolica è caratterizzata da numerose reazioni; ogni reazione è catalizzata da un enzima specifico. Non tutte le vie metaboliche procedono al massimo della loro attività in ogni momento. Per es., dopo un pranzo, nell’organismo c’è notevole disponibilità di glucosio: non tutte le molecole vengono trasformate in ugual misura nei prodotti terminali delle vie metaboliche suddette; al contrario, esistono meccanismi omeostatici controllati molto accuratamente dall’organismo che M.N. Gadaleta fanno sì che: a) il tasso ematico di glucosio sia sempre costante; b) una quota appropriata di questo zucchero venga utilizzata a scopi energetici; c) esistano sempre riserve di glicogeno; d) la quantità di glucosio eventualmente residua venga trasformata in lipidi di riserva. D’altra parte, quando l’ambiente esterno fornisce prodotti già fatti per la cellula è altamente dispendioso sintetizzare quei prodotti e quindi lasciare attive quelle vie metaboliche; sorge la necessità di disattivarle. M.N. Gadaleta La velocità di una via metabolica dipende dalla concentrazione dei suoi enzimi sintetizzati in quantità costanti (Enzimi costitutivi) e dalla presenza di enzimi regolatori. Il livello intracellulare degli enzimi regolatori delle vie metaboliche è generalmente molto basso. Spesso gli enzimi regolatori di vie metaboliche presentano un tempo di semivita molto breve. Per es. carbossicinasi 5h: questo permette di avere fluttuazioni della velocità di una via metabolica molto maggiori di quella ottenuta attraverso l’attivazione o inibizione di enzimi sintetizzati in quantità costanti (Enzimi costitutivi). M.N. Gadaleta – La velocità con cui una via metabolica decorre può essere regolata anche per mezzo dell’attivazione o inattivazione ormono-dipendente dell’espressione genica di nuovi enzimi, con conseguente aumento o diminuizione della velocità della loro biosintesi. Enzimi inducibili – Enzimi repressibili. Il controllo di una via metabolica si attua attraverso : a) il controllo della disponibilità dei suoi enzimi b) la modulazione dell’attività dei suoi enzimi a)La cellula può regolare la quantità assoluta di enzima presente in un determinato momento stimolando : la sua biosintesi ( la regolazione a livello dell’espressione genica prevede un processo complesso: è una regolazione di tipo lento , richiede minuti) e/o la sua degradazione o attraverso l’attivazione di zimogeni (vedi chimotripsina). M.N. Gadaleta da: Champe Gli enzimi inducibili sono quelli i cui geni sono espressi soltanto in un determinato stadio dello sviluppo o in particolari condizioni fisiologiche. Per es. in seguito a un aumento della glicemia, si ha un aumento dell’insulina che induce nel fegato la espressione della glucocinasi, un enzima che indirizza il glucosio nella sua forma di deposito, che è il glicogeno, riportando la glicemia alla normalità. La glucochinasi è un isoenzima della esochinasi presente solo nel fegato le cui cinetiche rispondono alla fosforilazione del glucosio in condizioni di elevata glicemia. M.N. Gadaleta da: Baynes M.N. Gadaleta da: Baynes M.N. Gadaleta b) La cellula può modulare l’attività degli Enzimi attraverso specifici ligandi . Gli enzimi la cui attività oltre che essere regolata da pH, [S], [cofattori, Mg+2, K+] e [coenzimi], è modulata da specifici ligandi sono detti enzimi regolatori o regolati. L’attività catalitica di un enzima è modulata grazie 1) alla flessibilità conformazionale delle proteine (per esempio stato T stato R) , 2) alla loro dinamicità in risposta a ligandi o effettori (regolazione allosterica) e 3)alla loro capacità intrinseca di trasmettere modificazioni conformazionali tra siti spazialmente distanti all’interno della molecola (effetto cooperativo). M.N. Gadaleta Gli enzimi regolatori subiscono una: regolazione allosterica regolazione covalente regolazione attraverso proteine controllo M.N. Gadaleta La regolazione allosterica prevede cambiamenti conformazionali della molecola proteica, in seguito a interazioni di ligandi in siti diversi dal sito attivo,che coinvolgono solo formazione e rottura di legami deboli: la transizione di conformazione che modula l’attività dell’enzima è veloce,richiede pochi secondi. La regolazione covalente prevede cambiamenti conformazionali in seguito a formazione e rottura di legami covalenti: coinvolge almeno due enzimi, lenta,richiede minuti. La regolazione mediante proteine controllo: quando ad attivare o disattivare un enzima sono non piccole molecole, ma proteine (vedi calmodulina, rapida, secondi). M.N. Gadaleta 1. REGOLAZIONE ALLOSTERICA L’attività degli enzimi allosterici è regolata dal legame reversibile di uno specifico ligando detto effettore allosterico. Il ligando viene riconosciuto da uno specifico sito allosterico sull’enzima diverso dal sito attivo. Un enzima può avere diversi siti allosterici ed essere regolato da più effettori allosterici. L’effettore allosterico non è un interruttore che “accende” o “spegne”, cioè “attiva” o “disattiva” un enzima allosterico, ma, piuttosto, un dispositivo di regolazione della “luminosità” (cioè dell’intensità dell’attività di una enzima): è meglio detto modulatore. M.N. Gadaleta Nella maggior parte dei casi gli enzimi allosterici sono enzimi polimerici che mostrano anche l’effetto cooperativo. Allosterismo: cambiamento conformazionale che si verifica in un protomero, in risposta ad una interazione ligando-sito allosterico. Cooperatività: implica un cambiamento conformazionale di un protomero, indotto dall’interazione con un effettore che, a sua volta, induce un protomero adiacente ad assumere una nuova conformazione con una diversa affinità per il ligando effettore o per un secondo ligando. M.N. Gadaleta Allosterismo cambiamenti nella struttura terziaria Cooperatività cambiamenti nella struttura quaternaria Proteine allosteriche: proteine che subiscono una regolazione di tipo allosterico e/o che mostrano il fenomeno della cooperatività: quasi sempre i due fenomeni sono connessi anche perché quasi tutte le proteine allosteriche sono polimeriche. Può esistere un effetto allosterico in assenza di cooperatività: per es. nella alcooldeidrogenasi (ADH): in questo enzima i cambiamenti conformazionali indotti in un protomero non si trasmettono ai protomeri adiacenti. E’, tuttavia, molto raro. Effettori/modulatori allosterici : positivi = attivatori negativi = inibitori M.N. Gadaleta Il cambiamento conformazionale di un enzima può essere indotto oltre che da un effettore allosterico dalle molecole di S. In questo caso, come nel caso di Hb, il sito di legame per O2 presente in ciascun protomero, corrisponde al sito di legame per S in un enzima allosterico. I cambiamenti conformazionali indotti su ciascun protomero dal legame del S (o di O2 nel caso di Hb) sono meglio definiti interazioni cooperative omotropiche. M.N. Gadaleta Effettori/modulatori omotropi ed eterotropi L’influenza esercitata da molecole di S, attivatori o inibitori sul legame di altre molecole di S, attivatori o inibitori prende il nome di interazione omotropa, interazione quasi sempre positiva. L’influenza esercitata da un ligando sul legame di ligandi diversi, per es. da un inibitore allosterico sul legame di S o da un inibitore allosterico sul legame di un attivatore allosterico, prende il nome di interazione eterotropa e può essere tanto positiva che negativa. M.N. Gadaleta da: Baynes M.N. Gadaleta Gli enzimi allosterici non seguono la cinetica di MM Il comportamento cinetico sigmoide riflette la presenza di interazioni cooperative tra le diverse subunità dell’enzima. Il substrato S può comportarsi da modulatore omotropo positivo in quanto le subunità dell’enzima agiscono in modo cooperativo. (K0,5) da: Nelson & Cox M.N. Gadaleta EFFETTO COOPERATIVO E’ stato dimostrato in proteine di trasporto (Hb) proteine enzimatiche e in molte altre proteine oligomeriche. FUNZIONE:conferire alla proteina una regolabilità per meglio rispondere alle esigenze fisiologiche dell’organismo. Esistono variazioni fisiologiche della concentrazione di S:secondo l’equazione di Michaelis e Menten quando c’è poco S l’attività dell’enzima è bassa, quando S aumenta, l’attività dell’enzima aumenta. M.N. Gadaleta Ma le variazioni di concentrazione dei S possono essere: 1 tali da regolare la V0 dell’enzima in risposta alle esigenze metaboliche cellulari secondo la cinetica di Michaelis e Menten (curva iperbolica). Effetto cooperativo non necessario 2 molto piccole; insufficienti a regolare la V0 secondo la cinetica di Michaelis e Menten: necessità di un effetto omotropo cooperativo positivo che amplifichi la risposta dell’enzima alle variazioni di concentrazioni di S 3 troppo grandi per regolare la V0 secondo la cinetica di Michaelis e Menten: necessità di un effetto omotropo cooperativo negativo per ammortizzare le variazioni di concentrazione di S. La sigmoidicità della curva può variare da enzima ad enzima e, quindi, varia la regolabilità. Esistono effetti cooperativi misti (prima positivi, poi negativi) che permettono una maggiore regolabilità a bassa [S] e una minore regolabilità ad alta [S]. M.N. Gadaleta 1 80 1 9 1 7000 A) curva iperbolica di Michaelis e Menten. Una variazione di [S] di circa 80 volte fa variare la Vo dal 10% al 90% del valore della Vmax . B) curva sigmoide con moderato EFFETTO COOPERATIVO POSITIVO. Una variazione di [S] di circa 9 volte fa variare laVo dal 10% al 90%dellaVmax . Le curve sigmoidi sono a volte così ripide che un aumento veramente piccolo di [S] provoca una accelerazione della velocità di catalisi molto maggiore che in un enzima semplice. C) curva iperbole simile dell’EFFETTO COOPERATIVO NEGATIVO. Per un aumento di velocità dal 10% al 90% occorrerebbe un aumento di [S] di 60007000 volte (es. Gliceraldeide 3P DH). M.N. Gadaleta CINETICA DELLE PROTEINE ALLOSTERICHE In conseguenza dell’interazione tra sito di legame per S, sito di legame per A (modulatore positivo) e/o sito di legame per I (modulatore negativo) il diagramma della velocità iniziale di reazione (v0) in funzione di [S] è rappresentato da una curva sigmoide. Lo stesso dicasi per gli enzimi e per gli effetti di S,A e I da: Nelson & Cox M.N. Gadaleta ASPARTATO TRANSCARBAMILASI (ATCasi): un enzima allosterico regolato da S con effetto omotropo cooperativo positivo e da modulatori eterotropi positivi e negativi,ATP e CTP. da: Berg J.M. et al. (V Ed.) (necessarie per la biosintesi degli acidi nucleici) M.N. Gadaleta da: Nelson & Cox (IV Ed.) M.N. Gadaleta M.N. Gadaleta da: Berg J.M. et al. (V Ed.) Effetto omotropo cooperativo negativo La cinetica di alcuni enzimi allosterici, sebbene simile ad una iperbole equilatera, non può essere descritta dall’equazione di Michaelis e Menten (risulta più appiattita e sale molto lentamente, non è una iperbole equilatera). Il fatto che la curva di saturazione cresce così lentamente si spiega col fatto che il legame di una molecola di S rende più difficile il legame delle successive molecole di S. Esempio: Gliceraldeide 3fosfato deidrogenasi: 4 siti per NAD+ Gliceraldeide 3fosfato deidrogenasi = enzima regolato da NAD+ (che può essere considerato un substrato dell’enzima) con effetto omotropo cooperativo negativo Effetto omotropo cooperativo negativo: il legame della prima molecola di NAD+ diminuisce l’affinità delle altre subunità per NAD+. M.N. Gadaleta INIBIZIONE DA PRODOTTO TERMINALE O RETROREGOLAZIONE O REGOLAZIONE A FEEDBACK Un chiaro esempio di come operi un meccanismo di regolazione è rappresentato dalla inibizione a feedback della biosintesi della L-isoleucina nei batteri: questo processo si realizza in 5 stadi, ciascuno dei quali è legato ad una reazione enzimatica. Il prodotto finale (L-isoleucina) inibisce il primo enzima in modo tale che, quando la concentrazione dell’aminoacido L-isoleucina comincia a diventare significativa, il processo di sintesi si interrompa. M.N. Gadaleta Regolazione retroattiva nella via di biosintesi della Lisoleucina.L’inibizione a feedback può essere di tipo competitivo o allosterico e, in ogni caso, porta ad un aumento della Km dell’enzima che può superare quello della [S] in vivo, portando ad una diminuzione o all’azzeramento della velocità della reazione catalizzata. M.N. Gadaleta 2. REGOLAZIONE COVALENTE(1) Nella regolazione covalente, modificazioni covalenti (rottura o formazione di nuovi legami) catalizzate da E convertono l’una nell’altra la forma attiva e inattiva degli E regolati. E’ una regolazione più lenta di quella allosterica (richiede alcuni minuti). Esistono diversi tipi di modificazione che hanno luogo a carico di amminoacidi specifici (vedi figura). M.N. Gadaleta Acetilazione Lys M.N. Gadaleta da: Berg J.M. et al. (V Ed.) M.N. Gadaleta REGOLAZIONE COVALENTE(2) La maggior parte delle modificazioni covalenti sono reversibili per cui per ognuna di esse sono richiesti due E: una chinasi e una fosfatasi per la fosforilazione, una acetiltransferasi e una acetilasi per la acetilazione, ecc. PROTEIN CHINASI (PK) = enzimi che fosforilano altre proteine utilizzando ATP (o altri nucleosidi trifosfati) come substrato. Quaranta dei 280 residui della PKA formano un nucleo catalitico conservato, comune a quasi tutte le proteine chinasi conosciute. da: Champe Le PK costituiscono una delle più grandi famiglie di proteine: se ne conoscono più di 550 nella specie umana. Questa molteplicità di E permette di ottimizzare la regolazione secondo lo specifico tessuto, momento o substrato. M.N. Gadaleta Serinchinasi, treoninchinasi, tirosinchinasi La fosforilazione è un mezzo molto efficiente per regolare l’attività delle proteine bersaglio da: Berg J.M. et al. (V Ed.) M.N. Gadaleta La fosforilazione è un mezzo molto efficiente per regolare l’attività delle proteine bersaglio da: Berg J.M. et al. (V Ed.) M.N. Gadaleta 3.Regolazione mediante proteine controllo Esistono importanti enzimi oligomerici in cui è presente un particolare protomero con attività regolatrice; queste subunità non hanno di per sé attività catalitica, ma, la loro associazione con i protomeri con funzione catalitica, permette la modulazione dell’attività catalitica del complesso attraverso cambiamenti conformazionali indotti. Es. proteinchinasi A, calmodulina da: Berg J.M. et al. (V ed.) (PKA) M.N. Gadaleta La calmodulina funge da subunità regolatrice di molte proteine complesse, per es. della glicogeno fosforilasi chinasi o glicogeno sintasi chinasi 2 e della PK Ca+2-calmodulina dipendente La calmodulina è a sua volta modulata dal calcio (considerato un terzo messaggero nel trasferimento dell’informazione metabolica) da: Champe M.N. Gadaleta Gli enzimi regolatori sono a loro volta regolati. Per es. le proteine chinasi regolano l’attività di molti enzimi attraverso la fosforilazione, ma che cosa induce l’attivazione delle PK? Il cAMP è uno degli attivatori delle proteinchinasi (PK-cAMP dipendenti)di cui modifica la struttura quaternaria. L’attivazione di una via metabolica è spesso un processo a più tappe iniziato da molecole segnale che collegano l’ambiente extracellulare con l’ambiente cellulare per es. gli ormoni. In generale gli ormoni proteici (insulina, glucagone) e ormoni come l’adrenalina non entrano nelle cellule ma hanno recettori (molecole proteiche che le riconoscono) sulle membrane delle cellule bersaglio. Si comportano da ligandi del recettore. M.N. Gadaleta da: Berg J.M. et al. (V Ed.) M.N. Gadaleta da: Champe Molti recettori segnalano il riconoscimento di uno specifico ligando (ormone o “primo messaggero”) innescando una serie di reazioni che hanno come risultato finale una altrettanto specifica risposta intracellulare. M.N. Gadaleta I “secondi messaggeri”, es. cAMP, sono la prima espressione di una cascata di eventi che trasduce il legame dell’ormone in una risposta cellulare. Il sistema dell’adenilato ciclasi è particolarmente importante nella regolazione delle vie del metabolismo intermedio. Il cAMP è considerato un antico segnale di “fame”: nei batteri avvia l’espressione di geni che portano all’attivazione delle vie cataboliche. Proteine G: trasducono il messaggio del recettore legato all’ormone in attivazione dell’adenilato ciclasi. da: Champe M.N. Gadaleta • La concentrazione del cAMP è regolata dall’adenilato ciclasi e dalla fosfodiesterasi ciclica. • Quest’ultima è attivata dal Ca+2 e inibita da caffeina e teofillina. Adenilato ciclasi Fosfodiesterasi ciclica Regolazione mediante attivazione di zimogeni da: Berg J.M. et al. (V ed.) : Attivazione Irreversibile:è un partic0lare tipo di regolazione covalente Alcuni Il processo è detto anche di maturazione: infatti la scissione proteolitica favorisce l’acquisizione della struttura tridimensionale funzionalmente attiva dell’enzima, in quanto concorre alla formazione del sito attivo. M.N. Gadaleta L’attivazione degli zimogeni pancreatici ha luogo nell’intestino, cioè laddove essi devono funzionare. Una maturazione precoce porterebbe all’autodigestione del pancreas con esiti letali. da: Stryer M.N. Gadaleta M.N. Gadaleta M.N. Gadaleta REGOLAZIONE mediante COMPARTIMENTAZIONE DELLE VIE METABOLICHE COMPARTIMENTAZIONE DELLE VIE METABOLICHE Un altro meccanismo che ha la cellula per regolare il proprio metabolismo è la compartimentazione delle vie metaboliche. In genere, le vie anaboliche e quelle cataboliche sono localizzate in organelli o compartimenti cellulari diversi per agevolare il loro controllo ed evitare che siano attivate contemporaneamente; infatti, non avrebbe senso per la cellula che, ad es., l’ossidazione degli acidi grassi avvenisse contemporaneamente alla loro biosintesi e nello stesso compartimento cellulare: se ciò si verificasse ci troveremmo di fronte ad un ciclo futile. M.N. Gadaleta Invece, la separazione (compartimentazione) della biosintesi degli acidi grassi (citoplasma) dalla loro ossidazione (mitocondrio) permette di controllare i due processi per mezzo della regolazione del trasporto di intermedi comuni ad entrambi attraverso la membrana dei mitocondri: per es. gli acil-CoA (derivati degli acidi grassi legati al CoA) non diffondono attraverso la membrana mitocondriale, che possono attraversare solo grazie all’esistenza di uno specifico sistema di trasporto: il sistema navetta della carnitina (vedi fig. 16.16). Così, se la situazione metabolica richiede la biosintesi, piuttosto che l’ossidazione degli acidi grassi, la cellula può controllare, attraverso segnali ormonali o di altro tipo, il sistema di trasporto degli acidi grassi in modo da adattarlo alle esigenze cellulari. M.N. Gadaleta da: Champe Il malonilCoA (primo prodotto della biosintesi degli acidi grassi) blocca la carnitinapalmitoiltransferasi I (CPT I) impedendo l’ingresso degli acilCoA nei mitocondri e quindi la loro degradazione. M.N. Gadaleta • REGOLAZIONE della sintesi e della demolizione del glicogeno : 1) Regolazione allosterica della glicogeno sintasi e della glicogeno fosforilasi . 2) Regolazione ormonale (glucagone, adrenalina, insulina) che si attua attraverso una regolazione covalente da parte della PKA Regolazione allosterica della glicogeno sintasi e della glicogeno fosforilasi . Fegato:sensore della glicemia: un alto livello di glucosio nel sangue inibisce la demolizione del glicogeno Muscolo:l’attività fisica (aumento di Ca+2 e di AMP) favorisce la demolizione del glicogeno La contemporanea attivazione della glicogeno fosforilasi e inattivazione della glicogeno sintasi evita un ciclo futile da: Champe M.N. Gadaleta da: Champe attraverso la via cAMP-dipendente. M.N. Gadaleta Il cAMP attiva le proteinchinasi c-AMP dipendenti. La concentrazione della proteina fosforilata è regolata dall’azione della protein-chinasi cAMP dipendente (PKA) e della PKA fosfatasi. da: Champe M.N. Gadaleta Gli enzimi regolatori modulati covalentemente possono amplificare notevolmente un segnale chimico mediante un effetto di AMPLIFICAZIONE A CASCATA. L’amplificazione a cascata è dovuta al fatto che: ogni molecola di enzima agisce, in un dato tempo, su migliaia di molecole di S; quando però S è un altro enzima una serie di 3-4 passaggi possono portare a una enorme amplificazione del segnale iniziale. La fosforilasichinasi e la glicogenofosforilasi sono coinvolte in un’amplificazione a cascata in due passaggi: essi fanno parte di una cascata che comprende altre due tappe e che amplifica il segnale dell’adrenalina. M.N. Gadaleta L’amplificazione del segnale iniziale è pari al prodotto del numero di turnover dei diversi E coinvolti nella cascata metabolica. M.N. Gadaleta ISOENZIMI Altro tipo di regolazione del metabolismo (riguarda l’espressione genica). Isozimi o isoenzimi = forme multiple di un E che si trovano in un singolo organismo (es. in organi diversi) o anche in una singola cellula (es. in organuli diversi). • Catalizzano la stessa reazione • Hanno proprietà cinetiche diverse • Rispondono diversamente ai modulatori allosterici • Hanno diversa composizione in AA (sono il prodotto di geni diversi) • Se il pI è diverso sono separabili elettroforeticamente M.N. Gadaleta Gli isoenzimi hanno proprietà e caratteristiche cinetiche diverse. Esochinasi,costitutiva ,ubiquitaria Km per il Glu:0,05mM Glucochinasi o EsochinasiD,indotta, solo nel fegato, da iperglicemia, Km per il Glu:10mM La distribuzione delle diverse forme isoenzimatiche risponde a)a esigenze di controllo fine delle velocità metaboliche mediate dalle risposte diverse di isozimi a modulatori allosterici diversi, nello stesso tessuto: es. l’esochinasi D o glucochinasi del fegato non è inibito dal Glu-6P come la esochinasi del fegato e degli altri tessuti. M.N. Gadaleta b)a esigenze metaboliche diverse nei differenti organi es. lattico deidrogenasi (LDH) 5 isozimi nel ratto e in altri animali LDH + acido lattico + NAD+ acido piruvico + NADH + H PM = 134.000 4 catene PM = 33.500 M = muscolo H = heart = cuore (forme prevalenti) M4, M3H, M2H2, MH3, H4 I diversi isozimi della LDH differiscono per Km e Vmax verso l’acido piruvico. Nel muscolo scheletrico e nel tessuto embrionale prevale la glicolisi anaerobia glucosio acido lattico M4 ha bassa Km e alta Vmax per il piruvico trasforma rapidamente piruvico acido lattico Nel muscolo cardiaco la glicolisi è fortemente aerobia glucosio CO2 + H2O senza formazione di lattico H4 ha alta Km e bassa Vmax per il piruvico M.N. Gadaleta da: Baynes LDH1 = H4 LDH2 = H3M LDH3 = H2M2 LDH4 = H3M LDH5 = M4 (anche fegato) M.N. Gadaleta c) metaboliche diverse nei differenti comparti cellulari: es. aspartato aminotransferasi (AAT) mitocondriale e citoplasmatico malico deidrogenasi (MDH) mitocondriale e citoplasmatico d) metaboliche diverse, durante il differenziamento e lo sviluppo ,di tessuti adulti dalle loro forme embrionali e fetali: es. profilo isoenzimatico LDH fetale diverso da quello adulto profilo isoenzimatico delle cellule cancerose simili a quelli fetali piuttosto che a quelli adulti. M.N. Gadaleta Non solo E ma molte proteine possono esistere in forme multiple. Oggi si conoscono molte isoforme di proteine ed enzimi. Il loro studio è importante nella ricerca delle basi molecolari del differenziamento. Pattern isoenzimatici in diagnostica: importanti perché gli isoenzimi caratterizzano i diversi tessuti M.N. Gadaleta FINE e) metaboliche di sincronizzazione, attraverso isoenzimatiche a modulatori allosterici diversi: es. biosintesi di AA diversi dall’aspartato in E.coli risposte diverse delle forme A – 3 isoenzimi modulati a “feedback” da affettori diversi B – 2 isoenzimi C – 2 isoenzimi A = aspartochinasi B = omoserina DH C = treonina deidratasi M.N. Gadaleta M.N. Gadaleta da: Champe da: Champe La contemporanea attivazione della glicogeno fosforilasi e inattivazione della glicogeno sintasi evita un ciclo futile. da: Champe M.N. Gadaleta da: Champe da: Champe da: Devlin (II Ed.) M.N. Gadaleta
Scaricare