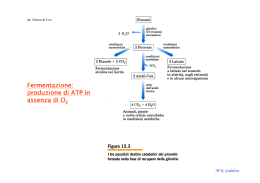
Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA N. 17 ENZIMI V: Chimotripsina La chimotripsina La chimotripsina è una endopeptidasi: catalizza l’idrolisi di legami peptidici interni di una proteina e, in alcuni casi, catalizza anche legami esterei. Il sito di legame della chimotripsina accoglie catene laterali aromatiche di AA o grossi gruppi non polari. La chimotripsina catalizza una reazione a due substrati con meccanismo a ping pong. Maturazione del chimotripsinogeno in α-chimotripsina Sintetizzato e secreto a livello del pancreas Attiva a livello intestinale (3 catene polipeptidiche legate da 2 ponti disolfuro intercatena) da: Campbell et al. M.N. Gadaleta da: Campbell et al. Elissoide: 51 x 40 x 40 Ǻ Poca α-elica Catena molto distesa con ponti H Struttura quasi β 241 AA 3 catene polipeptidiche 3 intracatena 5 ponti SS 2 intercatena M.N. Gadaleta Tutti gli AA polari sono all’esterno tranne quelli con un ruolo fondamentale nella catalisi:Ser195,His57,Asp102 La chimotripsina rompe il legame peptidico di una proteina da: Nelson & Cox Intermedio covalente Nel meccanismo d’azione della chimotripsina si ha una catalisi covalente aiutata da una catalisi acido-basica generale. M.N. Gadaleta Trasferimento di cariche (relais) nella chimotripsina: triade catalitica nel sito attivo dell’enzima Ser195, His57 e Asp102 costituiscono la triade catalitica. Mediante acido iodoacetico è stata individuata His57,mentreSer 195 attraverso DIPF M.N. Gadaleta da: Voet, Voet & Pratt Stiramento del substrato:legame del sito attivo più forte con lo stato di transizione che con S M.N. Gadaleta Meccanismo d’azione della chimotripsina: 1^ fase acilazione 1° prodotto di reazione - L’atomo di O2 di Ser195 attacca il C carbonilico del legame peptidico suscettibile. Si forma C-O e l’O di S acquista una carica negativa netta: intermedio tetraedrico temporaneo stabilizzato dall’ossianione (O-) e da 2 NH della proteina. Un H+ passa da Ser195 a His57. La carica di His57 è in parte neutralizzata da Asp102. Asp102 orienta l’anello imidazolico di His57. H+ passa al legame peptidico suscettibile che viene rotto: il componente aminico rimane legato a His57, mentre il componente acido è esterificato a Ser195. Il componente aminico si stacca. Meccanismo d’azione della chimotripsina: 2^ fase deacilazione 2) His57 strappa un protone all’H2O. OH- attacca il C carbonilico del gruppo acilico legato a Ser195: intermedio tetraedico temporaneo. His57 dona un protone all’O di Ser195 che libera il componente acido del S. 2° prodotto di reazione Evoluzione convergente. Tutte le peptidasi condividono la triade catalitica e la formazione dell’ossianione. Peptidasi di origine evolutiva diversa convergono verso questa struttura che è evidentemente ottimale per la catalisi di un legame peptidico. Richiede catene laterali aromatiche nel AA che fornisce il C-O Richiede Lys+ o Arg+ nel AA che fornisce il C-O Richiede catene laterali piccole e prive di carica nel AA che fornisce il C-O N.B. La conformazione spaziale e di carica del sito attivo è responsabile della specificità di substrato.
Scaricare