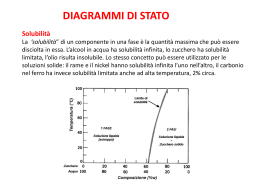
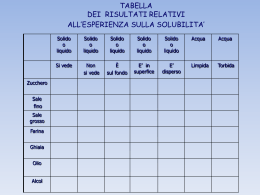
Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl) è pochissimo solubile: a 100 °C 1 L di H2O scioglie appena 20 mg di cloruro di argento. Pertanto, quando ad una soluzione di NaCl si aggiunge una soluzione di AgNO3 avviene una reazione di precipitazione, ovvero si forma una fase solida (o precipitato): AgNO3 (aq) + NaCl (aq) Considerando solo gli ioni interessati, si ha: AgCl(s) + NaNO3(aq) Ag+(aq) + Cl-(aq) AgCl(s) La quantità massima di soluto che si può disciogliere in un solvente ad una data temperatura definisce la solubilità di quella sostanza (normalmente espressa in moli/litro) La presenza della fase solida in equilibrio con la soluzione indica che la soluzione è satura Esempi di precipitati Solubilità e prodotto di solubilità In una soluzione satura di un elettrolita esiste l’equilibrio fra la fase solida e gli ioni che lo costituiscono. Ad es. : AgCl(s) ⇄ Ag+(aq) + Cl-(aq) L’equilibrio eterogeneo è definito dalla costante chiamata costante del prodotto di solubilità: KPS = [Ag+]·[Cl-] = 1,82·10-10 ( a 25 °C) In generale, per l’ elettrolita MaXb, si ha: MaXb(s) ⇄ a Mn+ + b Xm- KPS= [Mn+]a · [Xm-]b La solubilità s di un composto ionico in acqua pura è legata alla costante del prodotto di solubilità. Per es., se una soluzione satura di AgCl è stata ottenuta per dissoluzione di AgCl, deve essere: s = [Ag+] = [Cl-] e quindi s = (KPS)1/2 = 1,35·10-5 M (a 25 °C) Reazioni di precipitazione L’aggiunta di una soluzione di cromato di sodio, Na2CrO4, sostanza di colore giallo solubile in acqua, ad una soluzione di AgNO3 (sostanza incolore solubile in acqua) determina la formazione di un precipitato di cromato di argento, poco solubile: 2 AgNO3(aq) + Na2CrO4(aq) Ag2CrO4(s) + 2 NaNO3(aq) 2 Ag+(aq) + CrO42-(aq) ⇄ Ag2CrO4(s) L’aggiunta di due moli di AgNO3 ogni mole di Na2CrO4 forma la quantità stechiometrica di Ag2CrO4. La quantità di solido che si separa dipende dalla solubilità del precipitato formatosi La costante del prodotto di solubilità (KPS= 9,0·10-12) è relativa all’equilibrio: Ag2CrO4 (s) 2 Ag+ (aq) + CrO42-(aq) KPS = [Ag+]2·[CrO42-] In una soluzione di ioni Ag+ 0,100M, la concentrazione massima possibile di ioni CrO42- è calcolabile dalla relazione: [CrO42-] = KPS/ [Ag+]2 = 9,0·10-12/ (0,100)2 = 9,0 ·10-10 Superata questa concentrazione inizia la precipitazione della fase solida Ag2CrO4 In una soluzione formata per dissoluzione di questo sale, a 25 °C, ad equilibrio raggiunto, devono valere le seguenti eguaglianze: [Ag+] = 2s [CrO42-] = s dove s rappresenta la solubilità del composto, ovvero il numero di moli di Ag2CrO4 disciolte in un litro di soluzione satura, a quella temperatura. Noto il valore numerico della costante è quindi possibile calcolare la solubilità del composto: KPS = 9,0·10-12 = (2s)2·(s) s = 1,3 ·10-4 mol/L Effetto dello ione in comune sulla solubilità Negli equilibri eterogenei delle reazioni di dissoluzione o di precipitazione, l’aggiunta di uno ione comune al composto poco solubile ne fa diminuire la solubilità (principio di Le Châtelier) Ad es., consideriamo la solubilità di Ag2CrO4 (KPS= 9,0·10-12) in una soluzione 0,100 M di AgNO3. Prima della dissoluzione di Ag2CrO4 si ha: [Ag+]° = 0,100 (derivante dalla dissoluzione di AgNO3) [CrO42-]° = 0 In seguito alla dissoluzione di Ag2CrO4 si instaura l’equilibrio: Ag2CrO4(s) ⇄ 2Ag+ (aq) + CrO42-(aq) Assumiamo che si sciolgano x mol/L di cromato di argento. Le concentrazioni all’equilibrio sono: [Ag+] = 0,100 + 2x ; [CrO42-] = 0 + x 9,0·10-12 = (0,100 + 2x)2 ·(x) (0,100)2 · x x = 9,0 · 10-10 mol/L La solubilità di Ag2CrO4 in acqua pura è 1,3 ·10-4 mol/L Quindi la solubilità di questo sale in presenza dello ione in comune è molto minore rispetto a quella in acqua pura Effetto del pH sulla solubilità Il pH di una soluzione può modificare significativamente la solubilità di un sale. Per es. l’idrossido di magnesio si scioglie secondo l’equilibrio: Mg(OH)2(s) ⇄ Mg2+(aq) + 2 OH-(aq) KPS = 8,9·10-12 L’aggiunta di ioni OH-, per effetto dello ione in comune, diminuisce la solubilità di Mg(OH)2. L’aggiunta di ioni H3O+ (diminuzione del pH) aumenta la solubilità perché ioni OH-, reagendo con i protoni, vengono neutralizzati spostando così l’equilibrio verso destra. Mg(OH)2 (latte di magnesia) è usato come antiacido Analogamente, la solubilità di Ca3(PO4)2 è maggiore in ambiente acido che in acqua pura perché l’anione PO43-, essendo la base coniugata di un acido molto debole (HPO42-, pKa = 12,6), in ambiente acido si converte in HPO42- spostando verso destra l’equilibrio: Ca3(PO4)2 (s) ⇄ 3 Ca2+(aq) + 2 PO43-(aq) KPS = 1,3·10-32 Effetto del pH sulla solubilità Il calcare, CaCO3, è una sostanza poco solubile (Kps = 4,5·10-9) L’acqua piovana è leggermente acida a causa della CO2 disciolta: CO2(aq) + 2 H2O(l) ⇄ HCO3- (aq) + H3O+(aq) Ka= 4,4·10-7 Attraversando un terreno ricco di calcare, CaCO3 viene convertito in Ca(HCO3)2, solubile in acqua: CaCO3 (s) + H2O(l) + CO2(aq) Ca(HCO3)2 (aq) Questa azione di solubilizzazione può creare delle grandi cavità (grotte calcaree) Dato che la reazione è reversibile, il gocciolamento di una soluzione acquosa di Ca(HCO3)2 dal soffitto di una grotta, nel corso di millenni, può formare dei depositi di CaCO3 sul soffitto della grotta (stalattiti) oppure sul pavimento della stessa (stalagmiti) Il solfato di bario è una sostanza poco solubile Lo ione Ba2+ è tossico per l’uomo. La piccola solubilità del solfato di bario, BaSO4 (KPS = 1,5·10-9), permette l’uso di questa sostanza nella diagnostica medica Equilibri di complessamento Uno ione complesso è una specie carica costituita da uno ione metallico circondato da atomi o gruppi di atomi chiamati leganti Un legante è una molecola (H2O, NH3, CO, O2) o uno ione (Cl-, CN-,) avente una coppia di elettroni solitaria che può essere donata allo ione metallico per formare un legame covalente. Il numero di leganti uniti al centro metallico è chiamato numero di coordinazione Co(H2O)62+; Ni(NH3)62+; CoCl42-; PtCl2(NH3)2 Ogni ione complesso è caratterizzato da una costante di formazione o costante di stabilità. Per esempio, quando una soluzione di NH3 viene aggiunta ad una soluzione di ioni Ag+ avvengono le seguenti reazioni di equilibrio: Ag+(aq) + NH3 (aq) ⇄ Ag(NH3)+(aq) K1 = 2,1·103 Ag(NH3)+ + NH3(aq) K2 = 8,2 ·103 Ag(NH3)2+(aq) Effetto della formazione di complessi sulla solubilità di una sostanza La formazione di complessi può causare la completa solubilizzazione di una sostanza poco solubile in acqua. Per es., l’aggiunta di una soluzione acquosa di NH3 ad un precipitato di AgCl determina un aumento della sua solubilità in seguito alla formazione degli ioni complessi Ag(NH3)+ e Ag(NH3)2+: AgCl(s) ⇄ Ag+(aq) + Cl-(aq) Ag+(aq) + NH3(aq) Ag(NH3)+(aq) + NH3(aq) Ag(NH3)+(aq) Ag(NH3)2+(aq) La somma di queste 3 reazioni porta all’equazione: AgCl(s) + 2 NH3(aq) Ag(NH3)2+(aq) + Cl-(aq) K = 2,8·10-3 a) In una soluzione acquosa di NH3 10,0 M la solubilità di AgCl è 0,48 moli/L; b) in acqua pura è 1,3·10-5 mol/L
Scaricare



![K ps = [Ca 2+ ]](http://s2.diazilla.com/store/data/000128004_1-8ae544435108dbec861deb5fa2c69e2d-260x520.png)