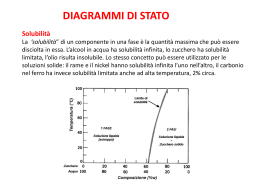
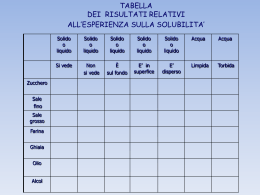
SOLUBILITA’ SOLUBILITA’IN ACQUA MOLECOLE DI ACQUA SOLUBILITA’ ► Rappresenta un parametro di estrema importanza che molto spesso consente non solo di capire la natura della sostanza in esame ma può condurre direttamente all’identificazione della stessa. ► La solubilità può anche rappresentare un utile parametro per capire il grado di purezza di una nota sostanza. ► Il suo valore è estremamente influenzato dalla temperatura per cui è bene sempre specificare la temperatura alla quale essa viene determinata. Nella F.U. per ogni composto iscritto è riportata anche la sua solubilità in vari solventi sia inerti che reattivi. La solubilità è intesa determinata a 20 °C e si esprime in parti per milione (ppm). Solventi Inerti Acqua Etere Etanolo Cloroformio Acetone Benzene Solventi Reattivi La solubilizzazione in tali solventi avviene grazie ad una reazione acido-base. SOLUBILITA’ Gradi e criteri di solubilità: SOLUBILISSIMO : 1 p. di sostanza in meno di 1 p. di solv MOLTO SOLUBILE : 1 p. di sostanza in 1 a 10 p. di solv. SOLUBILE : 1 p. di sostanza in 10 a 30 p. di solv. MODERATAMENTE SOLUBILE : 1 p. di sostanza in 30 a 100 p. di solv. POCO SOLUBILE : 1 p. di sostanza in 100 a 1000 p. di solv. MOLTO POCO SOLUBILE : 1 p. di sostanza in 1000 a 10.000 p. di solv. PRATICAMENTE INS. : 1 p. di sostanza in piu di 10.000 p. di solv. La solubilizzazione di una sostanza nei solventi avviene mediante fenomeni di associazione tra le sue molecole o gli ioni provenienti dalla sua dissociazione elettrolitica, e le molecole del solvente. Altre comuni espressioni usate per indicare la solubilità: % p/p espressi come 100 g di solvente o 100 g di soluzione % p/v espressi come 100 ml di solvente o 100 ml di soluzione % p/v = % p/p x d Quando la solubilità non è completa, può essere utile filtrare la sospensione ed esaminare il residuo ed il filtraggio: - il residuo può essere ripreso con acqua; se si tratta di un sale, questo risulterà assai più solubile in acqua che nell’acido o nella base impiegata, venendo a mancare l’effetto dello ione a comune; - il filtrato, acido o alcalino, può essere a sua volta alcalinizzato o acidificato, rispettivamente, al fine di liberare la sostanza salificata in soluzione. La formazione di un precipitato conferma l’avvenuta reazione acido-base e quindi la solubilità del composto. ATTENZIONE: La solubilità reattiva nelle soluzioni di carbonati o bicarbonati deve essere accompagnata da un evidente sviluppo di bollicine gassose dovute alla formazione di CO2 Solventi reattivi più comunemente adoperati sono: NaOH 2.5 M, Na2CO3 1 M, NaHCO3 1.5 M, HCl 1.2 M RCOOH + OH - 2 RCOOH + CO3= RCOOH + HCO3 R N + H+ 3 RCOO + H2O 2 RCOO + CO2 RCOO + H2O + CO2 R NH+ 3 ATTENZIONE: Non sottovalutare la presenza di sostanze anfotere. Natura della Solubilità La solubilità dipende dalle forze intermolecolari esercitate tra le varie molecole del composto e quelle esercitate dalle molecole del composto con quelle del solvente. In prima approssimazione possiamo dire che la solubilità è tanto più elevata quanto più simili sono i tipi di legame presenti nella molecola del solvente ed in quella del soluto. 1- Legame Ionico o Eteropolare 2- Legame covalente od omeopolare 3- Legame Idrogeno 4- Forze di Van der Waals LEGAME IONICO O ETEROPOLARE E’ un legame tipico dei sali, di Sali metallici di acidi organici, degli enoli, e dei fenoli. Esso si stabilisce tra due elementi quando uno di essi ha un valore di elettronegatività maggiore rispetto all’altro. In tal caso il più elettropositivo cede elettroni all’altro e i due atomi assumono una carica di segno opposto. + - Link alla Tabella Periodica LEGAME COVALENTE OD OMEOPOLARE Tipico legame che si può instaurare tra due atomi che sono elettroequivalenti per cui la nuvola elettronica si distribuirà egualmente tra gli atomi. In altri casi in cui l’elettronegatività è diversa, ci sarà un eccesso di carica negativa sul più elettronegativo. A---------B A---------B δ+ δ- Nel 2° caso il legame avrà un carattere parzialmente ionico per cui i baricentri delle cariche positive e negative non coincidono generando così un dipolo. Come tutti i dipoli esso sarà caratterizzato da un momento dipolare, indicato µ Il momento dipolare è in relazione con la costante dielettrica e con l’indice di rifrazione della sostanza. Più elevato il valore della costante dielettrica tanto maggiore è la polarità del composto. Composto Costante dielettrica Composto Costante dielettrica Acido cianidrico 114 Acido formico 58.4 Dimetilformammide 109 Nitobenzene 35.7 Acqua ossigenata 84,2 Metanolo 33.6 Acido fluoridrico 84 Etanolo 23 Acqua 81 Acetone 0.7 LEGAME IDROGENO E’ di estrema importanza nel regno biologico. Come è noto esso si forma tra un atomo di idrogeno ed uno specifico atomo caratterizzato da elevata elettrogenatività. Esso è caratterizzato, inoltre, da bassa entità energetica e la sua natura dipende dalla natura degli atomi che sono collegati all’atomo di idrogeno. Maggiore è la sua elettronegatività maggiore risulterà la forza di legame. Il legame idrogeno influenza le proprietà fisiche e chimiche delle sostanze nelle quali è presente. Tra queste ricordiamo: punto di ebollizione, il punto di fusione, la solubilità e l’acidità. O H : O N H : O O H : N Punto di Fusione Punto di Ebollizione 100 °C H 2O HF 0 °C H 2O H2Te H2Te NH3 -100 °C H2Se H 2S HF HBr HCl PH3 HI NH3 H2Se HI SbH3 AsH3 HBr PH3 AsH3 GeH4 SiH4 SnH4 -200 °C GeH4 CH4 SiH4 HCl CH4 SbH3 SnH4 H H H O H O H H H H Molecole di Acqua H H H O H R R O O H H O O R R O O H Molecole di Alcool Correlazione tra punto di ebollizione e legame idrogeno Acqua Metanolo Etanolo Propanolo Dimetiletere Peso Molecolare 18 32 46 60 46 Punto di Ebollizione 100 65 78 97 25 Valori espressi in °C Legame Idrogeno e Solubilità O R H O C C O H R Acidi carbossilici O CO-NH2 CO-NH-CH3 CO-N(CH3)2 CO-NH2 CO-NH-CH3 CO-N(CH3)2 p.f. 420 °C p.f. 217 °C p.f. 80 °C Ammidi sostituite ALTRI ESEMPI: CH3 CH3 C C H2C O HC C C2H5O H C O C2H5O COOH O O OH OH O Acidi orto, meta e para Idrossi-benzoici H O O C C H H COOH Acidi orto, meta e para Idrossi-benzoici OH OH COOH C O H HO O COOH Acido Acetilsalicilico O COCH3 FORZE DI VAN DER WAALS ☻Sono forze di natura elettrostatica generalmente molto deboli, almeno in confronto con le forze di interazione elencate in precedenza. ☻Il valore dell’entità di tale forza aumenta in genere con l’aumentare del peso molecolare. In una serie omologa di composti organici, l’aumento del punto di fusione e del punto di ebollizione passando dagli omologhi inferiori a quelli superiori, è dovuto all’accumularsi delle forze di Van der Waals. Relazione tra Peso Molecolare e Solubilità Composto P.M. Solubilità a Ac. n-butirrico 88.10 Miscibile Ac. n-valerianico 102.13 4 Ac. n-capronico 116.16 Poco solubile Ac. n-enantico 130.18 Insolubile Alcool propilico 60.09 Miscibile Alcool butirrico 74.12 9 Alcool amilico 88.15 2 Alcool esilico 102.17 0.6 a = g/100 ml Relazione tra Punto di Fusione e Solubilità Nel processo di solubilizzazione entrano in gioco oltre alle forze intermolecolari esistenti tra soluto e solvente anche le forze intramolecolari del soluto puro. Queste forze si possono valutare prendendo in considerazione i punti di fusione e di ebollizione del soluto. Composto P.M. Solubilità a CH3-CH2-CH2-OH 60.09 Miscibile Cl-CH2-CH2-CH2-OH 94.54 50 Br-CH2-CH2-CH2-OH 139.00 16.6 a = g/100 ml Separazione di Sostanze Organiche mediante la Solubilità La solubilità viene valutata nei seguenti solventi: 1234567- H 2O Etere Etilico NaHCO3 2N Na2CO3 2N NaOH 2N HCl 2N H2SO4 Prima di effettuare le prove di solubilità accertarsi che la sostanza sia perfettamente omogenea. A- SOLUBILITA’ IN ACQUA L’acqua per il suo carattere fortemente polare è in grado di sciogliere i composti ionici e tutte quelle sostanze che si possono trasformare in ioni attraverso una reazione di tipo acido-base. B: + H-OH RCOOH + H2O B:H+ + OHRCOO- + H2O:H+ Si solubilizzano in acqua tutte quelle sostanze organiche basiche o acide che sono in grado di formare con essa dei legami idrogeno Parte Lipofila Parte Idrofila La solubilità in acqua è influenzata dalla minore o maggiore prevalenza del gruppo polare rispetto al gruppo non polare. Generalmente quando è presente un solo gruppo polare la molecola è ancora solubile in acqua se il radicale idrofobico della molecola non supera i 4 atomi di carbonio a catena lineare o i 5 atomi a catena ramificata. ☻In pratica si può generalizzare affermando che il rapporto tra gli atomi di carbonio e gruppi polari deve essere di 4:1 o 5:1 per molecole lineari o ramificate. Esempi acidi organici CH3 H3 C C CH3 5:1 6:1 COOH B- SOLUBILITA’ IN ETERE Valori delle costanti dielettriche: Acqua: Etere etilico 81 4.3 Sostanze apolari e quelle poco polari si sciolgono bene in etere mentre i composti Ionici non si sciolgono. In base alla solubilità in acqua ed etere etilico è possibile suddividere le sostanze in 4 gruppi: ABCD- Solubili in Acqua ed Etere Etilico Solubili in Acqua ed insolubili in Etere Insolubili in entrambi Solubili in Etere ed insolubili in Acqua A- Solubili in Acqua ed Etere Etilico La sostanza in esame non è di natura ionica. Ha in genere un solo gruppo Polare capace di dare origine a dei legami idrogeno B- Solubili in Acqua ed Insolubili Etere Etilico Si tratta di una sostanza ionica oppure di una sostanza il cui rapporto atomi di Carbonio e gruppi polari è inferiore a 5:1 C- Insolubili in entrambi Si tratta di sostanze ad elevato peso molecolare oppure con elevato punto di fusione. D- Solubili in Etere Etilico e insolubili in Acqua Sostanza decisamente organica che comunque non rientra nelle 3 categorie prima descritte. Sostanza Insolubile in Acqua NaHCO3 Na2CO3 NaOH HCl NaHCO3 2N Na2CO3 2N NaOH 2N Sostanze Acide 2N 2N 2N 2N HCl 2N Sostanze Basiche C- SOLUBILITA’ IN BICARBONATO HA + NaHCO3 (NaHCO3 satura) NaA + H2O + CO2 Ka = 4 x 10-11 Le sostanze organiche capaci di spostare l’acido carbonico dai bicarbonati sono gli acidi carbossilici alifatici ed aromatici e gli acidi solfonici. Non si sciolgono in bicarbonato i fenoli forti, fenoli con gruppi elettron-attrattori CH3-CH2-CH2-CH2-COOH O COOH H COOH HN OH O H N H O Acido p-Ammino Salicilico Acido Salicilico Acido p-Nitro Salicilico D- SOLUBILITA’ IN CARBONATO SODICO 2N HA + Na2CO3 HA + NaHCO3 NaA + H2O + NaHCO2 NaA + H2O + CO2 Ka = 4.3 x 10-7 Ka = 4 x 10-11 SI sciolgono in tale soluzione tutte le sostanze che si sciolgono in bicarbonato e sostanze aventi un carattere di acido di media forza. OH R Saccarina R= NO2, F, ecc E- SOLUBILITA’ IN NaOH 2N In tale soluzione si sciolgono tutte le soluzioni decisamente acide. In particolare, gli acidi carbossilici, i fenoli, i tiofenoli, i mercaptani e le solfonammidi reagiscono con NaOH per formare dei Sali solubili in acqua. Reagiscono anche ossime ed acidi idrossammici. NH-R Acidi idrossammici SO2-NH2 Solfonammidi ossime R-SO2-NH2 R-SO2-NH- R-CO-NHOH R-CO-NH-O- R-CH=N-OH R-CH=N-O- OCH3 CH3 OH HO HO CHO CH H 3C CH3 Vanillina β-Naftolo Timolo OH O Fenoli N H O Succinimmide F- SOLUBILITA’ IN HCl 2N Le sostanze che non sono solubili in acqua ma che si sciolgono in acido cloridrico sono sostanze sufficientemente basiche. L’entità della basicità di un composto si può valutare dal valore della Ka. R1 H H N H + HCl R2 N H+ Cl- R3 R1 R2 N R3 Al variare del radicale presente la basicità può essere modificata CH3-NH2 Kb = Kb = 5x10-4 3.8x10-10 CH2-NH2 H3C NH Kb = 7x10-4 Kb = 2x10-5 H3C CH3 N CH3 CH3 Kb = 7x10-5 H N Kb = 1x10-13 NH2 COMPOSTI ANFOTERI R1 H NH2 C C R2 NH2 NH2 R2 COOH COOH Sulfamidici Amminoacidi SO2NH2 NH2 NH2 O2 S H N N O2 S H N COCH2CH2COOH S N N HN NH2 O2 S N C NH2 NH2 O2S H N S N SOLUBILITA’ COMPOSTI INORGANICI
Scaricare