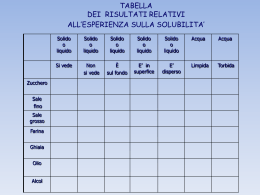
DIAGRAMMI DI STATO Solubilità La ‘solubilità” di un componente in una fase è la quantità massima che può essere disciolta in essa. L’alcool in acqua ha solubilità infinita, lo zucchero ha solubilità limitata, l’olio risulta insolubile. Lo stesso concetto può essere utilizzato per le soluzioni solide: il rame e il nickel hanno solubilità infinita l’uno nell’altro, il carbonio nel ferro ha invece solubilità limitata anche ad alta temperatura, 2% circa. 1 COMPONENTE 2 COMPONENTI La regola delle fasi di Gibbs : stabilisce un criterio per il numero di fasi che possono coesistere all'interno di un sistema all'equilibrio. La regola di Gibbs è espressa dalla semplice equazione F+V=C+N F = numero delle fasi presenti C = numero di componenti presenti nel sistema V (varianza) = numero di gradi di libertà N = numero di variabili non composizionali (ad esempio, temperatura e pressione). PUNTO 1 : N=1, l’unica variabile non composizionale del sistema è la temperatura (Il diagramma è costruito a pessione costante) F=1, siamo in fase liquida omogenea. C=2, (A e B). Pertanto V=C+N-F=2+1-1=2. PUNTO 2 : N=1 (temperatura) F=3 (liquido+a+b) C=2 (A e B) Pertanto V=0. Cioè non è possibile variare nessun parametro senza modificare il numero di fasi d’equilibrio. Curve di Tamman Andamento della temperatura di un sistema in funzione del logaritmo del tempo, quando sottoposto a raffreddamento. Dalla conoscenza del diagramma di stato e della regola delle fasi è sempre possibile ricavare le curve di Tamman. bivariante monovariante bivariante zerovariante DIAGRAMMA DI STATO DI UN SISTEMA BINARIO ISOMORFO Un sistema binario isomorfo è caratterizzato dalla completa solubilità, sia allo stato liquido che a quello solido, dei due componenti l’uno nell’altro. Per la maggiore o minore solubilità di due componenti si ricordano le REGOLE DI HUME-ROTHERY. LIQUIDUS SOLIDUS REGOLA DELLA LEVA C0 C L W C C L C C 0 WL . C C L TIE-LINE Microstruttura di una lega binaria isomorfa. Raffreddamento d’equilibrio Lega binaria isomorfa – Raffreddamento di non-equilibrio Trasformazione eutettica: L( ) S ( ) S ( ) Trasformazione eutettoidica: S ( ) S ( ) S ( ) Trasformazione peritettica: S ( ) L( ) S ( ) Trasformazione peritettoidica: S ( ) S ( ) S ( ) Trasformazione monotettica: L( ) S ( ) L( ) Trasformazione sintettica: L( ) L( ) S ( ) DIAGRAMMA DI STATO CON EUTETTICO (Cu-Ag) Microstrutture di un sistema eutettico Microstrutture di un sistema eutettico TRASFORMAZIONI EUTETTOIDICA e PERITETTICA PERITETTICA L S ( ) S ( ) EUTETTOIDICA S ( ) S ( ) S ( ) TRASFORMAZIONE EUTETTOIDICA Raffreddamento acciaio Ipo-eutettoidico Raffreddamento acciaio Iper-eutettoidico Elementi austenitizzanti Si può ancora fare una distinzione all’interno di questa classe: elementi in grado di dare origine ad un campo completamente aperto Es: Ni, Mn, Co, … elementi che danno origine ad un campo chiuso Es: C, N, Cu, Zn, Au, … Elementi ferritizzanti Anche in questo caso possiamo fare un’ulteriore distinzione all’interno di questa classe: elementi in grado di collegare il campo a con quello Es: Cr, Al, Mo, Si, P, V, W, … elementi che non sono in grado di collegare il campo a con quello (caso molto meno importante a causa degli elementi interessati) Es: B, S, Nb, Ce, Ta, … TRASFORMAZIONI ISOTERME – CURVE TTT Trasformazione perlitica: Acciaio eutettoidico Equazione di AVRAMI Trasformazione bainitica superiore inferiore PROPRIETA’ MECCANICHE DELLE LEGHE Fe-C Curve TTT in presenza di elementi di lega TRASFORMAZIONE CON RAFFREDDAMENTO CONTINUO CURVE CCT TRASFORMAZIONE CON RAFFREDDAMENTO CONTINUO CURVE CCT IPOEUTETTOIDICO IPEREUTETTOIDICO
Scaricare