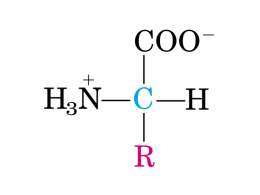
Metabolismo degli amminoacidi Gli amminoacidi derivati in gran parte dalla degradazione delle proteine della dieta o intracellulari possono essere ossidati per generare energia. La quantità di energia ricavata dall’ossidazione degli amminoacidi varia in funzione del tipo di organismo e della situazione metabolica. Il catabolismo degli amminoacidi nelle piante è in genere correlato alla produzione di metaboliti per altre vie biosintetiche. Tre situazioni in cui gli amminoacidi negli animali subiscono una degradazione ossidativa: 1) Durante la sintesi e degradazione delle proteine cellulari (turnover delle proteine), alcuni amminoacidi, se non necessari per la sintesi di altre proteine possono essere ossidati. 2) Quando una dieta è ricca di proteine e gli amminoacidi sono in eccesso per la sintesi di proteine; non si possono formare riserve di amminoacidi! 3) Durante il digiuno prolungato. La prima tappa del catabolismo degli amminoacidi in qualunque organismo consiste normalmente nella rimozione del gruppo α-amminico. La rimozione del gruppo α-amminico (con la formazione di un α-chetoacido) è dovuta all’azione di enzimi chiamati amminotransferasi o transaminasi. Nel loro insieme le amminotransferasi convogliano il gruppo α-amminico della maggior parte degli amminoacidi all’α-chetoglutarato formando glutammato. Il glutammato viene trasportato dal citosol nei mitocondri dove viene sottoposto a deaminazione ossidativa catalizzata dalla L-glutammato deidrogenasi. L’α-chetoglutarato prodotto dalla reazione della glutammato deidrogenasi è un intermedio del ciclo dell’acido citrico. La glutammato deidrogenasi è un enzima allosterico molto complesso. -Il GTP, un prodotto della succinil-CoA sintetasi nel ciclo dell’acido citrico, ne è un modulatore negativo La glutammina trasporta ammoniaca attraverso il sangue. Composto con carica negativa Nei tessuti extraepatici lo ione NH4+ per l’escrezione prodotto dalla reazione catalizzata dalla glutammato deidrogenasi, reagisce col glutammato per formare glutammina, un trasportatore non tossico di gruppi amminici che può attraversare le membrane cellulari. Durante questa reazione, catalizzata dalla glutammina sintetasi viene idrolizzato ATP. Composto neutro La glutammina entra nel circolo sanguigno e raggiunge il fegato. Nei mitocondri epatici il gruppo amminico è nuovamente convertito in NH4+ , con l’intervento della glutamminasi. Il principale trasportatore di ammoniaca dal muscolo al fegato è l’alanina. L’alanina viene prodotta quando i gruppi amminici, raccolti dal glutammato, sono trasferiti al piruvato. Questa reazione è catalizzata dalla alanina transaminasi. Nel fegato il gruppo amminico trasportato è trasferito dall’alanina nuovamente all’α-chetoglutarato generando glutammato e piruvato. Il piruvato può essere utilizzato dal fegato per la gluconeogenesi. Il ciclo del glucosio-alanina L’ammoniaca libera è molto tossica e non può essere accumulata nell’organismo. I gruppi amminici se non vengono riutilizzati per la sintesi di altri amminoacidi o altri prodotti azotati devono essere eliminati Molti organismi acquatici rilasciano l’ammoniaca semplicemente sotto forma di ioni NH4+. Gli organismi che eliminano ammoniaca non possono vivere in ambienti in cui l’acqua è limitata. L’evoluzione delle specie terrestri è sostanzialmente dipesa dallo sviluppo delle capacità di convertire l’ammoniaca in composti non tossici da eliminare in un piccolo volume di acqua. La maggior parte dei vertebrati terrestri converte l’ammoniaca in urea (uomo, altri mammiferi, anfibi adulti) o in acido urico (uccelli e rettili) Negli uccelli e nei rettili, la disponibilità di acqua è un elemento fondamentale nello scegliere l’acido urico come via di eliminazione dell’azoto -l’urea viene escreta con le urine (+ acqua) -l’acido urico, poco solubile, viene escreto con le feci sotto forma di cristalli di acido urico. La prima tappa nella produzione dell’urea consiste nella formazione del carmamil fosfato catalizzata dalla carbamil fosfato sintetasi I. carbossifosfato Questo processo avviene all’interno della matrice mitocondriale epatica e porta all’accoppiamento covalente di un azoto del NH4+ con un atomo di carbonio. Nella reazione si consumano 2 ATP. Carbamil fosfato Il ciclo dell’urea Il gruppo carbamilico ha un elevato potenziale di trasferimento a causa del suo legame anidride e viene trasferito all’ornitina per formare citrullina. 2Pi La citrullina è trasportata dalla matrice mitocondriale nel citosol dove si condensa con l’aspartato, il donatore del secondo gruppo amminico. L’argininosuccinasi scinde l’argininsuccinato in arginina e fumarato. L’arginina è infine idrolizzata in urea e ornitina. L’ornitina è trasportata nuovamente nel mitocondrio per iniziare un nuovo ciclo, mentre l’urea è eliminata tramite escrezione. La sintesi del fumarato è importante perché lega il ciclo dell’urea al ciclo dell’acido citrico. Il fumarato viene idratato a malato che a sua volta viene ossidato ad ossalacetato. L’ossalacetato ha diversi possibili destini metabolici: 1) Transaminazione ad aspartato 2) Conversione a glucosio attraverso la via gluconeogenetica (via fosfoenolpiruvato) 3) Condensazione con l’acetil CoA per la sintesi di citrato (ciclo dell’acido citrico) 4) Conversione in piruvato. La reazione netta nella formazione del carbamil fosfato più il ciclo dell’urea è: O O CO2 + NH4+ + 3 ATP + -O - C - CH2 - CH - C - ONH3+ Aspartato O 2HN O O - C - NH2 + 2 ADP + 2 Pi + AMP + PiPi + 7 H+ + -O - C - CH = CH - C - OUrea Fumarato 2 Pi L’escrezione dell’urea e l’idrolisi del pirofosfato spingono la reazione verso il compimento. Uno degli atomi di azoto proviene da NH4+, mentre l’altro dall’aspartato. La reazione netta nella formazione del carbamil fosfato più il ciclo dell’urea è: O O CO2 + NH4+ + 3 ATP + -O - C - CH2 - CH - C - ONH3+ Aspartato O 2HN O O - C - NH2 + 2 ADP + 2 Pi + AMP + PiPi + 7 H+ + -O - C - CH = CH - C - OUrea Fumarato 2 Pi Considerando l’idrolisi del pirofosfato, durante la produzione di una sola molecola di urea vengono scissi 4 legami fosfoanidridici. La detossificazione di NH4+ è un processo che richiede energia. Destino degli scheletri carboniosi degli amminoacidi La strategia della degradazione degli amminoacidi è quella di convertire gli scheletri carboniosi in intermedi metabolici di primaria importanza, che possono essere trasformati in glucosio o ossidati nel ciclo dell’acido citrico. Gli amminoacidi che sono degradati a acetil CoA o acetoacetil CoA sono detti chetogenici, in quanto possono dare origine a corpi chetonici oppure essere utilizzati per la sintesi di acidi grassi. Gli amminoacidi che sono degradati a piruvato o ad intermedi del ciclo dell’acido citrico sono detti glucogenici perché possono essere utilizzati per la sintesi netta di glucosio. I mammiferi non hanno una via metabolica per la sintesi diretta di glucosio a partire da acetil CoA o acetoacetil CoA. Destino degli scheletri carboniosi degli amminoacidi Gli amminoacidi glucogenici sono colorati in violetto, mentre quelli chetogenici sono colorati in giallo. Quasi tutti gli amminoacidi sono sia glucogenici che chetogenici Biosintesi degli amminoacidi L’azoto è un componente essenziale degli amminoacidi L’atmosfera è ricca di azoto gassoso (N2), una molecola poco reattiva. Certi organismi come i batteri che vivono nei noduli radicali del Trifolium aureum sono in grado di convertire l’azoto gassoso in ammoniaca. Questo composto può essere utilizzato per sintetizzare prima glutammato e glutammina e poi altri amminoacidi. Il ciclo dell’azoto Alcuni batteri in condizioni anaerobiche La fissazione dell’azoto Soltanto poche specie di batteri possono convertire l’azoto atmosferico (N2) in ammoniaca (NH3). La fissazione dell’azoto è mediata da due enzimi che sono uniti in un complesso noto come complesso della nitrogenasi, la nitrogenasi riduttasi e la nitrogenasi. Gli elettroni per la riduzione dell’N2 provengono di solito dall’ossidazione di composti organici o dalla fotosintesi. Gli elettroni fluiscono dalla ferredossina (generata nella fotosintesi o in altri processi ossidativi) alla riduttasi (una ferroproteina) e raggiungono la nitrogenasi (una proteina molibdeno-ferro) per ridurre l’azoto ad ammoniaca. L’idrolisi dell’ATP nella riduttasi determina alcune modificazioni conformazionali necessarie per un efficiente trasferimento degli elettroni. Per ciascun elettrone trasferito vengono idrolizzate 2 molecole di ATP. La fissazione dell’azoto (b) Sebbene solo 6 elettroni siano richiesti per ridurre l’N2 a 2 NH3, 8 elettroni debbono passare attaverso il complesso della nitrogenasi per ridurre una molecola di N2. I due elettroni in più sono dovuti alla produzione obbligatoria di una molecola di H2. La reazione catalizzata dalla nitrogenasi è: N2 + 8 H+ + 16 ATP + 16 H2O ' 2 NH3 + 16 ADP + 16 Pi + H2 La fissazione dell’azoto è un processo costoso dal punto di vista del consumo energetico. Il complesso della nitrogenasi è estremamente sensibile all’inattivazione da parte dell’O2. I noduli che fissano l’azoto Alcuni batteri che fissano l’azoto vivono quali simbionti nei noduli delle radici delle piante leguminose. Le piante forniscono l’energia per la fissazione dell’azoto sotto forma di carboidrati. Le piante producono una proteina che lega l’O2, la leghemoglobina, che evita che l’O2 interferisca col complesso della nitrogenasi. I noduli che fissano l’azoto Fotografia al microscopio elettronico di una sezione sottile di un nodulo di una radice di pisello. In rosso i batteri simbiontici, in giallo/verde il nucleo della cellula vegetale. L’azoto ridotto, sotto forma di ione ammonio NH4+ è incorporato nelle biomolecole attraverso il glutammato e la glutammina. Il glutammato e la glutammina sono poi utilizzati direttamente o indirettamente come fonte di azoto per la biosintesi di altri composti azotati (altri amminoacidi, purine, pirimidine) La glutammato deidrogenasi La glutammato deidrogenasi catalizza l’amminazione riduttiva dell’α-chetoglutarato. Base di Schiff Gli equivalenti riducenti necessari alla reazione sono forniti dal NADPH. Nei mammiferi la glutammato deidrogenasi catalizza la reazione inversa durante il catabolismo degli amminoacidi (usando NAD+ come ossidante) La glutammina sintetasi La glutammina sintetasi catalizza la produzione dipendente da ATP di glutammina da glutammato e NH4+ . La reazione catalizzata dalla glutammina sintetasi rappresenta il punto d’ingresso dell’azoto ridotto nel metabolismo cellulare. La glutammina sintetasi è il sito di regolazione del metabolismo dell’azoto. Numerosi prodotti finali del metabolismo della glutammina sono inibitori allosterici dell’enzima. La glutammina sintetasi è soggetta oltre alla regolazione allosterica anche a regolazione covalente (aggiunta reversibile di unità di AMP, adenilazione, o di UMP, uridilazione) Il gruppo α-amminico della maggior parte degli amminoacidi proviene dal gruppo α-amminico del glutammato per transamminazione. La glutammina fornisce il suo atomo di azoto della catena laterale nella biosintesi di numerosi composti, tra cui il triptofano e l’istidina. Biosintesi degli amminoacidi L’alanina, l’aspartato e il glutammato vengono prodotti ciascuno tramite una reazione di transamminazione che si svolge in una sola tappa. Per sintetizzare ciascuno degli altri amminoacidi non essenziali sono necessarie tappe ulteriori. Famiglie biosintetiche di amminoacidi in batteri e piante L’insieme delle vie biosintetiche degli amminoacidi = precursori dalla glicolisi * = precursori dal ciclo dell’acido citrico = precursori dalla via del pentosio fosfato * * * * * = amminoacidi essenziali * * * *
Scaricare