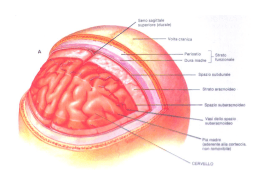
CAPITOLO 14 INTRODUZIONE Numerose condizioni patologiche possono manifestarsi con sintomatologia neurologica: alcune sono associate a disordini del sistema nervoso centrale (SNC) o periferico, altre a patologie sistemiche o metaboliche. In questi casi l’approccio diagnostico deve quindi partire, come sempre, da un accurato esame clinico e strumentale, per il quale si rimanda a testi di neurologia veterinaria, che localizzi la sede del problema. Solo nel caso in cui si escludano patologie a organi o apparati diversi dall’SNC è opportuno prendere in considerazione test di laboratorio specifici per le patologie dell’SNC, rappresentati prevalentemente dall’analisi del liquido cefalorachidiano (LCR o liquor). Alla luce di quanto detto, una descrizione dettagliata degli aspetti anatomici, funzionali e patologici dell’SNC è superflua in questa sede, per cui si rimanda ai testi specifici di neurologia veterinaria. Nella descrizione dell’analisi del liquor verranno solo richiamati alcuni concetti necessari a comprendere il meccanismo per cui in corso di patologie neurologiche possono riscontrarsi determinate alterazioni di laboratorio. © 2010 ELSEVIER srl. Tutti i diritti riservati. APPROCCIO DIAGNOSTICO A PAZIENTI CON SINTOMATOLOGIA NEUROLOGICA Come sopra accennato, prima di focalizzare l’attenzione sull’SNC è necessario escludere ogni altra patologia sistemica/ metabolica in grado di determinare ripercussioni neurologiche. La visita clinica e neurologica è in questo caso fondamentale, così come un approccio di laboratorio che verifichi, secondo i criteri descritti nei rispettivi capitoli, la presenza/ assenza di alterazioni quali: • Insufficienza epatica (encefalopatia epatica). • Sindrome uremica. • Ipoglicemia. • Endocrinopatie quali diabete (in particolare le forme chetoacidosiche e iperosmolari), ipotiroidismo, iperadrenocorticismo. • Alterazioni a carico di calcio, fosforo ed elettroliti. • Anemia/disidratazione/eritrocitosi. • Sindrome da iperviscosità (eritrocitosi o iperproteinemie marcate). Non va poi dimenticato che in alcuni casi l’SNC può risentire di fenomeni tossici anche in assenza di lesioni anatomiche (per esempio, antiparassitari, anticolinesterasici ecc.) In tali C0070.indd 195 casi è probabile che i vari test di laboratorio possano non presentare alterazioni significative. In tal caso il sospetto di intossicazione neurologica deve essere formulato per esclusione di tutte le potenziali cause neurologiche o extraneurologiche di malattia o mediante approcci diversi da quello clinico-patologico. APPROCCIO DIAGNOSTICO A PATOLOGIE A LOCALIZZAZIONE NEUROLOGICA PRIMARIA Una volta escluso che gli eventuali sintomi neurologici possano dipendere da patologie esterne all’SNC, lo studio delle patologie neurologiche negli animali domestici prevede un’approfondita visita neurologica condotta da un medico veterinario specializzato che spesso si avvale dell’ausilio di tecniche di diagnostica per immagini (radiografia, risonanza magnetica, tomografia computerizzata) e analisi di laboratorio, le quali, da sole, non devono sostituire l’approccio clinico-strumentale, ma forniscono informazioni complementari. Le analisi più richieste al laboratorio dal clinico che sospetti una patologia neurologica riguardano l’esame dell’LCR, spesso prelevato in sede chirurgica o durante l’esecuzione di esami mielografici, TC o RM). Tuttavia esistono altri marker biochimici e microbiologici la cui determinazione nel siero o nel liquor stesso può fornire importanti informazioni cliniche. 1 14. APPROCCIO CLINICO-PATOLOGICO ALLE PATOLOGIE DEL SISTEMA NERVOSO CENTRALE Approccio clinico-patologico alle patologie del sistema nervoso centrale CENNI DI ANATOMIA E FISIOLOGIA DEL LIQUIDO CEFALO-RACHIDIANO L’LCR è un liquido protettivo normalmente presente lungo l’intera estensione del sistema nervoso centrale. Circonda pertanto sia le strutture contenute nella scatola cranica, sia il midollo spinale racchiuso nella colonna vertebrale. L’LCR si forma attraverso un processo di dialisi del plasma a opera delle cellule ependimali dei plessi corioidei dei sistemi ventricolari encefalici, e si raccoglie nello spazio subaracnoideo, tra pia madre e aracnoide. Dopo essere circolato attraverso i ventricoli cerebrali fluisce attraverso la cisterna magna, circolando in direzione cranio-caudale, fino ad avvolgere l’intero midollo spinale per poi tornare a circondare gli emisferi cerebrali. Infine viene riassorbito dai villi aracnoidali 6/14/10 3:12:57 PM 196 • Parte 1 • Fisiopatologia e interpretazione dei test di laboratorio Seni durali (riassorbimento) Spazio subaracnoideo 14. APPROCCIO CLINICO-PATOLOGICO ALLE PATOLOGIE DEL SISTEMA NERVOSO CENTRALE 1 C0070.indd 196 Encefalo Ventricoli Plessi corioidei Cisterna magna Midollo spinale FIGURA 14.1 Scheda della localizzazione, produzione e distribuzione del liquido cefalorachidiano. dei seni venosi e delle vene cerebrali (Figura 14.1). La sua funzione è quella di mantenere “sospese” le strutture nervose, evitando possibili traumatismi con le adiacenti strutture ossee, di contribuire alla perfusione e alla nutrizione dei tessuti nervosi, concorrendo inoltre al mantenimento di una costante pressione intracranica. Il volume di LCR e del sangue presenti all’interno delle strutture ossee che circondano l’SNC può essere regolato per mantenerne costanti volume e pressione endocranica, in modo da non danneggiare le strutture nervose. Per questo motivo, solitamente il volume del sangue e dell’LCR variano in modo inversamente proporzionale. Se, per esempio, a causa di variazioni della funzione respiratoria o cardiaca, aumenta la pressione nei vasi sanguigni intracranici, diminuirà la pressione dell’LCR e viceversa. Anche in condizioni patologiche come idrocefalo o edemi cerebrali la situazione viene compensata mediante un abbassamento della pressione dell’LCR che può anche essere “spostato” nelle diverse cavità cerebrali oppure riassorbito maggiormente. Prelievo del liquor L’LCR andrebbe prelevato ogni volta che viene sospettata una patologia a carico di encefalo e/o midollo spinale, di qualsiasi origine (infiammatoria, degenerativa, neoplastica, traumatica). • Sedi e tecniche di prelievo: il liquor può essere prelevato dalla cisterna magna, alla base del cranio, in prossimità della giunzione atlanto-occipitale, oppure a livello della colonna lombare, nello spazio subaracnoideo, tra L5-L6 o L6-L7 (nel gatto). In linea generale, il liquor andrebbe prelevato a valle rispetto alla sede sospettata di lesione e quindi dalla cisterna magna in caso di sospetta lesione intracranica e a livello lombare se si sospetta un problema a carico del midollo spinale. Il prelievo si effettua in anestesia generale con l’animale in decubito laterale, dopo aver preparato chirurgicamente la zona di cute corrispondente ai punti di repere. Per il prelievo dalla cisterna magna, il cranio viene flesso di 90° rispetto al collo e la testa posizionata in modo che il suo asse longitudinale risulti parallelo al tavolo, con la nuca in prossimità del bordo del tavolo in modo da poter agevolmente accedere alla sede di prelievo. I punti di repere per il prelievo dalla cisterna magna sono il margine craniale delle ali dell’atlante e la protuberanza occipitale. Per quanto riguarda il prelievo dell’LCR dalla sede lombare, di più difficile esecuzione rispetto al prelievo cervicale, l’animale in decubito laterale viene posizionato in modo da flettere leggermente il dorso per aprire gli spazi tra L5-L6 e L6-L7. I punti di repere sono rappresentati in questo caso dall’ala dell’ileo e dai processi spinosi di L6 o L7. Per il prelievo si utilizzano aghi spinali con mandrino, del calibro di 20-22 Gauge e di lunghezza variabile in funzione della taglia dell’animale. Una volta inserito l’ago nella sede corretta, il mandrino viene retratto per permettere la fuoriuscita del liquido che va poi raccolto in provette prive di anticoagulante, scartando le prime gocce per evitare una possibile contaminazione ematica. Nel caso in cui si preveda di eseguire sia analisi citologiche sia batteriologiche, il liquido va raccolto in due provette separate, di cui una sterile. Per evitare rischi per l’animale, non bisognerebbe prelevare più di 1 mL di liquor ogni 5 kg di peso dell’animale (poche gocce in cuccioli e gattini), con una velocità di deflusso del liquido non superiore a 1 mL ogni 30 secondi. Per informazioni tecniche più dettagliate riguardo l’esecuzione del prelievo, si rimanda a testi specifici di neurologia veterinaria. Il prelievo di LCR è sconsigliato nelle situazioni di accertato aumento della pressione endocranica (edemi, idrocefalo, neoformazioni occupanti spazio, traumi) in quanto associato a rischio di ernia cerebrale. ANALISI DEL LIQUIDO CEFALORACHIDIANO L’analisi dell’LCR permette di ottenere diverse informazioni utili dal punto di vista diagnostico e patogenetico nello studio delle patologie dell’SNC nel cane e nel gatto. La collaborazione tra il clinico che esegue il prelievo e il patologo-clinico che analizza il campione deve essere molto stretta, in modo che entrambi possano ottenere il maggior numero di informazioni diagnostiche, prognostiche e terapeutiche. Se, per esempio, 6/14/10 3:12:57 PM durante l’analisi del liquor si rileva la presenza di eritrociti, è indispensabile sapere se il sangue deriva da una contaminazione verificatasi durante il prelievo o se si tratta realmente di una maggiore permeabilità della barriera emato-encefalica che ha permesso il passaggio di elementi cellulari dai vasi o di una rottura vasale pregressa. Dal momento, inoltre, che si tratta di un fluido biologico per il quale è difficile prelevare grosse quantità di materiale e soprattutto poter ripetere il campionamento, è consigliabile eseguire le analisi entro 1-2 ore, in modo da prevenire possibili alterazioni soprattutto a carico della componente cellulare. Alcuni autori suggeriscono l’utilizzo di additivi proteici (albumina, plasma autologo, plasma expander) per la stabilizzazione delle cellule dell’LCR se questo non viene processato immediatamente dopo il prelievo: tuttavia la loro reale efficacia è tuttora dubbia, soprattutto per conservazioni prolungate. Caratteristiche del liquor normale Il liquido cefalorachidiano in condizioni normali si presenta come un liquido trasparente e incolore. Contiene basse concentrazioni di ioni e molecole presenti anche nel plasma. Il suo peso specifico è molto simile a quello dell’acqua distillata (1004-1006) ed è caratterizzato dalla quasi totale assenza di cellule. La composizione normale dell’LCR di solito comprende: • Proteine: la concentrazione di proteine nel liquor è molto bassa, con una lieve differenza tra liquido prelevato dalla cisterna magna (nel cane e nel gatto solitamente < 2030 mg/dL) rispetto a quello prelevato dalla zona lombare (< 35-45 mg/dL). Le proteine presenti sono rappresentate principalmente da albumina e in misura minore dalle diverse classi di globuline. L’albumina non è prodotta all’interno dell’SNC ma proviene interamente dal sangue, per cui si può valutare il rapporto tra la sua concentrazione nell’LCR e quella plasmatica, denominata albumin quotient (AQ). Da questo valore si può poi risalire, per sottrazione, al contenuto di immunoglobuline nel liquor (IgG index). Dal momento che la concentrazione proteica è molto bassa, i metodi descritti nel Capitolo 4 dedicato alle proteine plasmatiche per la determinazione delle proteine nel sangue non sono sufficientemente sensibili per identificare concentrazioni così basse. Per questo motivo per misurare le proteine dell’LCR solitamente vengono usati gli stessi reagenti utilizzati per le proteine urinarie (rosso di pirogallolo per la determinazione quantitativa o le strisce reattive urinarie per una determinazione semiquantitavia) o metodi di precipitazione con reattivo di Pandy a base fenolica, che rileva le globuline più che le albumine. • Glucosio: il glucosio presente nell’LCR (denominato con il termine glicorrachia) proviene per diffusione dal sangue, quindi la sua concentrazione è proporzionale a quella rilevata nel sangue stesso. Generalmente la quantità di glucosio nell’LCR è circa l’80% di quella ematica. • Enzimi: nel liquor è possibile misurare l’attività di alcuni enzimi che possono essere di provenienza ematica o C0070.indd 197 Parte 1 • 197 essere prodotti da cellule interne al liquor stesso, così come originare dal tessuto nervoso. Si tratta principalmente della creatinchinasi (CK), dell’aspartato transaminasi (AST) e della lattato deidrogenasi (LDH). La CK è una proteina composta da due subunità, B (dall’inglese brain ) e M ( muscle ) che combinandosi diversamente danno origine a tre isoenzimi: CK-BB, CK-MM e CK-MB, espressi in modo specifico in diversi tessuti. Il tessuto nervoso produce prevalentemente l’isoenzima CK-BB (peraltro prodotto in minima quantità anche nei tessuti periferici), nel muscolo scheletrico predomina CK-MM, mentre il tessuto muscolare cardiaco esprime sia CK-MM sia CK-MB. Dal momento che la maggior parte di questi enzimi non è prodotta dalle cellule sospese nel liquor, un aumento della loro attività nell’LCR riflette o una maggiore permeabilità all’enzima prodotto dalle cellule di provenienza ematica (per danno alla barriera emato-encefalica), oppure un rilascio di enzima da cellule danneggiate dei tessuti nervosi circostanti. • Cellule: in un liquor non patologico le cellule dovrebbero essere virtualmente assenti, per quanto riguarda sia gli eritrociti sia le cellule nucleate. Tuttavia, anche in campioni patologici il numero di cellule non è quasi mai abbastanza elevato da permettere la conta cellulare mediante contaglobuli automatici. Questi ultimi, infatti, di solito sono caratterizzati da una sensibilità analitica non sufficiente a identificare in modo accurato un numero di cellule nucleate inferiore alle 100/μL a meno che non si usino dei software specifici. Per questi motivi solitamente, per ottenere la conta cellulare sia di eritrociti sia di elementi nucleati, bisogna ricorrere agli emocitometri manuali (per esempio, camera di Bürker, di Neubauer o di Fuchs-Rosenthal). Anche se questi strumenti permettono di contare anche un numero ridotto di cellule, la loro precisione e accuratezza rimane comunque piuttosto scarsa. Solitamente per la conta cellulare si utilizza del liquor non diluito, in modo da non abbassare ulteriormente il numero di cellule, premurandosi di risospendere bene il campione prima di riempire gli emocitometri e di attendere almeno una decina di minuti prima di contare le cellule, in modo da consentire loro di sedimentare bene nella camera. È necessario quindi contare tutte le cellule (separatamente eritrociti e cellule nucleate) all’interno dei 9 quadrati grandi presenti in ogni camera (Figura 14.2) ed eseguire un semplice calcolo per ottenere il numero totale di cellule per microlitro: 1 14. APPROCCIO CLINICO-PATOLOGICO ALLE PATOLOGIE DEL SISTEMA NERVOSO CENTRALE Fisiopatologia e interpretazione dei test di laboratorio • Numero di cellule contate × 10/9 = cellule/μL • In teoria la visualizzazione delle cellule nucleate può essere facilitata aggiungendo un colorante vitale (per esempio, 1 parte di colorante + 9 di liquor), moltiplicando poi il numero di cellule contate in base al fattore di diluizione. In pratica, però, in campioni poco cellulari tale procedura rischia di abbassare ulteriormente il numero di cellule. Generalmente il numero di cellule presenti in un liquor 6/14/10 3:12:58 PM 198 • Parte 1 • Fisiopatologia e interpretazione dei test di laboratorio e dipende strettamente dalla sua concentrazione nel plasma. Il potassio si trova in concentrazioni molto inferiori rispetto al plasma (< 3 mmol/L) e la sua presenza deve essere rigidamente regolata in quanto si tratta di uno ione fondamentale per la trasmissibilità dell’impulso nervoso. Anche la presenza di cloro, calcio e magnesio, importanti per la conduzione elettrica, è indipendente dalla loro concentrazione plasmatica. 14. APPROCCIO CLINICO-PATOLOGICO ALLE PATOLOGIE DEL SISTEMA NERVOSO CENTRALE 1 C0070.indd 198 Caratteristiche del liquor patologico In molti casi, pur in presenza di patologie neurologiche in atto, l’LCR non presenta aspetti anomali (per esempio, epilessia, intossicazioni, disturbi metabolici, patologie vertebrali ecc.). Al contrario, alcuni aspetti macro- e microscopici, nonché biochimici, sono spesso molto indicativi di patologia dell’SNC. In corso di patologia l’analisi del liquor deve tener presente una serie di aspetti differenti, come riassunto, a fine capitolo, nella Tabella 14.1. FIGURA 14.2 Griglia di emocitometro per la conta manuale di cellule dell’LCR. Le cellule vanno contate in tutti i 9 quadrati grandi (delimitati nella figura dalle linee verdi). Questa area corrisponde a un volume di 0,9 μL, per cui il numero totale di cellule contato va moltiplicato per 1,1 per ottenere il numero esatto di cellule/μL. lombare è leggermente più basso di quello del liquido prelevato dalla cisterna magna. La cellularità di un LCR non patologico prevede la presenza di un numero limitato di cellule nucleate (< 8/μL, ma solitamente < 2-3/μL) composte da piccoli linfociti e cellule mononucleate di dimensioni maggiori (linfociti attivati, monociti-macrofagi, cellule istiocitoidi) in assenza di granulociti. Occasionalmente è possibile riscontrare cellule ependimali e dei plessi corioidei che sono mononucleate, tonde o cuboidali, e caratterizzate da moderata coesività. In caso di rottura delle strutture ossee circostanti o di penetrazione con l’ago nella vertebra è anche possibile che l’LCR venga contaminato da cellule normalmente presenti nel midollo osseo (precursori emopoietici) o normali costituenti del tessuto osseo (osteoblasti e osteoclasti). Gli aspetti morfologici di linfociti, granulociti e monociti presenti nell’LCR sono invece sovrapponibili a quelli delle cellule circolanti, anche se spesso gli elementi mononucleati di volume maggiore assumono caratteristiche che li accomunano ai macrofagi/istiociti, condividendone la stessa funzione macrofagica. La presenza di un aumentato numero di altri tipi cellulari è invece solitamente indice di contaminazione ematica (eritrociti, neutrofili, eosinofili) o di patologia (cellule infiammatorie o neoplastiche). • Ioni: la presenza di ioni all’interno dell’LCR è molto importante per il mantenimento della pressione osmotica e per la conduzione degli stimoli nervosi. In particolare nell’LCR sono normalmente presenti sodio, potassio, cloro, calcio e magnesio. La concentrazione di sodio è la più elevata Aspetto macroscopico Fermo restando che l’assenza di alterazioni macroscopiche non permette di escludere a priori la presenza di alterazioni citologiche o biochimiche, un’alterazione del colore e della trasparenza del liquor riflette spesso la presenza di disturbi a livello di SNC. Le principali alterazioni potenzialmente rilevabili sono: • Liquido torbido o opaco: è spesso il risultato della presenza di un numero elevato di cellule nucleate (> 500/μL), indicando quindi la possibile presenza di processi infiammatori, infettivi o neoplastici. • Colorazione rosata più o meno intensa: deve far pensare alla presenza di sangue; se dopo centrifugazione del campione gli eritrociti precipitano sul fondo della provetta, mentre il surnatante appare trasparente, è probabile che si tratti di una contaminazione ematica da prelievo o di un’emorragia molto recente (qualche ora) a livello di spazio subaracnoideo. • Colorazione giallo-arancione omogenea (denominata xantocromia): è solitamente dovuta a emorragie avvenute da un tempo maggiore (un giorno). Tale colorazione può essere visibile anche nel surnatante ottenuto dopo centrifugazione del liquor, e dipende dalla degradazione degli eritrociti e dalla presenza di emoglobina (o metaemoglobina) e bilirubina. La stessa alterazione cromatica si può osservare anche in corso di patologie infiammatorie e neoplastiche o in presenza di elevate concentrazioni di proteine. • Colorazione grigio-verdastra: può essere riscontrabile in corso di patologie infiammatorie, soprattutto se a eziologia batterica. Cellularità Il numero di cellule presenti nell’LCR è, come abbiamo descritto, molto basso in campioni normali, ma può esserlo anche in campioni patologici. In caso di aumento delle cellule nucleate nel liquor si parla di pleocitosi che, in base alla tipologia di cellule responsabili dell’aumento, verrà 6/14/10 3:12:58 PM denominata pleocitosi neutrofilica, eosinofilica, linfo-monocitica o mista (vedi oltre). Nell’eventualità in cui si riscontri la presenza di sangue di sospetta origine iatrogena, bisognerebbe riconsiderare la presenza di cellule (sia nucleate sia non) sulla base dell’entità della contaminazione stessa. Alcuni autori suggeriscono delle “formule” di correzione (sottrarre 1 cellula nucleata/μL ogni 500 eritrociti/μL) che però, per loro stessa ammissione, non si rivelano sempre molto attendibili, tanto da consigliare la ripetizione del prelievo in caso di contaminazione ematica massiva. Morfologia delle cellule presenti Per valutare la morfologia delle cellule eventualmente presenti in un LCR, è necessario allestire dei preparati citologici in modo appropriato, come descritto in seguito. Per facilitare l’esame citologico le cellule possono essere concentrate, in modo da poterne valutare al microscopio un numero consistente, e da conservarne le caratteristiche morfologiche. Questo evita di ricorrere a un secondo prelievo, che per questo tipo di materiale biologico è opportuno evitare. La difficoltà nell’ottenere buoni preparati citologici di LCR, oltre alla bassa cellularità, risiede anche nelle caratteristiche chimiche del liquido, che essendo povero di proteine rispetto ad altri fluidi biologici, non garantisce una buona resistenza delle cellule agli agenti fisico-chimici. Per tale motivo l’LCR deve essere processato nel più breve tempo possibile dal prelievo, evitando la conservazione per più di qualche ora (anche in frigorifero). È possibile migliorare la conservabilità delle cellule dell’LCR aggiungendo del plasma del paziente al campione di LCR (vedi sopra). Tecniche per l’allestimento di preparati citologici • Centrifugazione: si centrifuga la provetta contenente il liquor e si striscia il sedimento. In questo modo si ottiene solitamente un buon recupero cellulare a scapito però della morfologia delle cellule, che subendo dei traumi meccanici, per le loro caratteristiche di particolare fragilità, spesso si rompono e non sono più riconoscibili. Questo metodo è quindi sconsigliabile nella pratica. • Sedimentazione: questo tipo di tecnica prevede l’utilizzo di particolare “camere” che si possono trovare in commercio (camera di Sayk) o che possono anche essere allestite in maniera più “artigianale”. Tutte, però, sfruttano lo stesso principio per cui la parte liquida del campione viene assorbita da carta assorbente, mentre le cellule precipitano (o appunto sedimentano) sul vetrino. Si tratta di una metodica che prevede un maggior dispendio di tempo, in quanto l’assorbimento del liquido deve essere lento per impedire che anche le cellule rimangano intrappolate nella carta assorbente, ma che permette una migliore conservazione delle cellule stesse che mantengono integrità e mostrano caratteristiche morfologiche superiori rispetto ai campioni ottenuti per centrifugazione. Lo svantaggio è che il recupero delle cellule può non essere ottimale (in particolare per i linfociti). Alcuni autori suggeriscono di inumidire con C0070.indd 199 Parte 1 • 199 soluzione fisiologica la carta assorbente prima di caricare il campione per evitare un’eccessiva perdita cellulare. • Citocentrifugazione: prevede la centrifugazione di particolari camere di sedimentazione adattate per essere inserite in centrifughe particolari e/o dotate di rotori adatti ad accogliere tali camere (vedi Capitolo 15). Dal punto di vista del campione che si ottiene con tale metodica, il risultato è intermedio tra le tecniche citate in precedenza: citocentrifugando il liquor a basse velocità (200-500 rpm) si ottiene un recupero cellulare superiore a quello per sedimentazione e le cellule mantengono buone caratteristiche morfologiche. Inoltre il tempo impiegato per la centrifugazione varia tra 3 e 10 minuti, sicuramente inferiore al tempo necessario per ottenere un buon campione per sedimentazione. • Un ulteriore metodo prevede l’utilizzo di membrane filtranti con pori delle dimensioni adatte a filtrare il liquido ma non le cellule che rimangono quindi concentrate sul filtro. Si tratta tuttavia di una metodica poco usata in medicina veterinaria. In qualsiasi modo sia stato preparato il vetrino per la valutazione morfologica di cellule concentrate, questo deve essere successivamente colorato. Di norma si utilizzano colorazioni di tipo Romanowsky (May Grünwald-Giemsa, Wright-Giemsa, colorazione rapide). Principali quadri citologici patologici Di seguito verranno descritti alcuni dei quadri più frequentemente riscontrabili nel cane e nel gatto. Nella Figura 16, Tavole a colori sono riportati alcuni esempi di aspetti citologici. Ulteriori informazioni e immagini sui dettagli citologici sono reperibili su testi di citologia o neurologia. • Liquor emorragico: è stato già detto in precedenza che la presenza di sangue nel liquor deve essere interpretata in modo cauto, in quanto può essere semplicemente l’esito di una contaminazione da prelievo. Per distinguere se la presenza di sangue nell’LCR è sintomo di un’emorragia subaracnoidea o semplice contaminazione, oltre a utilizzare gli accorgimenti descritti in precedenza in sede di prelievo, bisogna osservare se il sangue è presente nella stessa quantità in tutto il volume di liquido prelevato o se è in quantità maggiori nelle prime gocce prelevate: in quest’ultimo caso è più probabile che si tratti di contaminazione. Se nel campione sono presenti coaguli o piastrine è certo che si tratta di sangue contaminante. Il rilievo di eritrofagocitosi non è sempre indice di pregressa emorragia, ma se si riscontrano macrofagi contenenti emosiderina (siderofagi) signifi ca che il sangue è presente nel liquor da almeno 12-24 ore e quindi è un indice certo di emorragia locale pregressa. • Pleocitosi neutrofiliche: come detto in precedenza, con il termine generico di pleocitosi si intende l’aumento nell’LCR di una certa classe di cellule nucleate. In particolare il rilievo di un numero elevato di granulociti neutrofili (più del 25% del totale delle cellule nucleate) è solitamente indice della presenza di un processo infiammatorio spesso 1 14. APPROCCIO CLINICO-PATOLOGICO ALLE PATOLOGIE DEL SISTEMA NERVOSO CENTRALE Fisiopatologia e interpretazione dei test di laboratorio • 6/14/10 3:12:58 PM 200 14. APPROCCIO CLINICO-PATOLOGICO ALLE PATOLOGIE DEL SISTEMA NERVOSO CENTRALE 1 • Parte 1 • Fisiopatologia e interpretazione dei test di laboratorio di origine infettiva (batterica, virale, fungina o protozoaria). Non è raro, tuttavia, il riscontro di tale alterazione in conseguenza a traumi, o all’utilizzo dei mezzi di contrasto usati per le mielografie e a neoplasie con associata necrosi. Le principali patologie che inducono quadri infiammatori neutrofilici sono: Meningiti/meningoencefaliti batteriche: solitamente una netta predominanza di neutrofili, in presenza di conte cellulari elevate (anche superiori alle 1000 cellule/μL) e segni di degenerazione cellulare (cariolisi, carioressi) è indicativa di flogosi batterica, anche se non si osservano i microrganismi responsabili. In corso di terapia, se l’animale tende a rispondere a tali trattamenti, i neutrofili vengono gradualmente sostituiti da monociti-macrofagi e linfociti. Per la conferma diagnostica e un migliore inquadramento eziologico, sono necessarie indagini colturali microbiologiche (vedi Capitolo 17). Meningiti-encenfaliti (arteriti) responsive agli steroidi: si tratta probabilmente di una delle cause più frequenti di pleocitosi neutrofilica nel cane. Solitamente colpisce animali giovani e di media-grossa taglia. La patogenesi non è chiara, anche se sembrano coinvolti meccanismi immuno-mediati o infettivi. In questo caso i neutrofili presenti nell’LCR, pur se in numero elevato non mostrano segni di degenerazione. Si può inoltre osservare un numero minore di cellule mononucleate. In seguito a somministrazione di corticosteroidi il ripristino delle condizioni normali è tuttavia piuttosto rapido. Infezioni virali: nel corso di infezioni virali quali il cimurro canino nella sua forma acuta o la peritonite infettiva felina nei gatti (FIP), se c’è interessamento meningoencefalico è comune il riscontro di pleocitosi neutrofiliche (conte cellulari spesso superiori alle 500 cellule/μL). In questi casi i neutrofili presenti nell’LCR non presentano solitamente fenomeni degenerativi e, nel caso della FIP, in cui possono inoltre essere presenti numerosi macrofagi, il riscontro di un elevato contenuto proteico è di aiuto nel confermare la diagnosi. In ogni caso, per la diagnosi di tali infezioni virali è opportuno seguire l’approccio diagnostico descritto nel Capitolo 17. Pleocitosi linfocitiche/mononucleari Possono essere riscontrate in corso di: • Infezioni virali: anche in questo caso una delle cause principali è da ricercarsi nelle infezioni virali, soprattutto nelle fasi croniche. Ancora una volta, l’infezione da cimurro può determinare quadri di pleocitosi (conte cellulari > 50 cellule/μL) linfocitica, talvolta in presenza di corpi inclusi intracitoplasmatici patognomonici. • Meningo-encefalite granulomatosa (GME): si tratta di una condizione, di cui ancora si ignora l’eziologia, che colpisce più frequentemente cani giovani e adulti di piccola-media taglia (razze toy e terrier). Solitamente accanto ai linfociti è possibile riscontrare un numero elevato di cellule mo- C0070.indd 200 nonucleate di dimensioni maggiori (monociti-macrofagi) e talvolta anche neutrofili. • Encefalite necrotizzante dei cani di piccola taglia: è una condizione descritta in cani giovani di razze di piccola taglia (Carlino, Maltese, Yorkshire terrier). l’LCR è caratterizzato da pleocitosi (> 200 cellule/μL) a netta prevalenza di linfociti e monociti/macrofagi. • Altre condizioni meno comuni: in corso di poliencefalomieliti feline, infezioni da toxoplasma o ehrlichia nel cane, in caso di interessamento dell’SNC, è frequente riscontrare pleocitosi mononucleari. In caso di ehrlichiosi per esempio possono essere riscontrati linfociti LGL. Pleocitosi eosinofiliche Questo tipo di alterazione è di riscontro infrequente e spesso le cause sono le stesse che determinano pleocitosi neutrofilica (infezioni batteriche, fungine, protozoarie, prototecosi). Pleocitosi eosinofiliche sono state inoltre riportate in corso di migrazioni parassitarie aberranti. Ci sono inoltre dei casi di meningite responsiva agli steroidi (vedi sopra) in cui prevalgono gli eosinofili anziché i neutrofili. In corso di neoplasie linfoidi, come anche accade in altre sedi dell’organismo, è possibile riscontrare un elevato numero di eosinofili. È stata infine segnalata nei cani di razza Golden retriever e Rottweiler una forma di meningoencefalite eosinofilica, a eziologia ignota, che si riflette in una pleocitosi (> 500 cellule/μL) a netta predominanza di eosinofili. Pleocitosi miste Si tratta di quelle condizioni in cui il liquor presenta un elevato numero di cellule, ma non vi è la netta prevalenza di un tipo cellulare in particolare, al contrario, possono essere presenti contemporaneamente linfociti, monociti-macrofagi, neutrofili, eosinofili e plasmacellule. In realtà, rappresenta la forma di pleocitosi più comune che si può verificare come risposta aspecifica in corso di patologie infiammatorie di diversa natura (infettive e infestive, traumatiche, degenerative e neoplastiche). Liquor neoplastici Innanzitutto bisogna specificare che in corso di neoplasie localizzate a livello dell’SNC, molto raramente esfoliano cellule neoplastiche all’interno del liquor, pertanto si può affermare che l’analisi citologica del liquor, quando vi sia il sospetto diagnostico di neoplasia, ha una sensibilità molto bassa. Tuttavia, è possibile riscontrare cellule neoplastiche in corso di linfoma localizzato alle meningi, durante il quale è frequente identificare cellule linfoidi anomale, soprattutto se il linfoma è di tipo linfoblastico. In questo caso, infatti, le cellule linfoidi immature hanno caratteristiche citologiche e atipie che permettono di differenziarle da quelle normalmente presenti nell’LCR e da quelle che si possono riscontrare in corso di pleocitosi linfocitica infiammatoria. Al contrario, se il processo neoplastico è a carico dei linfociti maturi, sarà molto più difficile distinguere nel liquor i linfociti neoplastici dai normali residenti o dai linfociti reattivi. In questi casi è consigliabile eseguire ulteriori indagini diagnostiche. Anche 6/14/10 3:12:58 PM se si tratta di una situazione poco frequente, è possibile riscontrare nell’LCR anche cellule di tumori metastatici (per esempio, carcinomi, melanomi) o primari dei plessi coriodei (per esempio, carcinoma corioideo). Analisi biochimiche Per quanto riguarda le analisi biochimi- che che si possono eseguire sull’LCR, la determinazione della concentrazione di proteine è sicuramente uno dei parametri più importanti da valutare. Oltre a misurarne la concentrazione è possibile anche eseguire delle analisi elettroforetiche (per conoscere la classe proteica responsabile dell’aumento) utilizzando delle metodiche ad alta sensibilità, anche se i risultati sono di utilità clinica dubbia. Un aumento della concentrazione proteica è da mettere in relazione alla presenza di processi patologici a eziologia infiammatoria ma anche degenerativa o neoplastica. In questi casi si può osservare un concomitante aumento delle cellule nucleate (pleocitosi, vedi sopra). Talvolta si può invece riscontrare un incremento proteico in assenza di alterazioni quali-quantitative delle cellule. In questo caso si parla di dissociazione albumino-citologica che si può osservare in presenza di alterazioni dell’integrità della barriera emato-encefalica dovute a patologie compressive sia intra- sia extradurali (patologie discali, neoplasie, lesioni vertebrali ecc.), traumi, patologie degenerative e poliradicoloneuriti. Anche la valutazione della glicorrachia può essere utile in quanto se il glucosio presente nel liquor è di molto inferiore a quello sierico (< 60%) può indicare la presenza di meningiti batteriche, dal momento che il glucosio viene consumato sia dalle cellule infiammatorie sia dai microrganismi stessi per il loro metabolismo. Se invece, al contrario, la concentrazione del glucosio nell’LCR si avvicina troppo a quella del sangue (> 80%) può indicare una maggiore permeabilità o una soluzione di continuo della barriera ematoencefalica (di entità ridotta, per cui le cellule non riescono ancora a oltrepassarla). Infine, come abbiamo già descritto in precedenza, nel liquor possono essere presenti degli enzimi tra cui il più importante è sicuramente la creatinchinasi (CK): l’aumento dell’attività dell’isoenzima CK-BB, che è prodotto dal tessuto nervoso, può essere correlato a un problema locale (per esempio, degenerazione mielinica). Se l’isoenzima presente è invece C0070.indd 201 Parte 1 • 201 quello muscolare, la causa è da attribuire a una maggiore permeabilità (o danno) della barriera ematoencefalica. Per valutare l’aumento di singoli isoenzimi della CK sia nel siero sia nell’LCR occorre però eseguire una elettroforesi particolare che separa in bande differenti i diversi isoenzimi, in modo da poter identificare quello responsabile dell’aumento. Tuttavia gli studi in medicina veterinaria riguardo l’utilizzo di tale tecnica sono ancora insufficienti per valutare la reale utilità di tale analisi. ANALISI BIOCHIMICHE, SIEROLOGICHE E BATTERIOLOGICHE Oltre alle analisi dell’LCR di cui abbiamo parlato finora, esistono altre indagini che è possibile eseguire per meglio inquadrare un problema neurologico. Se, per esempio, sorge il sospetto che le alterazioni neurologiche riscontrate possano essere associate ad agenti infettivi, sarà opportuno eseguire indagini microbiologiche e sierologiche appropriate, sia sul siero sia nel liquor stesso, in modo da poter mettere in relazione la positività sierologica/microbiologica alla presenza delle lesioni, tenendo presente i limiti legati alla ricerca di anticorpi sia su siero sia nell’LCR descritti nel Capitolo 17. In caso di patologie sistemiche caratterizzate anche da lesioni neurologiche, come spesso accade in corso di malattie infettive o in alcune patologie metaboliche, il quadro clinicopatologico va completato ricercando le alterazioni ematologiche e biochimiche tipiche della malattia in esame. Infine, un’indicazione generica della presenza di lesioni all’SNC può essere desunta ancora una volta dall’analisi dell’attività sierica della CK. Tale riscontro è però abbastanza aspecifico perché l’isoenzima maggiormente responsabile dell’attività della CK totale nel siero è quello muscolare. Nel siero, l’isoenzima CK-BB è poco rappresentato e, anche nel caso aumenti di molto, raramente altera l’attività della CK totale. Sebbene le esperienze in questo senso siano del tutto preliminari, sembra però che nel cane l’aumento dell’isoenzima CK-BB, identificabile mediante separazione elettroforetica, possa permettere di identificare lesioni neurologiche caratterizzate da citolisi e da rottura della barriera emato-encefalica anche se l’entità dell’aumento di tale isoenzima non sembra correlata con l’estensione e la gravità delle lesioni neurologiche. 1 14. APPROCCIO CLINICO-PATOLOGICO ALLE PATOLOGIE DEL SISTEMA NERVOSO CENTRALE Fisiopatologia e interpretazione dei test di laboratorio • 6/14/10 3:12:58 PM 202 • Parte 1 • Fisiopatologia e interpretazione dei test di laboratorio Tabella 14.1 14. APPROCCIO CLINICO-PATOLOGICO ALLE PATOLOGIE DEL SISTEMA NERVOSO CENTRALE 1 Principali alterazioni biochimiche e citologiche del liquido cefalo-rachidiano associate a particolari condizioni patologiche Alterazione del liquor Conta cellulare Cellule predominanti Concentrazione proteine Approccio diagnostico Meningoencefaliti batteriche Marcatamente elevata, anche > 1000 cellule/μL Pleocitosi neutrofilica (>75%) con o senza segni di degenerazione Elevata, spesso > 100 mg/dL Ricerca microscopica batteri Neutrofilia periferica Esami colturali per* Staphylococcus spp., Streptococcus spp., Pasteurella multocida ed Escherichia coli ecc. Meningoencefaliti fungine Moderata-elevata 30-1000 cellule/μL Pleocitosi mista e prevalente neutrofilia (> 50%). Talvolta eosinofilia Moderatamente elevata > 50 mg/dL Ricerca microscopica micromiceti. Esami colturali e sierologici (ricerca antigene) per Cryptococcus neoformans Meningoencefaliti protozoarie Moderata-elevata 50-200 cellule/μL Pleocitosi mista: monociti > linfociti > neutrofili > eosinofili Elevata, spesso > 100 mg/dL Esami sierologici per Toxoplasma gondii e Neospora caninum Cimurro Moderata 50-100 cellule/μL Pleocitosi neutrofilica nella fase acuta, linfocitica successivamente Elevata, spesso > 150 mg/dL Ricerca corpi inclusi citoplasmatici nei linfociti dell’LCR e cellule ematiche circolanti. Esami sierologici (IgM, per escludere sieropositività da anticorpi vaccinali). Biologia molecolare Peritonite infettiva felina Marcatamente elevata, anche > 500 cellule/μL Pleocitosi neutrofilica (> 50%) senza segni di degenerazione Marcatamente elevata, spesso > 200 mg/dL Elettroforesi proteine del siero (eventualmente del versamento). Determinazione α1glicoproteina acida. Ricerca di lesioni piogranulomatose Meningoencefalite granulomatosa (razze toy e Terrier) Moderata 30-100 cellule/μL Più spesso pleocitosi linfocitica-monocitica/ macrofagica. Raramente neutrofilica Marcatamente elevata, fino a 500 mg/dL Esami sierologici e colturali negativi. Non risponde sempre a terapia con corticosteroidi Meningoencefalite/arterite responsiva agli steroidi (cani taglia medio-grande) Marcatamente elevata > 500 cellule /μL Pleocitosi neutrofilica (80-100%), neutrofili non degenerati Elevata, solitamente > 100 mg/dL Esami sierologici e colturali negativi. Risponde a terapia con corticosteroidi Meningoencefalite eosinofilica responsiva agli steroidi Marcatamente elevata, anche > 1000 cellule/μL Pleocitosi eosinofilica (80-100%) Elevata, spesso > 100 mg/dL Esami sierologici e colturali negativi. Risponde a terapia con corticosteroidi Predisposti i Golden retriever Encefalite necrotizzante dei cani di piccola taglia Elevata > 200 cellule/μL Pleocitosi linfocitica (80-100%) o mista Elevata, spesso > 300 mg/dL Tipica del Carlino, Maltese, Yorkshire terrier Trauma/compressione Lievemente aumentata > 20 cellule/μL Pleocitosi, neutrofilia (forme Variabile, spesso > acute) o mononucleare 50-100 mg/dL (forme croniche) Possibile presenza di sangue Esame clinico. Tecniche di diagnostica per immagini Neoplasia Da normale a elevata (meningioma) Variabili (pleocitosi linfocitica nel linfoma) Esame clinico. Tecniche di diagnostica per immagini Variabile, fino a 150 mg/dL * = Specie batteriche più frequentemente riscontrate in corso di meningiti suppurative. C0070.indd 202 6/14/10 3:12:58 PM
Scarica