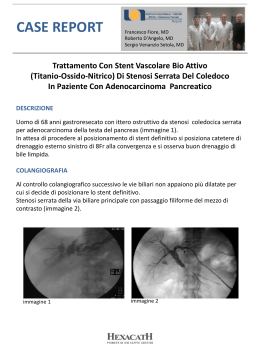
Interventistica Percutanea nei By-Pass Aorto-Coronarici Venosi Luca Favero, Giampaolo Pasquetto, Salvatore Saccà, Carlo Cernetti, Bernhard Reimers Dipartimento di Cardiologia, Mirano (VE) Epidemiologia Il bypass aortocoronarico confezionato con vena safena (Saphenous Vein Graft: SVG) rappresenta una consolidata metodica di rivascolarizzazione miocardica che ha dimostrato di ridurre la sintomatologia anginosa e di prolungare la sopravvivenza (1) . Tuttavia, la suscettibilità del SVG a sviluppare aterosclerosi ostruttiva rende questa metodica una soluzione spesso temporanea(29) e indubbiamente inferiore ai graft confezionati con arteria (10). Dal punto di vista clinico, ischemia ricorrente si verifica nel 3-5% dei pazienti subito dopo l’intervento di SVG(11-13), nel 4-8% annualmente dopo l’intervento (4,6,8) e a 10 anni nel 60 % circa dei casi(14). Nei pazienti ricoverati per angina instabile oltre i 5 anni dall’intervento, nell’85% dei casi il vaso responsabile è il SVG(15). Occlusioni clinicamente silenti si verificano nel 28% a 1-3 anni, nel 31% a 4-6 anni e nel 35% a 7-11 anni dall’intervento(23). Dal punto di vista anatomopatologico, i processi degenerativi dei SVGs si verificano nel 20% già durante il primo anno con una forte componente trombotica. Successivamente l’incidenza annua di degenerazione è del 1-2% per i primi 6 anni e del 5% dal sesto al decimo anno. A 10 anni dall’intervento il 60-70% dei SVGs presenta alterazioni degenerative(3,5,9 -13,16,1722) . Fisiopatologia della degenerazione dei bypass venosi La patologia dei SVGs riconosce tre meccanismi patogenetici principali che presentano un andamento temporale noto. Nel primo mese la malattia del SVG è legata nella maggior parte dei casi a trombosi acuta del condotto venoso. Cause meno frequenti sono le stenosi delle anastomosi o il confezionamento del bypass su un vaso sbagliato. La patologia dei SVGs che compare tra 1 e 12 mesi è per lo più dovuta a stenosi da iperplasia intimale, anche se in questo arco temporale possono essere ancora in gioco le stenosi delle anastomosi(24-25). La malattia dei SVGs oltre il primo anno dall’intervento è invece per lo più legata a stenosi su base aterosclerotica con frequente sovrapposizione trombotica(26-30). Le possibilità di prevenzione della malattia dei SVGs mediante terapia medica appaiono al momento ancora limitate. Le raccomandazioni attuali prevedono l’uso di aspirina (325 mg/die) a tempo indefinito e di statine(31). Recentemente è stato infatti dimostrato che la riduzione del colesterolo LDL sotto i 100 mg/dl mediante terapia aggressiva con statine riduce sia gli eventi clinici avversi che la progressione della malattia dei SVGs (32-33). venti “Redo”) comporta un rischio di infarto periprocedurale che arriva fino al 2-8%(34,35) e di morte del 5-12% (36-40), con una sopravvivenza a 5 anni del 8494%. Il rischio di severo danneggiamento di un già esistente graft arterioso in arteria mammaria è del 5-38% (41-44). Questi risultati riflettono le difficoltà tecniche legate al reintervento e il profilo prognostico sfavorevole dei pazienti. Tre studi(45-47) non randomizzati hanno evidenziato una minor incidenza di infarto miocardio acuto intraospedaliero e una mortalità più bassa nei pazienti sottoposti a rivascolarizzazione percutanea (PCI) rispetto a quelli sottoposti a re-intervento di bypass aortocoronarico. L’incidenza di un’ulteriore rivascolarizzazione della lesione colpevole a 4 anni invece è risultata maggiore dopo PCI che dopo bypass. Per tali ragioni si è ritiene che l’indicazione al reintervento di bypass sussista in presenza delle seguenti condizioni: possibilità di utilizzare un’arteria mammaria interna per la discendente anteriore, necessità di rivascolarizzare più vasi, presenza di malattia diffusa di SVGs più vecchi di 7 anni, impossibilità ad intervenire con angioplastica sui vasi nativi, ridotta funzione ventricolare sinistra (48,49). Terapia interventistica dei SVGs Terapia chirurgica. Il re-intervento di bypass aortocoronarico (cosiddetti inter- La terapia interventistica delle lesioni dei SVGs rimane a tutt’oggi una sfida nel laboratorio 9 Interventistica per cutanea nei by-pass aorto-coronarici venosi L. Favero,G. Pasquetto, S. Saccà, C. Cernetti, B. Reimers Emodinamica 2003, 35:9-18 di interventistica, principalmente per l’alto rischio di embolizzazione e di infarto periprocedurale, per l’alta incidenza di restenosi dopo PCI, e per l’inevitabile progressione della malattia aterosclerotica, soprattutto nei cosiddetti SVGs degenerati. Ciononostante negli ultimi dieci anni sono stati ottenuti notevoli progressi nella comprensione della storia naturale e nella definizione della strategia interventistica dei SVGs (50). Peculiarità delle lesioni dei SVGs: lesione “significativa”, graft “degenerati” e il problema delle occlusioni totali. È stato notato che la ricorrenza di eventi ischemici oltre il primo anno dopo PCI efficace su SVGs è legata nella maggior parte dei casi a progressione della malattia in lesioni di grado moderato non trattate al momento della PCI(51). Sulla base di questa osservazione si ammette la necessita’ di trattare nei SVGs anche le lesioni angiograficamente di grado intermedio (40-50% in diametro). La malattia aterosclerotica dei SVGs si presenta in due forme distinte dal punto di vista anatomo angiografico e, in ultima analisi, anche dal punto di vista della prognosi dopo PCI: una forma caratterizzata da lesioni focali, singole, ed un’altra caratterizzata da degenerazione diffusa del graft venoso (da un punto di vista semantico definiamo SVG degenerato quello che presenta una lesione > 30 mm in lunghezza con presenza di trombo o contorno irregolare). La maggior parte degli studi clinici che supportano il trattamento percutaneo dei SVGs sono stati condotti su SVGs con lesioni focali e quindi non permettono di stabilire in maniera definitiva il trattamento ottimale dei SVGs degenerati. Due studi(52,53) hanno valutato i risultati della PCI nei SVGs degenerati, dimostrando che l’impianto di stent può essere effettuato con un’ accettabile incidenza di complicanze periprocedurali, le quali comunque risultano sempre più frequenti rispetto a quanto 10 osservato durante interventistica su lesioni focali. Purtroppo i risultati a medio e lungo termine sono meno favorevoli a causa dell’alta incidenza di necessità di re-PCI e della progressione della malattia su altri segmenti del graft non trattati inizialmente. L’approccio al problema dei SVGs occlusi richiede una distinzione tra occlusione acuta in corso di infarto miocardio acuto (IMA) e occlusione subacutacronica. In presenza di occlusione acuta, si ammette l’utilità di una PCI sul graft venoso, anche se e’ stato dimostrato che la mortalità e’ maggiore nel caso di PCI primaria su SVGs rispetto a PCI primaria sui vasi nativi(54,55). Nel caso delle occlusioni subacute-croniche dei graft, numerosi studi osservazionali indicano una bassa percentuale di successo procedurale con un’alta incidenza di infarti periprocedurali legati a embolizzazione di materiale aterotrombotico che viene dislocato durante la procedura di ricanalizzazione e occlude i vasi nativi distali(56). Il tentativo di ricanalizzazione di graft venosi occlusi da tempo è quindi considerato una procedura da evitare(57). Fibrinolisi selettiva intra graft L’infusione selettiva intragraft di farmaci fibrinolitici è stata proposta come metodica adiuvante nell’interventistica sui SVGs degenerati, soprattutto in presenza di bypass occlusi. Sono stati utilizzati l’Urochinasi in infusione continua o somministrata a boli e il t-PA in bolo seguito da infusione continua. Questi tipi di trattamento hanno però dimostrato di accompagnarsi ad un’alta incidenza di complicanze periprocedurali, come emorragie ed infarto miocardio (58), tanto che attualmente i benefici derivanti dalla trombolisi intra graft non sembrano giustificare i rischi da essa implicati. Il device di scelta: lo stent. I primi studi sui risultati dell’angioplastica (PTCA) semplice nel trattamento percutaneo dei SVGs riportavano risultati non favorevoli sia procedurali che a distanza (59-60). Dopo l’introduzione degli stent, in seguito anche ai risultati incoraggianti di un registro che aveva utilizzato gli stent nei SVGs 61), sono stati condotti studi randomizzati di confronto tra PTCA e stenting per il trattamento dei SVGs. Nello studio SAVED, in cui i pazienti venivano randomizzati a PTCA o ad impianto elettivo di stent di Palmaz-Schatz, i pazienti trattati con stent avevano un maggiore successo procedurale (92% vs 69%, p<0.001), una significativa riduzione dell’end-point composito a 6 mesi di morte, infarto miocardio Q, ripetizione di CABG e re-PCI (26% vs 39%, p<0.05), un trend favorevole verso una minore rivascolarizzazione della lesione colpevole (TLR) (17% vs 26%, p=ns) e verso una minore, ma sempre elevata, restenosi angiografica (36% vs 47%, p=0.11)(62). Nello studio VENESTENT(63), in cui i pazienti venivano randomizzati a PTCA semplice o ad impianto elettivo di stent Wiktor, i pazienti trattati con stent mostravano una incidenza significativamente minore di rivascolarizzazione del vaso colpevole (TVR) a 6 mesi (11.5% vs 25%, p<0.05) e un trend favorevole verso una minore incidenza di restenosi (21.9% vs 35.6%, p=0.09). Lo studio randomizzato WINS(64) ha dimo strato un’equivalenza tra lo stent autoespandibile Wallstent e lo stent di Palmaz-Schatz nel trattamento dei SVGs sia in lesioni de novo che restenotiche. Numerosi, più recenti studi osservazionali che hanno utilizzato diversi tipi di stent “balloonexpandable” indicano che l’impianto di stent nei SVGs ha un’alto tasso di successo, un’ accettabile incidenza di trombosi dello stent e una possibile riduzione della restenosi rispetto ad altri device(61,65-70). Uno studio monocentrico recente(71), ha mostrato un’ incidenza di restenosi angiografica significativamente minore nei segmenti di SVG trattati con stent rispetto ai segmenti di SVG trattati con angioplastica semplice. L’incidenza di restenosi sembra più alta per le lesioni ostiali e restenotiche (30-60%) rispetto a lesioni in altre sedi del graft o de novo (17-39%). L’incidenza di necessità di TLR dopo impianto di stent nei SVGs è massima nei primi 8 mesi, ma il rischio di TLR permane per 18-24 mesi suggerendo che i pazienti trattati con stent nei graft vanno seguiti scrupolosamente anche dopo i primi 8-10 mesi per il rischio di restenosi “ritardata” (72,73) . Negli ultimi anni notevoli sforzi sono stati condotti al fine di sviluppare stent ricoperti in grado di limitare i fenomeni di embolizzazione distale in fase acuta e la restenosi a distanza (Figura 1). I risultati clinici derivanti dall’impiego di questi nuovi stent hanno dato indicazioni discordanti. Nel trial Recovers, in cui i pazienti sono stati randomizzati al trattamento con uno “stent graft” (Jostent, Jomed), costituito da 2 stent in acciaio che racchiudono una membrana di politetrafluoroetilene (PTFE), o con normale stent di acciaio, l’utilizzo di stent graft ha dimostrato di comportare un aumento degli infarti non Q a 30 giorni e di non ridurre l’incidenza di restenosi angiografica a 6 mesi (74) . La maggior incidenza di complicanze procedurale è verosimilmente legata al elevato profilo del device che comprende due stent sovrapposti che racchiudono (“a sandwich”) la membrana di PTFE. Di più favorevole profilo sono stent lasercut in acciaio con membrane di pericardio bovino cucite sullo stent. Nel trial prospettico non randomizzato Symbiot II(75), in cui i pazienti sono stati sottoposti al trattamento con stent autoespandibile Symbiot (Boston Scientific), costituito da una struttura in nitinol racchiusa tra due membrane in PTFE, l’incidenza di eventi cardiaci avversi maggiori a 30 giorni (endpoint primario) è risultata bassa se comparata con i risultati ottenuti in uno studio precedente che aveva utilizzato il Wallstent (WINS, 64). Anche l’incidenza di restenosi angiografica, e di “failure” a 6 a b Figura 1. a) Stent graft Jostent Graftmaster (Jomed). b) Esemplificazione delle fasi di impianto di uno stent Symbiot (Boston). Dall’alto al basso: posizionamento dello stent, rilascio dello stent autoespandibile con contenimento della placca all’esterno dello stent, postdilatazione dello stent, e risultato finale. mesi del vaso trattato (TVF) sono risultati inferiori ai risultati di studi precedenti(62,64). Ulteriori studi di tipo randomizzato sono in corso (Symbiot III) per confermare i risultati incoraggianti derivanti da queste prime esperienze con gli stent Symbiot. Un ultimo accenno va al problema dell’uso degli stent medicati (DES) con rapamicina o paclitaxel. A tutt’oggi non esistono studi sufficientemente numerosi da permettere di stabilire il ruolo dei DES nel trattamento dei SVGs. Va precisato comunque che con i diametri di DES attualmente esistenti (fino ad un massimo di 3.5 mm), il trattamento di condotti venosi di diametro 3.5 mm può comportare un’inadeguata apposizione dello stent alla parete del vaso e un’inadeguata concentrazione di farmaco antiproliferativo con una possibile inefficace prevenzione della restenosi. Inoltre i meccanismi fisiopatologici della restenosi nei SVGs non sembrano uguali a quelli dei vasi nativi e quindi i risultati degli studi con DES nei vasi coronarici nativi non possono essere automaticamente trasportati ai SVGs senza la conferma di studi dedicati. Se è vero che lo stent rappresenta il device di scelta nel trattamento percutaneo dei SVGs, menzione va comunque fatta ad altre metodiche che sono state sperimentate nel trattamento dei 11 Interventistica per cutanea nei by-pass aorto-coronarici venosi L. Favero,G. Pasquetto, S. Saccà, C. Cernetti, B. Reimers Emodinamica 2003, 35:9-18 graft senza fornire risultati però comparabili con quelli ottenuti con gli stent. Lo studio CAVEAT II ha confrontato l’efficacia della PTCA vs aterectomia direzionale (DCA) nei SVGs (76). La metodica di DCA ha dimostrato di avere una più alta incidenza di successo procedurale ma al prezzo di una maggiore incidenza di IMA non Q. A 6 mesi, l’incidenza di restenosi angiografica non è risultata differente nei due gruppi. Per quanto riguarda l’utilizzo dell’aterectomia rotazionale, si ritiene sia controindicato nei SVGs a causa dell’alto rischio di embolizzazione distale che questa tecnica comporta. Nella seconda metà degli anni novanta ha conosciuto un periodo di successo l’aterectomia con catetere ad estrazione transluminale (TEC). Un trial randomizzato multi-centrico e alcuni studi monocentrici(77-79) hanno evidenziato una minore incidenza di complicanze emboliche procedurali, almeno nei graft senza evidente trombosi endoluminale, ma alti tassi di restenosi angiografica. L’aterectomia con laser ad eccimeri (ELCA) infine ha mostrato in uno studio comparativo con la PTCA di non offrire benefici ne’ in termini di risultati angiografici immediati ne’ di eventi cardiaci avversi ad 1 anno (80). Sistemi di protezione dall’embolizzazione. Come già detto uno degli aspetti peculiari del trattamento dei SVGs è l’alto rischio di fenomeni di embolizzazione distale e/o noreflow e la conseguente alta incidenza di IMA periprocedurali, per lo più di tipo non Q(81-83). Per ovviare a questo problema, sono stati sviluppati device che possiamo suddividere in device di trombectomia e device di protezione (Figura 2). I sistemi di trombectomia aspirano trombi e frammenti di placca per “ripulire”i SVGs prima del loro trattamento definitivo. Tali sistemi, dopo avere dato iniziali risultati incoraggianti (84-86) sono oggi meno utilizzati(87) rispetto ai sistemi di protezione 12 a b c Figura 2. Sistemi di protezione distale: a) Percu Surge (Guardwire , Medtronic) con palloncino distale gonfiato e catetere di aspirazione; b) Angioguard X P (Cordis ); c) Filterwire EX (Boston). che hanno fornito risultati più univoci(81,82,88,89). Lo studio SAFER(88) ha randomizzato 801 pazienti sottoposti a PCI su lesioni de novo in SVGs con o senza il sistema di protezione con palloncino occlusivo distale Percu Surge (Guardwire, Medtronic). Lo studio ha dimostrato che l’utilizzo di questo sistema riduce in maniera significativa l’incidenza di IMA non Q periprocedurale (8.6% nel braccio con PercuSurge vs 14.7% nel braccio di controllo, p<0.05) e di no-reflow (3% nel braccio con PercuSurge vs 9% nel braccio di controllo, p<0.05). Questo effetto è risultato indipendente dalla somministrazione di farmaci inibitori del recettore glicoproteico IIb/IIIa. Lo studio FIRE (89), che ha randomizzato 651 pazienti sottoposti a PCI su lesioni de novo in SVGs a trattamento con sistema di occlusione distale (Guardwire, Medtronic) vs filtro distale (FilterWire EX, Boston), ha dimostrato un sovrapponibile successo procedurale (97.2% nel braccio con Guardwire vs 95.5% nel braccio con FilterWire, p=ns) e una sovrapponibile incidenza di eventi cardiaci avversi maggiori (MACE 11.6% nel braccio con Guardwire vs 9.9% nel braccio con FilterWire, p=ns). I sistemi di protezione dall’embolizzazione si configurano quindi come metodiche necessarie nel trattamento degli SVGs degenerati, e sembra esserci una sostanziale equivalenza di risultati tra sistemi ad occlusione distale ed aspirazione e filtri distali. È necessario invece accumulare ulteriori dati per quanto riguarda i sistemi di protezione ad occlusione prossimale. Questi sistemi di protezione operano bloccando il flusso anterogrado mediante occlusione del graft all’ostio e aspirando a fine procedura il sangue dal graft con rimozione degli eventuali frammenti di trombo o placca embolizzati. Questi device (Proxis, Kerberos, TriActiv) sono in via di valutazione clinica. Utilizzo degli inibitori IIb/IIIa L’efficacia degli inibitori del recettore della glicoproteina IIb/IIIa come farmacoterapia adiuvante durante PCI nei SVGs non è evidente come per le lesioni del circolo nativo. I dati cumulativi degli studi EPIC ed EPILOG non mostrano differenze significative nella prognosi a 30 giorni e 6 mesi tra pazienti trattati su SVGs con o senza abciximab(90, 91). A tutt’oggi non esistono evidenze scientifiche totalmente convincenti riguardo l’utilità dell’uso degli inibitori IIb/IIIa nell’interventistica sui SVGs (92). trattamento della restenosi intra stent nei SVGs. Aspetti tecnici dell’interventistica nei bypass aortocoronarici venosi La via di accesso preferita nel nostro centro durante interventistica sui SVGs è quella femorale perché consente l’utilizzo di cateteri guida di diametro maggiore ( 7F), in grado di fornire maggior supporto durante la PCI e di permettere il posizionamento di sistemi di protezione dall’embolizzazione. I diametri dei cateteri guida utilizzati variano dal 6 all’8 F e il tipo di catetere guida dipende dal SVG che si desidera trattare. I bypass per la coronaria destra di solito vengono incannulati con il Judkins destro o il Multipurpose, mentre i bypass per la coronaria non si riesca ad avanzare sulla guida il palloncino o lo stent è possibile inserire una guida aggiuntiva nel bypass. La cosiddetta “buddy-wire” fornisce supporto al catetere guida permettendo l’avanzamento dei device desiderati. L’utilizzo del sistema di protezione è altamente raccomandato, anche in presenza di graft non diffusamente degenerati. Di preferenza nella nostra esperienza il sistema più rapido e facile da usare è quello con filtro distale. Qualora la stenosi del graft sia particolarmente serrata e non consenta il passaggio del filtro, è possibile eseguire con una certa sicurezza una predilatazione senza protezione distale della lesione con Figura 3. Esempio di graft venoso degenerato per il ramo marginale ottuso, di 12 anni d’ età , con difetti di riempimento che suggeriscono la presenza di trombi multipli. Angiogrammi basali (in alto, proiezione OAS a sinistra e OAD a destra) e dopo trattamento con 2 stent graft (in basso, proiezione OAS a sinistra e OAD a destra). Brachiterapia. È stato recentemente dimostrato che la brachiterapia con raggi ã della restenosi intra stent dei SVGs possiede un’efficacia terapeutica analoga a quanto avviene nel circolo coronario nativo(93). A tutt’oggi pertanto, la brachiterapia con raggi ã è l’unica metodica che si è dimostrata utile nel ridurre le recidive dopo sinistra con il Judkins destro e l’Amplatz sinistro. Alternative valide sono i cateteri con curve specifiche per bypass destro o sinistro. Le guide utilizzate variano a seconda delle preferenze dell’operatore, ma in molti casi è necessario impiegare guide ad alto supporto per potere avanzare i device nel bypass. Nel caso si utilizzi un sistema di protezione con filtro o occlusione distale e un pallone di piccolo diametro (1.5, 2.0 mm) espanso a poche atmosfere, successivamente avanzare il filtro, e finire la procedure con sistema di protezione in sede. Alternativamente si può utilizzare il Guardwire, che avendo un profilo minore, permette un più facile superamento anche di lesioni serrate. La tecnica di impianto degli stent espansi su pallone nei 13 Interventistica per cutanea nei by-pass aorto-coronarici venosi L. Favero,G. Pasquetto, S. Saccà, C. Cernetti, B. Reimers Emodinamica 2003, 35:9-18 SVGs prevede alcuni accorgimenti. Si raccomanda dove possibile di eseguire l’impianto dello stent direttamente senza predilatazione, al fine ridurre il rischio di embolizzazione distale (82) . Qualora sia necessario predilatare, si raccomanda di utilizzare un palloncino sottodimensionato rispetto al vaso al fine di minimizzare il rischio di embolizzazione distale. Resta ancora da definire quale è il tipo di stent preferibile. Nel caso si utilizzino stent balloonexpandable, si consiglia di non sovradimensionare lo stent rispetto al vaso ma di mantenere un rapporto stent:graft di 1:1 e di non eseguire post-dilatazione ad alta pressione, evitando così la protrusione e successiva embolizzazione di materiale aterotrombotico attraverso le maglie dello stent. Uno stent specificatamente creato per i bypass venosi è lo stent Ultra (Guidant) espandibile fino ad un diametro di 6 mm e con elevata copertura metallica, il quale consente di coprire la placca friabile del graft con potenziale riduzione dei fenomeni di embolizzazione. La lunghezza dello stent deve essere maggiore della lunghezza della lesione valutata all’ angiografia coronarica quantitativa, al fine di evitare fenomeni di “shift” di placca. In questo senso, l’interventistica sui graft comporta spesso l’impianto di stent lunghi o multipli fino, in presenza di malattia diffusa, alla ricostruzione con stent dell’intero condotto venoso. Le Figure 3 e 4 illustrano un esempio di trattamento di SVG degenerato per il ramo marginale ottuso. Conclusioni In pazienti portatori di bypass aorto-coronarici con indicazioni alla rivascolarizzazione, il trattamento percutaneo di graft venosi stenotici rappresenta spesso la terapia di prima scelta. Ciò nondimeno, questa procedura a tutt’oggi è da considerarsi una delle più difficili e rischiose che affrontiamo in sala di emodinamica. 14 a b c d Figura 4. Fasi della procedura di cui alla figura 1. a) Posizionamento del filtro di protezione distale contenuto nel delivery sheath; b) normale flusso attraverso il filtro aperto, senza evidenza di embolizzazione distale dopo passaggio del filtro; c) impianto di 2 stent graft autoespandibili Symbiot; d) postdilatazione con pallone non compliante 4.5x20 mm a 12 atm. Tentativi di ridurre l’incidenza di complicanze periprocedurali con sistemi di protezione e con stent (coperti o no), entrambi da considerarsi d’obbligo, sono promettenti ma siamo ancora lontani da una soluzione definitiva del problema. La migliore strategia in termini di utilizzo di stent medicati o ricoperti e in termini di terapia farmacologia preventiva per ridurre la tuttora elevata incidenza di restenosi e di progressione della malattia è ancora da definire. Bibliografia 1)Morwani JG, Topol EJ. Aortocoronary saphenous vein graft disease pathogenesis, predispositions, and prevention. Circulation 1998;97:916-31. 2)Bourassa MG, Enjalbert M, Campeau L, et al. Progression of coronary artery disease between 10 and 12 years after coronary artery bypass graft surgery. In Roskamm H. ed. Prognosis of Coronary Heart Disease: Progression of Coronary arteriosclerosis. Berlin, Springer-Verlag, 1983:150. 3)The VA coronary artery bypass surgery cooperative study group. Eighteen-year follow-up in the Veterans Affairs Cooperative Study of coronary artery bypass surgery for stable angina. Circulation 1992;86:121-30. 4)Campeau L, Lesperance J, Hermann J, et al. Loss of the improvement of angina between 1 and 7 years afetr aortocoronary bypass surgery. Circulation 1979;suppl 60:I 1-15. 5)Hwang MH, Meadows WR, Palac RT, et al. Progression of native coronary artery disease at 10 years: inshights from a randomized study of medical versus surgical therapy for angina. J Am Coll Cardiol 1990;16:1066-70. 6)Johnson WD, Kayser KL, Pedraza PM, et al. Angina pectoris and coronary bypass surgery. Am Heart J 1984;108:1190-97. 7)Frick MH, Valle M, Harjola PT, et al. Progression of coronary artery disease in randomized medical and surgical patients over a 5-year angiographic follow-up. Am J Cardiol 1983;52:681. 8)Cameron A, Kemp HG, Shimomura S, et al. Aortocoronary bypass surgery, a 7-year follow-up. Circulation 1979; suppl 60:I9-13. 9)Palac RT, Hwang MH, Meadows WR, et al. Progression of coronary artery disease in medically and surgically treated patients 5 years after randomization. Circulation 1981; suppl 64:II-17. 10)Loop FD, Lytle BW, Cosgrove DM, et al. Influence of internal mammary-artery graft on 10-year survival and other cardiac events. N Engl J Med 1986;314:1-6. 11)Rasmussen C, Thiis JJ, Clemmensen P, et al. Management of suspected graft failure in coronary artery bypass grafting. Circulation 1996; suppl 94:I-413. 12)Reifart N, Haase J, Storger H, et al. Interventional standby for cardiac surgery. Circulation 1996; suppl 94:I-86. 13)Cutlip DE, Dauerman HL, Carrozza JP, et al. Recurrent ischemia within thirty days of coronary artery bypass surgery: angiographic findings and outcome of percutaneous revascularization. Circulation 1996;suppl 94:I-249. 14)Dooris M, Safian RD. Coronary artery bypass graft. In: R Safian, MS Freed, ed. The manual of interventional cardiology. Royal Oak,MI: Physicians’s Press, 2001; 317. 15)Chen L, Theroux P, Lesperance J, et al. Angiographic features of vein grafts versus ungrafted coronary arteries in patients with unstable and previous bypass surgery. J Am Coll Cardiol 1996;28:1493-99. 16)Campeau L, Enjalbert M, Lesperance J, et al. The relation of risk factors to the development of atherosclerosis in saphenousvein bypass grafts and the progression of disease in the native circulation. N Engl J Med 1984;311:1329-32. 17)Fitzgibbon GM, Burton JR, Leach AJ, et al. Coronary bypass graft fate. Angiographic grading of 1400 consecutive grafts early after operation and of 1132 after one year. Circulation 1978;57:1070. 18)Goldman S, Copeland J, Moritz T, et al. Starting aspirin therapy after operation: effects on early graft patency. Circulation 1991;84:520-25. 19)Hamby RJ, Aintablian A, Handler M, et al. Aortocoronary saphenous vein bypass grafts. Long-term patency, morphology and blood flowin patients with patent grafts early after surgery. Circulation 1979;60:901. 20)Bourassa MG, Enjalbert M, Campeau L, et al. Progression of atherosclerosis coronary arteries and bypass grafts: Ten years later. Am J Cardiol 1984;53:102C. 21)Bourassa MG, Fischer LD, Campeau L, et al. Long-term fate of bypass grafts: The coronary Artery Surgery Study (CASS) and Montreal Heart Institute Experiences. Circulation 1985; suppl 72:V71-78. 22)Fitzgibbon GM, Leach J, Kafka HP, et al. Coronary bypass graft fate: long-term angiographic study. J Am Coll Cardiol 1991;17:1075-80. 23)White C, Campeau L, Knatterud G, et al. Patency of saphenous vein bypass grafts following elective angiography: preliminary results from the POST CABG trial. J Am Coll Cardiol 1993;21:18A. 24)Mulvihill NT, Boccalatte M, Farah B, et al. Perutaneous revascularization of degenerated saphenous vein grafts. In: Euro PCR, 2002,126. 25)Douglas J Jr. Interventistica percutanea in pazienti con pregresso intervento di bypass coronario. In: Topol EJ, ed. Cardiologia Interventistica. Phila-delphia,PA:W.B.Saunders Compa-ny,1999:297-98. 26)Guthaner MG, Robert EW, Alderman EL, et al. Long-term serial angiographic studies after coronary artery bypass surgery. Circulation 1979;60:250-9. 27)Seides SF, Bozer JS, Kent KM, et al. Long-term anatomic fate of coronary artery bypass grafts and functional status of patients five years after operation. N Engl J med 1978;298:1213-17. 28)Neitzel GF, Barboriak JJ, Pintar K, et al. Atherosclerosis in aortocoronary bypass grafts. Morphologic study and risk factor analysis 6 to 12 years after surgery. Arteriosclerosis 1986; 6:594-600. 29)Morrison DA, Crowley ST, Veerakul G, et al. Percutaneous trasluminal angioplasty of saphenous vein grafts for medically refractory unstable angina. J Am Coll Cardiol 1994;23:1066-70. 30)Smith SH, Greer JC. Morphology of saphenous vein coronary artery bypass grafts: seven to 116 months after surgery. Arch pathol Lab Med 1983;107:13-18 31)Charlson ME, Isom OW. Care of coronary-artery bypass 15 Interventistica per cutanea nei by-pass aorto-coronarici venosi L. Favero,G. Pasquetto, S. Saccà, C. Cernetti, B. Reimers Emodinamica 2003, 35:9-18 surgery. N Engl J Med 2003;348:1456-63. 32)Campeau L, Knatterud GL, Domanski M, et al. The effect of aggressive lowering of lowdensity lipoprotein cholesterol levels and low-dose anticoagulation on obstructive in saphenous vein bypass grafts. N Engl J Med 1997;336:153-62. 33)Campeau L, Hunninghake DB, Knatterud GL, et al. Aggressive cholesterol lowering delays saphenous vein graft atherosclerosis in women, the elderly, and patients with associated ris k factors. Circulation 1999;99:3241-47. 34)Schaff HV, Orszulak TA, Gersh BJ, et al. The morbidity and mortality of reoperation for coronary artery disease and analysis of late results with use of actuarial estimate of event-free interval. J Thorac Cardiovasc Surg 1983;85:508-15. 35)Foster ED, Fisher LD, Kaiser GC, et al. Comparison of operative mortality and morbidity for initial and repeat coronary artery bypass grafting: the Coronary Artery Surgery Study (CASS) registry experience. Ann of Thoracic Surg 1984;38:56370. 36)Verheul HA, Muolign AC, Hondema S, et al. Late results of 200 repeat coronary artery bypass operation. Am J Cardiol 1991;67:24-30. 37)Lytle BW, Loop FD, Cosgrove DM, et al. Fifteen hundred coronary reoperations: results and determinants of early and late survival. J Thorac Cardiovasc Surg 1987;93:84759. 38)Laird-Meeter K, VanDomBurg R, Vanden Brand MJBM, et al. Incidence, risk, and outcome of reintervention after aortocoronary bypass surgery. Br Heart J 1987;57:427-35. 39)Weintraub WS, Jone EL, Craver JM, et al. In hospital and long-term outcome after reoperative coronary artery bypass graft surgery. Circulation 1995; suppl 92:II 50-57. 40)Hannan EL, Kilburn H, O’Donnel JF, et al. Adult open 16 heart surgery in New York State. JAMA 1990;264:2768-74. 41)Lytle BW, McElroy D, McCarthy O, et al. Influence of arterial coronary bypass grafts on the mortality in coronary reoperations. J Thorac Cardiovasc Surg 1994;107:67582. 42)Ivert TS, Ekestrom S, Petriffy A, et al. Coronary artery reoperations. Early and late results in 101 patients. Scand J Thoracic Cardiovasc Surg 1988;22:111-18. 43)Perrault L, Carrier M, Cartier R, et al. Morbidity and mortality of reoperation for coronary artery bypass grafting: significance of atheromatous vein grafts. Can J Cardiol 1991;7:427-30. 44)Gonzalez-Santos JM, Ennabli K, Grondin C. Repeat coronary artery bypass grafting in patients with patent atherosclerotic grafts: a special challenge. Thorac Cardiovasc Surg 1984;32:34649. 45)Weintraub WS, Jones EL, Morris DC, et al. Outcome of reoperative bypass surgery versus coronary angioplasty after previous bypass surgery. Circulation 1997;95:868-77. 46)Brener SJ, Loop FD, Lytle BW, et al. A profile of candidates foe repeat myocardial revascularization implications for selection of treatment. J Thorac Cardiovasc Surg 1997;114:15363. 47)Stephan WJ, O’Keefe JH, Piehler JM, et al. Coronary angioplasty versus repeat coronary artery bypass grafting for patients with previous bypass surgery. J Am Coll Cardiol 1996;28:1140-46. 48)Brener SJ, Ellis SG, Dykstra DM, et al. Determinants of the key decision for prior CABG patients facing need for repeat revascularization:PCA or CABG? J Am Coll Cardiol 1996;suppl 27:45A. 49)Colombo A, Tobis J. Saphenous vein grafts. In: Colombo A, Tobis J, ed. Techniques in Coronary Artery Stenting. London, UK: MartinDunitz, 2000:129. 50)Hong MK, Mehran R, Dangas G, et al.et al Are we making progress with percutaneous saphenous vein graft treatment? A comparison of 1990 to 1994 and 1995 to 1998 results. J Am Coll Cardiol. 2001 Jul;38(1):150-4 51)Ellis SG, Brener SJ, DeLuca S, et al. Late myocardial ischemic events after saphenous vein graft intervention: importance of initially “nonsignificant” vein graft lesions. Am J Cardiol 1997;79:1460-64. 52)Le May MR, Labinaz M, Marquis JF, et al. Predictors of long-term outcome after stent implantation in a saphenous vein graft. Am J Cardiol 1999;83:681-86. 53)Choussat R, Black AJ, Bossi I, et al. Long-term clinical outcome after endoluminal reconstruction of diffusely degenerated saphenous vein grafts with lessshortening Wallstents. J Am Coll Cardiol 2000;36:387-95. 54)Stone GW, Brodie BR, Griffin JJ, et al. Clinical and angiographic outcomes in patients with previous coronary artery bypass graft surgery treated with primary balloon angioplasty for acute myocardial infarction. Second Primary Angioplasty in Myo-cardial Infarction Trial (PAMI-2) Investigators. J Am Coll Cardiol. 2000 Mar 1;35(3):605-11. 55)Nyguien TT, O’Neil WW, Grines CL, et al. One-year survival in patients with acute myocardial infarction and a saphenous vein graft culprit treated with primary angioplasty. Am J Cardiol. 2003 May 15;91(10):1250-4. 56)Berger PB, Bell MR, Gril DE, et al. Influence of procedural success on immediate and longterm clinical outcome of patients undergoing percutaneous revascu-larization of occluded coronary artery bypass vein grafts. JACC 1996 Dec; 28(7):1732-7. 57)De Feyter PJ, Serruys PW, van den Brand M, et al. Percutaneous transluminal angioplasty of a totally occluded venous bypass graft: a challenge that should be resisted. Am J Cardiol. 1989 Jul 1;64(1):88-90. 58)Hartmann JR, McKeever LS, Stamato NJ, et al. Recanalization of chronically occluded aortocoronary saphenous vein bypass grafts by extended infusion of urokinase: initial results and short term follow-up. J Am Coll Cardiol 1991;18:1517:1523. 59)De Feyter PJ, Van Suylen RJ, De Jaegere PP, et al. Balloon angioplasty for the treatment of lesions in saphenous vein bypass grafts. J Am Coll Cardiol 1993;2:1539-49. 60)Reeves F, Bonan R, Cote H, et al. Long-term angiographic follow-up after angioplasty of venous coronary bypass grafts. Am Heart J 1991;122:620-27. 61)Wong SC, Baim DS, Schatz RA, et al. For the Palmaz-Schatz Stent Study Group. Immediate results and late outcome after stent implantation in saphenous vein graft lesions: the multicenter U.S. Palmaz-Schatz stent experience. J Am Coll Cardiol 1995;26:704-26. 62)Savage M, Douglas J, Fischman D, et al. For the Saphenous Vein De Novo Trial Investigators. Stent placement compared with balloon angioplasty for obstructed coronary bypass grafts. N Engl J Med 1997;337:740-47. 63)Hanekamp CEE, Koolen JJ, Den Heyer P, et al. For the VENESTENT Study Group. A randomized comparison between balloons angioplasty and elective stent implantation in venous bypass graft; the VENESTENT Study. J Am Coll Cardiol 2000;35:79. 64)Safian RD, Kaplan B, Schreiber T, et al. Final results of the randomized Wallstent endoprosthesis in saphenous vein graft trial (WINS). J Am Coll Cardio 1999;33:37A. 65)Rechavia E, Litvack F, Macko G, et al. Sten implantation of saphenous vein graft aorto-ostial lesions in patients with unstable ischemic syndromes:immediate angiographic results and long- term clinical outcome. J Am Coll Cardiol 1995;25:866-70. 66)Wong SC, Popma J, Pichard A, et al. Comparison of clinical and angiographic outcomes after saphenous vein grafts angioplasty using coronary versus “biliary” tubular slotted stents. Circulation 1995;91:339-50. 67)Fenton S, Fischman D, Savage M, et al. Long-term angiographic and clinical outcome after implantation of balloonexpandable stents in aortocoronary saphenous vein grafts. Am J Cardiol 1994;74:1187-91. 68)Leon MB, Wong SC, Pichard A. Balloon expandable stent implantation in saphenous vein grafts. In: Hermann HC, Hirschfeld JW, ed. Clinical use of the Palmaz-Schatz intracoronary stent. Futura Publishing Company Inc. 1993;111-12. 69)Fortuna R, Heuser R, Garratt K, et al. Wiktor intracoronary stent: experience in the first 101 vein graft patients. Circulation 1993;88:I-309. 70)Bilodeau L, Iyer S, Cannon A, et al. Flexible coil stent in saphenous vein grafts: clinical and angiographic follow-up. J Am Coll Cardiol 1992;19:264A. 71)Keeley EC, Velez CA, O’Neil WW, et al. Long term clinical outcome and predictors of major adverse cardiac events after percutaneous interventions on saphenous vein grafts. J Am Coll Cardiol 2001;38:659-65. 72)Dooris M, Safian RD. Coronary artery bypass graft. In: R Safian, MS Freed, ed. The manual of interventional cardiology. Royal Oak, MI: Physicians’s Press, 2001; 317. 73)Hong MK, Mehran R, Dangas G, et al. Comparison of time course of target lesion revascularization following successsful saphenous vein graft angioplasty versus successful native coronary angioplasty. Am J Cardiol 2000;85:256-58. 74)Stankovic G, Colombo A, Presbitero P, et al. Randomized evaluation of polytetrafluoroethylene-covered stent in saphenous vein grafts (RECOVERS Trial). Circulation 2003;108:37-42. 75)Reimers B. Personal Comunication, ESC 2003. 76)Holmes D, Topol EJ, Califf R, et al. A multicenter, randomized trial of coronary angioplasty versus directional atherectomy for patients with saphenous vein graft lesions. Circulation 1995;91:1966-74. 77)Kaplan B. Personal Comunication, 2000. (TOPIT trial) 78)Al-Shaibi KF, Goods CM, Jain SP, et al. Does transluminal extraction atherectomy reduce distal embolization in saphenous vein graft? Circulation 1995;92:I-329. 79)Misumi K, Matthews RV, Sun GW, et al. reduced distal embolization with transluminal extraction atherectomy compared to balloon angioplasty for saphenous vein graft disease. Cathet Cardiovasc Diagn 1996;39:246-51. 80)Natarajan MK, Bowman KA, Chisholm RJ, et al. Excimer laser angioplasty vs balloon angioplasty in saphenous vein bypass grafts: quantitative angiographic compari-son of matched lesions. Cathet Cardiovasc Diagn 1996;38:15358. 81)Grube E, Gerkens U, Yeung AC, et al. Prevention of distal embolization during coronary angioplasty in saphenous vein grafts and native vessels using porous filter protection. Circulation 2001;104:2436-41. 82)Webb JG, Carere RG, Virmani R, et al. Retrieval and analysis of particulate debris after saphenous vein graft intervention. J Am Coll Cardiol 1999;34:46875. 83)Altmann D, Popma J, Hong M, et al. CPK-MB elevation after angioplasty of saphenous vein grafts. J Am Coll Cardiol. 1993;21:232A. 84)Ramee S, Kuntz R, Schatz R, et al. Preliminary experience with the POSSIS coronary angiojet 17 Interventistica per cutanea nei by-pass aorto-coronarici venosi L. Favero,G. Pasquetto, S. Saccà, C. Cernetti, B. Reimers Emodinamica 2003, 35:9-18 rheolytic thrombectomy catheter in the VEGAS 1 pilot study. J Am Coll Cardiol 1996;27:69A. 85)van Ommen CG, van der Bos AA, Pieper M, et al. Removal of thrombus from aortocoronary bypass grafts and coronary arteries using the 6 FR hydrolyser. Am J Cardiol 1997;79:1012-16. 86)Stone GW, Cox DA, Low R, et al. Safety and efficacy of a novel device for treatment of thrombotic and atherosclerotic lesions in native coronary arteries and saphenous vein grafts: results from the multicenter X-Sizer for treatment of thrombus and atherosclerosis in coronary applications trial (X-TRACT) study. Catheter Cardiovasc Interv. 2003 Apr;58(4):419-27. 87)Cohen DJ, Cosgrove R, Berezin R, et al. Costeffectiveness of rheolytic thrombectomy for thrombuscontaining coronary lesions: results from the VEGAS 2 Trial. J Am Coll Cardiol 1999;47A. 88)Baim DS, Wahr D, George B, et al. Randomized trial of a distal embolic protection device during percutaneous intervention of saphenous vein aortocoronary bypass grafts. Circulation 2002;105:1285-90. 18 89)Stone GW, Rogers C, Hermiller J, et al. Randomized comparison of distal protection with a filter-based catheter and a balloon occlusion and aspiration system during percutaneous intervention of diseased saphenous vein aorto-coronary bypass grafts. Circulation 2003;108:548-53. 90)Mak KH, Challapalli R, Eisenberg MJ, et al. For the EPIC Investigators. Effect of platelet glycoprotein IIb/IIIa receptor inhibition on distal embolization during percutaneous revascularization of aortocoronary saphenous vein grafts. Am J Cardiol 1997;80:985-88. 91)Ellis SG, Lincoff AM, Miller D, et al. Reduction in complications of angioplasty with abciximab occurs largely independently of baseline lesion morphology. J Am Coll Cardiol 1998;32:1619-23. 92)Mathew V, Grill DE, Scott CG, et al. The influence of abciximab use on clinical outcome after aortocoronary vein graft interventions. J Am Coll Cardiol 1999;34:1163-69. 93)Castagna MT, Mintz GS, Waksman R, et al. Comparative efficacy of ã-irradiation for tretment of in-stent restenosis in saphenous vein graft versus native coronary artery in-stent restenosis. Circulation 2001;104:3020-22. 94)Abdelmeguid AE, Whitlow PL, Simpfendorfer C, et al. Percutaneous revascularization of ostial saphenous vein graft stenoses. J Am Coll Cardiol 1995;26:955-60. 95)Ahmed JM, Hong MK, Mehran R, et al. Comparison of debulkin followed by stenting versus stenting alone for saphenous vein graft aortoostial lesions: immediate and one-year clinical outcomes. 2000;35:1560-68. 96)Gruberg L, Hong MK, Mehran R, et al. In-hospital and longterm results of stent deployment compared with balloon angioplasty for treatment of narrowing at the saphenous vein graft distal anastomosis site. Am J Cardiol 1999;84:1381-8.
Scaricare