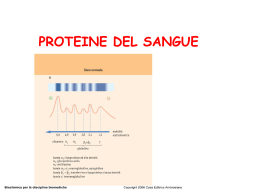
Corso di interpretazione clinica degli esami ematochimici di base Studio delle proteine plasmatiche e protidogramma Dott.ssa C.Conticello Catania, 11/06/2013 PROTEINE PLASMATICHE Le proteine del plasma costituiscono un gruppo eterogeneo di proteine, con funzione specifica o diverse funzioni e la cui concentrazione (da pochi microgrammi ad alcuni grammi per litro) è soggetta a specifiche variazioni di concentrazione in svariate condizioni fisiologiche e patologiche. Gli intervalli di riferimento normali per le proteine del siero sono tra 63 e 84g/L. Tali valori non sono costanti ma differiscono per età, sesso, momento della giornata, stato di veglia o di sonno, esercizio fisico, stagioni calde e stagioni fredde. I livelli plasmatici fisiologici dipendono dalla sintesi, dal catabolismo, dalla diminuzione delle proteine nei vari compartimenti corporei e da perdite esterne. Le plasmaproteine vengono sintetizzate principalmente dal fegato, in particolare l’albumina, il fibrinogeno e le globuline, ad eccezione delle immunoglobuline che vengono prodotte dal sistema immunitario (plasmacellule). Contribuiscono alla sintesi anche l’intestino per le lipoproteine ed il sistema monocito/macrofagico per alcuni fattori del complemento. Il metabolismo delle proteine è rapido ed intenso: viene giornalmente rinnovato, in condizioni fisiologiche, il 9% di tutte le proteine sintetizzate dal fegato ed il 10-25% di quelle circolanti. Anche nel catabolismo gioca un ruolo fondamentale il fegato. In condizioni fisiologiche le perdite (esterne) avvengono attraverso l’apparato gastroenterico (tutte le proteine), il rene (selettivo), le ghiandole esocrine, l’apparato respiratorio e gli organi genitali. O’Connel et al, aafp 2005 PROTEINE PLASMATICHE Vengono classificate: in base alla funzione: - trasporto di nutrienti (albumina, lipoproteine), di ioni metallici (trasferrina, ceruloplasmina), di ormoni (TBG, transcortina, RBP), altro… (aptoglobina). - difesa (complemento, immunoglobuline, inibitori enzimatici, della fase acuta). - emostasi e coagulazione ( fibrinogeno, plasmina). Sono queste funzioni specifiche cui si associano gli effetti sull’ Equilibrio idrico (attraverso il mantenimento della pressione oncotica), Effetto tampone (anfotere), Funzione catalitica, Riserva proteine corporee. ….in base alla migrazione elettroforetica (albumina, alfa1, alfa2, beta1,beta2, gamma) proteine PROTEINE PLASMATICHE -in base alla migrazione elettroforetica (albumina, alfa1, alfa2, beta, gamma) Poiché i metodi di separazione e di misurazione impiegati rispecchiano in prevalenza aspetti molecolari, chimici, fisici o la loro funzione, un’identica sostanza viene molte volte, a seconda delle circostanze e del metodo impiegato, denominata in diversi modi: macroglobulina, immunoglobulina M, -globulina, glicoproteina. E’ quindi importante lo studio delle caratteristiche strutturali, metaboliche e funzionali delle numerose proteine del plasma e delle loro variazione genetiche. A) Caratteristiche chimiche: proteine semplici, glicoproteine, lipoproteine Frazionamento Per ultracentrifugazione (precipitazione frazionata (massa, forma, densità, con sali o solventi organici) coefficiente di frizione) Tecniche immunochimiche (nef-turb) Immunofissazione Metodi qualitativi Metodi quantitativi B) Caratteristiche chimico-fisiche: solubilità, sedimentazione, carica elettrica Migrazione elettroforetica Immunoelettroforesi e. bidimensionale Metodi quantitativi Nella precipitazione frazionata mediante aggiunta di solfato di ammonio, si esprime la concentrazione del sale come % DI SATURAZIONE Le proteine del plasma possono essere così suddivise: a) GLOBULINE (33%) b) ALBUMINA (60%) c) FIBRINOGENO. Presente in quantità inferiori alle prime due ed è meno solubile. Nel siero presente solo in tracce Frazionamento secondo Chon, ottenuto con alcool etilico a bassa temperatura. Variando la concentrazione di etanolo e la temperatura, le diverse proteine possono essere precipitate in differenti frazioni Frazione I Frazione V fibrinogeno 60% globulina antiemofilica (fattore VIII) globuline insolubili a freddo protrombina componente C1q, C1r, C1s Frazione II Frazione III gammaglobuline 95% betaglobuline 60% (e betalipoproteine) isoagglutinine, immunoglobuline M, alfa2 macroglobulina protrombina e plasminogeno Frazione IV transferrina aptoglobina ceruloplasmina globulina legante gli ormoni tiroidei alfa1antitripsina alfa1glicoproteina antitrombina III componenti del Complemento albumina 95% alfa1glicoproteina alfa e beta globuline Metodi quantitativi Immunofissazione Tecnica di DOSAGGIO IN SITU Consiste nel fissare le CM (catene pesanti e leggere) in situ (lastrine di agarosio) mediante specifici antisieri e poi colorarle dopo aver rimosso tutte le altre bande non fissate, permettendo l’identificazione di una banda. Si esegue su siero e su urine. G A M k Immunofissazione su siero λ MIGRAZIONE ELETTROFORETICA Le proteine sono sostanze anfotere, cioè si possono comportare da acido, liberando ioni H+ , o da base liberando anioni OH-. Inoltre modificano le cariche elettriche dei loro residui chimici ionizzabili a secondo del mezzo in cui sono sciolte. In soluzione sono facilmente ionizzabili e si dissociano in ioni R-COO- (Asp, Glu) o ioni R-NH3+ (Lys, Arg). L'elettroforesi è una tecnica analitica e separativa basata sul movimento di particelle elettricamente cariche immerse in un fluido per effetto di un campo elettrico applicato mediante una coppia di elettrodi al fluido stesso. Le particelle con carica positive si spostano verso il catodo e quelle con carica negativa verso l'anodo. Può essere di diversi tipi: -libera: in un mezzo liquido -zonale: su un supporto solido (carta, cellulosa, poliacrilamide, agarosio) MIGRAZIONE ELETTROFORETICA anodo - catodo * le proteine sono evidenziate mediante una colorazione specifica, e la loro composizione percentuale è misurata mediante densitometria. + MIGRAZIONE ELETTROFORETICA Da ricordare che: •L’intensità del picco non corrisponde alla quantità delle proteine perché ogni colorante possiede affinità diversa per le diverse proteine •La proteina che principalmente contribuisce ad una data frazione non è la sola che migra in quella zona, ad eccezione dell’albumina, che può essere considerata unica. L’elettroforesi delle proteine del siero, su acetato di cellulosa o su agarosio, e’caratterizzata da una ottimale separazione e risoluzione di 7 bande elettroforetiche. CLASSIFICAZIONE DELLE PROTEINE SELEZIONATE IN BASE ALLA MOBILITA’ ELETTROFORETICA O’Connel et al, aafp 2005 1. banda della prealbumina 2. banda dell’albumina 3. banda 1 1-antitripsina 1-glicoproteina acida 1-antichimotripsina 1-lipoproteina (HDL) 1-fetoproteina4. 4. banda 2 2-macroglobulina (anodica) aptoglobina (catodica) ceruloplasmina proteina legante la vit.D (globulina GC) 5. banda 1 transferrina 1-lipoproteine (LDL) 6. banda 2 C3 2-microglobulina emopessina fibrinogeno (talvolta in zona ) 7. zona immunoglobuline (IgM ed IgA talvolta in zona 2) globuline prealbumina Proteine totali Albumina Globuline α1 α2 β1 β2 γ1 γ 2 Concentrazione 35-50 0.6-1.5 0.4-3.4 2.1-4.9 2.1-4.9 2.5-7.1 50-64 2.1-4.6 6.1-12 6-10.1 2.7-6.5 11.7-19.90 α1globuline AT-III Fibrinogeno Transcortina Fattore IX β2 microglobulina Fattori della coagulazione II, VII, X Aptoglobina Plasminogeno Immunoglo buline ceruloplasmina Fattore V Fattore XI Transferrina C8, C1q g/L Percentuale Proteine Emopessina C3, C6, C7 Proteina C reattiva PROTEINE PLASMATICHE Gli intervalli di riferimento normali per le proteine del siero sono tra 63 e 84g/L. Valori> 90: iperproteinemia, valori < 60 : ipoproteinemia Aumento : emoconcentrazione, gammopatie mono e policlonali. Diminuzione : Insufficiente apporto Digiuno prolungato,dieta ipoproteica. Ridotto assorbimento Vomito, diarrea, s.da malassorbimento Perdita S.nefrosica, enteropatie, ustioni estese, emorragie Ridotta sintesi Epatopatie acute e croniche Ipercatabolismo Ipertiroidismo, febbre,infezioni acute, traumi, interventi chirugici, neoplasie Emodiluizione Emorragie profuse, scompenso cardiaco congestizio, terapie idratanti Condizioni patologiche e modifiche delle proteine sieriche Albumina Globuline α1 Sindrome nefrosica ↓ Epatopatia cronica ↓ Infiammazione ↑ Anemia sideropenica α2 β γ ↑ ↑ ↓ ↓ ↑ ↑ ↓ ↑ Malattie autoimmuni (policlonali) ↑ Gammopatie monoclonali ↑ AIDS (policlonali) ↑ Enteropatia essudativa ↓ ↓ Proteine della fase acuta Positive Α1-antitripsina, -chimotripsina, -GP acida; Ceruloplasmina; aptoglobina, C3 e C4, ATIII, Ig Negative Albumina; Transferrina; Pre-albumina Indicazioni cliniche: Presenza di malattie infiammatorie Diagnosi differenziale tra patologie infiammatorie croniche Follow-up post-chirurgico nei pazienti a rischio post operatorio infettivo Follow-up dei pazienti onologici SINGOLE FRAZIONI PROTEICHE PREALBUMINA o TRANSTIRETINA: sintesi in parte nel fegato, in parte anche nella retina ed in altri tessuti. E’ il vettore sia per la tiroxina che per la proteina legante il retinolo. E’ una proteina negativa della fase acuta. ALBUMINA: MW 66,5 kDa. Il dosaggio dell’albumina è un ottimo indice della funzionalità epatica. E’ una proteina di trasporto (bassa specificità ed affinità, farmaci, bilirubina, acidi grassi, metalli ed ormoni). Contribuisce alla pressione osmotica. La concentrazione plasmatica dell’albumina diminuisce nei processi infiammatori, ustioni, epatopatie e nefropatie, malassorbimento, enteropatie protido-dispersive. Edema, ipocalcemia, alterazione nei livelli di sostanze trasportate BANDA 1 1-ANTITRIPSINA: GP. In circolo costituisce la maggiore componente delle proteasi circolanti. E’ sintetizzata dagli epatociti in forma immatura, dai macrofagi ma anche in altri tessuti (rene, pancreas, stomaco, intestino, milza, surrene). 1-ANTICHIMOTRIPSINA: GP. Inibisce la chimotripsina pancreatica. Protegge l’organismo dai processi infiammatori (polmoni e bronchi) e dai danni tessutali, modula la risposta immune proteggendo da reazioni allergiche. Uno sdoppiamento raro della banda può essere dovuto ad elevati livelli di 1-fetoproteina, i quali, dopo il secondo anno di vita, sono indicatori di epatiti evolutive, carcinoma epatico BANDA 2 2-MACROGLOBULINA: GP. Sintetizzata dal fegato. Modulatore dell’attività delle citochine. Aumenta fisiologicamente nel 3° trimestre della gravidanza, nell’infanzia e nell’età avanzata. Aumenti patologici si hanno nell’infiammazione acuta, nelle epatopatie, nel diabete. APTOGLOBINA: GP. Lega l’emoglobina libera (in modo forte ed irreversibile).La sua concentrazione aumenta dalla nascita fino all’età adulta. Diminuisce per iperconsumo in tutti i casi di emolisi intravascolare e per difetto di sintesi in condizione di riduzione del numero di epatociti. Può diminuire anche in seguito a sport prolungati, che comportano distruzione di eritrociti. E’ una proteina della fase acuta. CERULOPLASMINA: GP. Maggiore proteina di trasporto plasmatico del rame. La sua sintesi avviene nel fegato. Diminuisce nel morbo di Wilson. PROTEINA TRASPORTATRICE DELLA VITAMINA D BANDA 1 TRANSFERRINA: GP. Lega e trasporta in modo reversibile lo ione ferrico. Aumenta nelle sideropenie e diminuisce negli accumuli di ferro. Le funzioni principali della transferrina sono:-trasporto di ferro assorbito dall’intestino alle cellule che lo richiedono; -fattore protettivo contro cellule batteriche e neoplastiche in quanto compete con esse per l’utilizzo di ferro. BANDA 2 C3: proteina della fase acuta che si eleva molto lentamente e richiede 2-10 giorni per raggiungere il massimo livello dopo un’infiammazione. EMOPESSINA: GP. Lega il gruppo eme libero in rapporto 1:1 e lo trasporta al fegato, dove l’eme entra nella cellula e libera il ferro che è riutilizzato. 2-MICROGLOBULINA: costituisce la catena leggera degli antigeni del complesso maggiore di istocompatibilità (MHC) e si trova sulla superficie di tutte le cellule che esprimono questo antigene. ZONA E’ costituita dalle diverse classi delle immunoglobuline. A causa della loro eterogeneità, le immunoglobuline si estendono dalla regione a quella e talvolta occupano anche la zona . Le Ig sono l’espressione dell’attività secretoria di diversi cloni plasmacellulari Riduzione: IPOGAMMAGLOBULINEMIA AGAMMAGLOBULINEMIA Legata al sesso Più frequenti quelle acquisite. Negli adulti e negli anziani deve far sospettare una malattia Immunoproliferativa (linfoma) ZONA Aumento: IPERGAMMAGLOBULINEMIA POLICLONALE Tutte le malattie croniche infettive, collagenopatie, malattie autoimmuni. Utile seguire il decorso delle epatiti acute virali e di alcune malattie autoimmuni tipo LES e artrite reumatoide GAMMAPATIA MONOCLONALE comparsa in zona - di una banda stretta, che può essere rilevata come picco al Albumina Globuline α1 α2 β1 β2 densitogramma quando presente al di γ sopra di 1g/L. LE GAMMAPATIE MONOCLONALI La proliferazione di un singolo clone plasmacellulare con produzione di un’unica classe, sottoclasse, idiotipo di immunoglobulina, detta monoclonale. La presenza di Ig patologiche si mette in evidenza all’elettroforesi del siero come una banda netta che nella maggior parte dei casi si trova in zona , da qui il nome di gammapatia monoclonale alla malattia e di componente monoclonale della proteina (CM). Il termine CM si riferisce quindi a qualunque banda immunoglobulinica che presenti le caratteristiche d’una mobilità elettroforetica e sia costituita da un solo tipo di catena pesante e da un solo tipo di catena leggera. La frequenza è 1-2% nella popolazione al di sopra dei 25 anni ed aumenta al 3-7% negli ultrasettantenni. Il rischio di progressione in mieloma è dell’1% all’anno la presenza di un picco a banda stretta nella regione gamma indica una gammapatia monoclonale. La gammapatia monoclonale è associata ad una proliferazione clonale maligna o potenzialmente tale che rientra nella diagnosi di MM, macroglobulinemia di Waldenström, plasmacitoma solitario, MM smoldering, MGUS, PCL, HCD, LCDD, AL. L’ELETTROFORESI su acetato di cellulosa e su gel di agarosio è la tecnica essenziale per il riconoscimento di una CM. E’ possibile effettuare una quantificazione e la tipizzazione delle Ig e delle catene leggere della CM. Per il DOSAGGIO IN FASE LIQUIDA si possono usare la nefelometria (reazione Ag-Ab con deviazione del fascio di luce del nefelometro (scatter) tanto maggiore quanto più numerosi e più grandi sono i complessi e quindi la concentrazione della proteina) o la turbidimetria (tecnica in assorbimento che utilizza un normale spettrofotometro). Per il DOSAGGIO IN SITU si utilizza l’IMMUNOFISSAZIONE Consiste nel fissare le CM (catene pesanti e leggere) in situ (lastrine di agarosio) mediante specifici antisieri e poi colorarle dopo aver rimosso tutte le altre bande non fissate, permettendo l’identificazione di una banda Una volta sorto il sospetto di gammapatia monoclonale bisogna quantificare la proteina M con IFE siero ed urine. Le immunoglobuline sintetizzate dalle plasmacellule maligne in ordine di frequenza nel siero sono: •IgG (70%) • IgA(20%) •IgM (1%) •λ • IgD • IgE MGUS, MM, macroglobulinemia di Waldenström, plasmacitoma solitario, MM smoldering, PCL, HCD, LCDD, AL. MIELOMA MULTIPLO Il mieloma multiplo è la forma più comune di neoplasia plasmacellulare nell’uomo. Produce in genere un’immunoglobulina monoclonale ed un eccesso di catene leggere libere. Le Ig possono appartenere a tutte le classi di Ig con frequenza corrispondente al loro normale contenuto serico (mieloma secernente, oligosecernente) La maggior parte dei pazienti hanno una proteina M rilevabile ma l’ 1-3% ha un mieloma non secernente Circa il 20% dei pazienti produce solo catene leggere non rilevabili nel siero poiché passano attraverso i glomeruli e vengono escrete con le urine. Si parla in tal caso di mieloma Micromolecolare o mieloma di Bence Jones in cui la componente sierica è costituita da sole catene leggere in forma di monomeri, dimeri o trimeri. Beetham et al, ann clin biochem 2000 Le plasmacellule normalmente producono un eccesso di catene leggere che non si legano alle catene pesanti per formare una molecola Ig completa e si ritrovano nel sangue come catene leggere libere (sFLC). Ciò avviene anche per le PC maligne. Il monitoraggio delle sFLC è parte integrante della diagnostica e del decorso delle discrasie plasmacellulari. Tosi et al, tah 2013 The International Myeloma Working Group (IMWG) recommends: - a complete history taking and physical examination; - routine laboratory testing including serum protein electrophoresis (SPEP), serum immunofixation electrophoresis (SIFE), nephelometric quantitation of immunoglobulins, and measurement of serum FLCs (SFLCs); - bone marrow aspiration and biopsy with immunophenotyping, conventional cytogenetics, and fluorescence in situ hybridization; -and imaging. Il nuovo test Freelite™ della Binding Site (USA), utilizzato con il nefelometro BN™ II, permette un’ accurata e rapida quantificazione delle flc nel siero, nell’ urina e nel liquor. Il nefelometro è in grado di quantificare solo le flc senza determinare anche le catene leggere legate alla catena pesante dell’Ab. Ciò è reso possibile grazie alla presenza di Ab specifici che legano esclusivamente le flc (Ag). Brebner et al, rep-med 2013 Il saggio SFLC (Freelite™ Assay, The Binding Site Ltd., Birmingham, United Kingdom) è stato introdotto nel 2001. Esso riconosce un epitopo presente solo sulle catene leggere delle Ig nel siero. E’ l’unico test approvato dalla U.S. Food and Drug Administration ed è classificato come un test immunologico sulle catene leggere. Misura k e l separatamente rilevandone basse concentrazioni (meno di 1 mg/dL nel siero e meno di 200 mg/day nelle urine). Il vantaggio maggiore è il calcolo del rapporto kappa/ lambda per cui il range diagnostico è 0.26–1.65. Un rapporto alterato è utile indice di clonalità, poiché un disordine clonale produce elevate concentrazioni di un tipo solo di catene leggere. Si ritiene che questo saggio potrebbe avere un ruolo aggiuntivo nello screening, nella diagnosi, nel monitoraggio e nella prognosi delle PCD nella pop. Ad alto rischio.Oltre la rilevanza in Fase diagnostica e nel monitoraggio durante la terapia potrebbero anche essere l’unico marcatore della malattia in alcuni casi (MM non secernente; AL; LC MM) •Sindrome di Fanconi: depositi di catene k nel tubulo prossimale e presenza di catene k nelle urine e dolore (1/14 evolve in MM) •Sindrome POEMS: Isotipo L. VEGF (Policlinico San Matteo di Pavia-siero separato da provetta tappo rosso senza gel messo in un eppendorf). •MM IgM: 1%. IFT. •Malattia da emoagglutinine fredde: IgMk. Emolisi extravascolare. Anemia. Cercare le agglutinine fredde con un titolo >1:64 A 4 GRADI. •AL IgM: 5%, associata a catene l. Biopsia del nervo surale se neuropatia. R. •Scleromixedema: 1-eruzione generalizzata papulare o sclerodermoide; 2-depositi di mucina e fibrosi; 3-gammapatia monoclonale IgG (l); 4-assenza di patologia tiroidea. Conclusioni -Porre attenzione nella lettura al protidogramma delle singole bande raccogliendo una storia clinica completa del paziente - Di fronte un picco monoclonale fare ulteriori approfondimenti -Ricordare i nuovi test (sFLC) -Tenere a mente i casi rari Grazie dell’attenzione Diagnosi differenziale di alterazioni del protidogramma
Scaricare