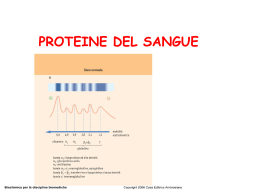
Appunti di BIOCHIMICA – a cura di fabio Zonin 4 - IL SANGUE IL SANGUE Il sangue è un sistema di trasporto e distribuzione attraverso il corpo. Esso rifornisce i tessuti di nutrienti essenziali e O2 e contemporaneamente rimuove i prodotti di scarto. Il sangue è composto da una soluzione acquosa contenente molecole di diverse dimensioni ed elementi cellulari. Alcuni di questi componenti hanno un ruolo fondamentale nella difesa contro attacchi esterni e nella riparazione di tessuti danneggiati. PLASMA E SIERO Il plasma è il supernatante ottenuto dalla centrifugazione di un campione di sangue, trattato con un anticoagulante, oppure lasciato coagulare (tempo richiesto: 35-40 minuti) e successivamente centrifugato. Gli anticoagulanti più comuni sono la litio-eparina e l’acido etilendiaminotetracetico (EDTA EDTA). EDTA L’eparina impedisce la coagulazione legando la trombina, l’EDTA ed il citrato legano gli ioni Ca2+ e Mg2+ interferendo con gli enzimi Ca/Mg dipendenti che convertono protrombina e tromboplastina in trombina. Quando il sangue + raccolto per una trasfusione si utilizza preferenzialmente il citrato come anticoagulante perché esso non altera i valori della coagulazione ed i suoi efetti sono annullati da Ca. durante la coagulazione il fibrinogeno è convertito in fibrina per l’azione proteolitica della trombina, perciò la principale differenza fra plasma e siero è l’assenza del fibrinogeno in quest’ultimo. Il plasma è l’ambiente naturale delle cellule del sangue, ma molte analisi chimiche vengono effettuate sul siero. siero ELEMENTI FIGURATI DEL SANGUE 35 4 - IL SANGUE Appunti di BIOCHIMICA – a cura di fabio Zonin Eritrociti Non sono classificati come vere e proprie cellule in quanto non possiedono il nucleo e gli organuli intracellulari. Essi sono infatti residui cellulari contenenti specifiche proteine e ioni, presenti in concentrazioni anche molto elevate. Gli eritrociti sono il prodotto finale dell’eritropoiesi del midollo osseo, un processo regolato dall’eritropoietina prodotta dai reni. L’emoglobina è sintetizzata dai precursori degli eritrociti, gli eritroblasti e i reticolo citi, tramite un processo controllato dalla concentrazione dei gruppi eme, la cui sintesi comporta il legame con un atomo di ferro in forma ridotta (Fe Fe2+) ai 4 atomi di N dell’anello porfirinico dell’eme. Gli eritrociti trasportano O2 e rimuovono CO2 e ioni H+. Non avendo organuli intracellulari, gli eritrociti non sono in grado di sintetizzare proteine, ed hanno perciò un tempo di vita limitato a circa 60-120 giorni, trascorsi i quali vengono catturati e distrutti nella milza. Leucociti La loro principale funzione è di proteggere l’organismo dalle infezioni. La maggior parte dei leucociti è prodotta nel midollo osseo, alcuni nel timo, mentre altri maturano all’interno di tessuti diversi. I leucociti possono controllare la loro stessa produzione secernendo nel sangue peptidi segnale che successivamente agiscono sulle cellule staminali del midollo osseo. I leucociti hanno la capacità di migrare al di fuori del circolo sanguigno verso i tessuti. Trombociti I trombociti o piastrine non sono vere e proprie cellule, bensì frammenti cellulari derivati dai megacariociti che risiedono nel midollo osseo. Le piastrine giocano un ruolo chiave nella coagulazione del sangue. LE PROTEINE DEL PLASMA Le proteine del plasma possono essere classificate in 2 gruppi: quelle sintetizzate dal fegato, fegato fra cui l’albumina albumina, albumina e quelle prodotte prodotte dalla plasmacellule nell’ambito della risposta immunitaria, immunitaria le immunoglobuline. immunoglobuline Molte proteine plasmatiche sono in grado di legare particolari molecole con alta affinità e specificità. Tali proteine agiscono come riserva di queste molecole e, trasportandole ai tessuti, ne controllano la disponibilità e la distribuzione. Il legame ad una proteina plasmatica può rendere un composto tossico meno nocivo per i tessuti. La funzione del laboratorio di analisi chimico fisiche Il laboratorio esegue un elevato numero di analisi biochimiche sui liquidi corporei, che possono fornire risposte a specifici problemi clinici riguardanti il paziente. Le analisi sono dunque richieste come aiuto nella formulazione della diagnosi o per il trattamento di specifiche condizioni. La maggior parte dei campioni analizzati da un laboratorio sono mediamente costituiti da sangue od urine. Alcune analisi sono effettuate sul sangue intero, mentre per la determinazione della maggior parte delle molecole e degli ioni è preferibile utilizzare il plasma o il siero. 36 Appunti di BIOCHIMICA – a cura di fabio Zonin 4 - IL SANGUE PROTEINE DI TRASPORTO E LORO LIGANDI PROTEINE LIGANDI LEGANO I CATIONI Albumina Cationi bivalenti e trivalenti (Cu2+,Fe3+) Ceruloplasmina Cu2+ Transferrina Fe3+ LEGANO GLI ORMONI Globulina che lega gli ormoni tiroidei (TBG) Tiroxina (T4), Tri-iodotironina (T3) Globulina che lega il cortisolo (CBG) Cortisolo Globulina che lega gli ormoni sessuali (SHBG) Androgeni (testosterone), Estrogeni (estradiolo) LEGANO EMOGLOBINA/PROTOPORFIRINA Albumina Eme, bilirubina, biliverdina Aptoglobina Dimeri di emoglobina LEGANO GLI ACIDI GRASSI LIBERI Albumina Acidi grassi liberi, steroidi Albumina Rappresenta il 50% (circa 35-45 g/l) delle proteine del plasma ed è la principale proteina plasmatica priva di funzioni enzimatiche od ormonali. È una delle più piccole proteine del plasma, con un peso molecolare di circa 66 KDa. Data la sua natura polare è estremamente solubile in acqua. A pH 7,4 l’albumina è un anione con circa 200 cariche negative per molecola; questa caratteristica consente all’albumina di interagire con numerosi ligandi. L’albumina è presente in grosse quantità nell’organismo (4-5 g/Kg di peso corporeo) e circa il 38% è localizzato nel sistema vascolare; essa gioca dunque un ruolo chiave nel controllo della pressione osmotica. L’albumina è caratterizzata da una velocità di sintesi di circa 1415g/giorno, strettamente influenzata dallo stato nutrizionale, in particolare dalla disponibilità di aminoacidi. Il tempo di vita dell’albumina è di circa 20 giorni, e la sua degradazione avviene mediante pinocitosi a livello di tutti i tessuti. L’albumina, oltre a essere una proteina di riserva in condizioni di digiuno ed un importante regolatore dell’osmolarità, dell’osmolarità è anche la principale proteina di trasporto. trasporto Essa è infatti la principale proteina plasmatica responsabile del trasporto di acidi grassi idrofobici, idrofobici bilirubina e farmaci. farmaci L’albumina rende infatti solubile in fase acquosa una serie di sostanze eterogenee, fra cui gli acidi grassi a catena lunga, gli steroli e svariati composti sintetici. Attraverso il legame l’albumina facilita infatti la solubilizzazione ed il trasporto di acidi grassi altamente idrofobici quali l’acido stearico, l’acido oleico e l’acido palmitico. L’albumina lega anche la bilirubina, trasportandola dal sistema reticolo-endoteliale al fegato e neutralizzandone contemporaneamente i possibili effetti tossici. L’albumina è inoltre in grado di legare numerosi farmaci, quali i saliciati, i barbiturici, i sulfamidici, la penicillina e la warfarina. Essendo generalmente le interazioni fra albumina e farmaco deboli, i farmaci legati possono essere rilasciati da sostanze che competono per il sito di legame. L’albumina favorisce dunque non solo la solubilizzazione del farmaco, ma ne regola anche la quantità in forma libera e quindi farmacologicamente attiva. L’albumina non è comunque essenziale per la sopravvivenza umana. 37 4 - IL SANGUE Appunti di BIOCHIMICA – a cura di fabio Zonin Proteine che trasportano ioni metallici Inel plasma il ferro è trasportato come ione ferrico (Fe Fe3+) in forma legata alla transferrina. transferrina Il complesso ferro-fransferrina si lega poi ad uno specifico recettore cellulare, viene internalizzato e, successivamente, il ferro è liberato nel citosol. Nella cellula il ferro può essere utilizzato nella sintesi di proteine contenenti il gruppo eme o può essere depositato in siti di accumulo sottoforma di ferritina o emosiderina. Il legame del Fe3+ alla transferrina svolge un’azione protettiva nei confronti degli effetti tossici di questo ione. Ferritina È il principale composto deputato all’accumulo di ferro in quasi tutte le cellule del corpo. Nel fegato e nel midollo osseo la ferritina funziona come una riserva di ferro. Nel plasma la concentrazione di ferritina è proporzionale alla quantità di ferro accumulato e pertanto la valutazione della ferritina plasmatica è uno dei migliori indicatori di carenza di ferro. Emosiderina È un derivato della ferritina e si trova nel fegato, nella milza e nel midollo osseo. Non è solubile in acqua e forma aggregati che rilasciano lentamente il ferro in caso di carenza di questo ione. Ceruloplasmina È la principale proteina di trasporto per il rame. Essa partecipa al trasporto del rame dal fegato ai tessuti periferici, ma è anche essenziale in altri processi quali la regolazione di reazioni di ossidoriduzione e il trasporto e l’utilizzazione del ferro. Immunoglobuline Le immunoglobuline sono proteine prodotte in risposta a sostanze estranee, gli antigeni. antigeni Il sistema immunitario è costituito da 2 entità diverse che coinvolgono linfociti diversi: i linfociti T, T derivanti dal timo, che sovraintendono alla risposta immunitaria cellulocellulo-mediata ed hanno una funzione regolatoria, ed i linfociti B che producono e secernono gli anticorpi (immunoglobuline immunoglobuline). immunoglobuline Gli anticorpi sono proteine sintetizzate dal sistema immunitario che presentano una particolare specificità per una sostanza estranea (immunogeno immunogeno) immunogeno che ne ha stimolato la sintesi. Tutte le sostanze in grado di stimolare la sintesi degli anticorpi sono denominate immunogeni, mentre qualsiasi altra molecola che può essere legata da un anticorpo prende il nome di antigene. Le immunoglobuline sono un gruppo eterogeneo di molecole, in grado di riconoscere e reagine con una’ampia varietà di antigeni specifici (epitopi epitopi) epitopi per dare origine ad una cascata di eventi che comportano l’eliminazione dell’antigene stesso. Alcune immunoglobuline hanno anche altre funzioni aggiuntive; ad esempio le IgG sono coinvolte nell’attivazione del complemento. 38 Appunti di BIOCHIMICA – a cura di fabio Zonin 4 - IL SANGUE Struttura delle immunoglobuline Tutte le immunoglobuline presentano una struttura simile, a forma di Y, composta da 2 catene pesanti e 2 catene leggere. Le immunoglobuline contengono 2 subunità identiche chiamate catene pesanti (catene catene H) H e 2 subunità identiche fra loro, ma più piccole delle catene H, chiamate catene leggere (catene catene L). L esistono diversi tipi di catene H che contraddistinguono diverse classi di immunoglobuline: IgG, IgA, IgM, IgD e IgE, che presentano rispettivamente la catene H di tipo γ, α, µ, δ, ed ε. Le catene L sono invece solo di 2 tipi, chiamati κ e λ. Entrambe possono essere presenti in ciascuna classe di Ig, ma ciascuna molecola di Ig contiene catena L dello stesso tipo. I domini N-terminali delle catene H ed L presentano una regione con sequenza aminoacidica variabile (regione regione V), V da cui combinazione deriva la specificità antigenica. Entrambe le regioni H e L sono indispensabili per l’attività dell’anticorpo, poiché le regioni V delle catene H e L sono fisicamente vicine e formano una tasca funzionale nella quale si adatta l’epitopo. Questa regione della molecola è chiamata regione di riconoscimento dell’antigene (Fab2). Il dominio immediatamente adiacente alla regione V è, sia nelle catene H che L, molto meno variabile. La rimanente Parte della catena H presenta un’altra regione costante (regione regione Fc), Fc costituita da una porzione con funzione di cerniera e da altri 2 domini. Questa regione costante è responsabile dell’attivazione del complemento. In seguito al legame di un antigene all’immunoglobulina, un cambio di conformazione viene trasmesso, attraverso la regione di cerniera, alla regione Fc, che viene attivata. Principali immunoglobuline IgG - Sono le immunoglobuline più comuni, proteggono gli spazi intratissutali e sono in grado di passare liberamente attraverso la placenta. placenta Hanno una massa molecolare di circa 160 KDa ed hanno una struttura composta da 2 catene H e 2 catene L unite fra loro da un numero variabile di ponti disolfuro. Le varie catene H di tipo γ presentano diversità strutturali e antigeniche, cosicché le IgG sono distinte in varie sottoclassi in funzione del tipo di catena γ presente. Le IgG rappresentano circa il 75% delle Ig presenti negli adulti ed hanno una vita media di 22 giorni. Esse sono presenti in tutti i fluidi extracellulari e mediano l’eliminazione di piccole proteine antigeniche solubili mediante la formazione di aggregati che inducono la successiva fagocitosi da parte del sistema reticolo-endoteliale. A partire dalla 18°-20° settimana di gravidanza le IgG sono trasportate attivamente attraverso la placenta e forniscono l’immunità umorale al feto ed al neonato prima della maturazione del proprio sistema immunitario. IgA - Sono ampiamente presenti nelle secrezioni e rappresentano una barriera antisettica di protezione per le mucose. mucose Esse hanno una catena H simile alla catena di tipo γ delle IgG e la catene di tipo α possiedono una regione addizionale di 18 aminoacidi all’estremità C-terminale che permette il legame di una catena di giunzione (catena catena I). I questo piccolo polipeptide acido di 129 aminoacidi è sintetizzato dalla plasmacellule e permette la formazione di dimeri di IgA di secrezione. Spesso le IgA sono associate in modo non covalente anche ad un polipeptide di 71 KDa ampiamente glicosilato, detto componente secretoria., sintetizzato dalla cellule delle mucose ed in grado di proteggere le IgA dalla digestione proteolitica. Le IgA rappresentano il 7-15% delle 39 4 - IL SANGUE Appunti di BIOCHIMICA – a cura di fabio Zonin Ig del plasma ed hanno una vita media di 6 giorni. Sono presenti, soprattutto in forma dimerica, nelle secrezioni intestinali, bronchiali e delle ghiandole parotidi, e rappresentano uno dei componenti principali del colostro. Le IgA rappresentano una prima barriera immunitaria contro l’invasione delle membrane delle mucose da parte di agenti patogeni, inducono la fagocitosi, causano la de granulazione degli eosinofili, e attivano il complemento. IgM - Sono presenti solo nello spazio intravascolare e partecipano all’eliminazione di antigeni circolanti e di microorganismi. Le IgM sono polivalenti ed hanno un elevato peso molecolare. Esse hanno una struttura generale simile alle IgA, ma presentano un dominio aggiuntivo sulle catene H che permette il legame di catene J che conferiscono alle IgM la capacità di polimerizzare. Le IgM normalmente circolano come pentameri uniti sia da ponti disolfuro che da catene J, ed aventi una massa molecolare di circa 971 KDa . le IgM rappresentano il 5-10% delle Ig circolanti ed hanno una vita media di 5 giorni. A causa della loro natura polimerica e della loro massa molecolare, esse sono presenti quasi esclusivamente nello spazio intravascolare. Le IgM sono i primi anticorpi che vengono sintetizzati in seguito ad uno stimolo antigenico. IgD - Rappresentano recettori di superficie per gli antigeni sui linfociti BB. Esse si differenziano dalle altre immunoglobuline per il lor elevato contenuto di carboidrati dovuto alla presenza di numerose catene oligosaccaridi che causano un aumento della loro massa molecolare fino a 190 KDa. Le catena H di tipo δ sono caratterizzate dalla presenza di un solo ponte disolfuro intercatena e da una regione cerniera particolarmente lunga e sensibile alla proteasi. Le IgD rappresentano meno dello 0,5% delle Ig circolanti e la loro funzione non è ancora completamente nota. Rappresentano un componente di membrana delle cellule B mature, ed è dunque probabile che esse giochino un ruolo nella risposta agli antigeni. IgE – Sono presenti solo in tracce, legano l’antigene e promuovono il rilascio di amine vasoattive da parte dei mastociti. Le igE presentano una catena H particolare di tipo ε costituita da 5, anziché 4 domini. Le IgE non legano le catene J e non polimerizzano. In virtù della lunghezza delle catene H hanno una massa molecolare di circa 200 KDa. Le IgE interagiscono con alta affinità con recettori presenti su mastociti e sui basofili. Il legame delle regioni Fab2 con l’antigene induce l’oligomineralizzazione di questi recettori ed il conseguente rilascio di amine vasoattive dai granuli intracellulari. Le IgE hanno un ruolo fondamentale nei fenomeni allergici, nelle reazioni di ipersensibilità, e mediano l’immunità antiparassitaria. Immunoglobuline Immunoglobuline monoclonali monoclonali - Sono il prodotto della proliferazione clonale di una singola cellula B e derivano da tumori benigni o maligni di questa cellula. Ciò comporta la produzione di anticorpi identici. Il fatto che le immunoglobine monoclonali siano assolutamente identiche fra loro permette di individuare, mediante analisi elettroforetica seguita da colorazione delle proteine, una singola banda sottile e intensa nella regione gamma (banda della paraproteina). Le immunoglobuline monoclonali sono associate a diverse patologie maligne quali il mieloma e la macrobulinemia di Waldenstrom e sono osservabili in trasformazioni neoplastiche benigne generalmente indicate come gammopatie monoclonali di significato incerto (MGUS MGUS). MGUS LA REAZIONE DELLA FASE ACUTA DELLA DELLA PROTEINA CC-REATTIVA È una risposta non specifica a stimoli quali danni tissutali o infezioni e coinvolge diverso organi e tessuti. Durante la fase acuta si osserva una caratteristica serie di cambiamenti nell’espressione di alcune proteine. Si assite infatti, in particolare nel fegato, ad uno spiccato aumento della sintesi di alcune proteine, accompagnato dalla diminuzione delle concentrazione plasmatica di altre. L’aumento della sintesi di alcune proteine, quali gli inibitori di proteasi (α-antitripsina), fattori della coagulazione (fibrinogeno, protrombina), elementi del complemento e la proteina C-reattiva (CRP CRP), CRP offre un chiaro beneficio clinico. La sintesi di albumina, transtiretina (prealbumina) e transferrina diminuisce durante la reazione alla fase acuta, e partanto queste molecole sono indicate come elementi negativi della fase acuta. acuta La CRP è il principale componente della reazione della fase acuta 40 Appunti di BIOCHIMICA – a cura di fabio Zonin 4 - IL SANGUE ed un marcatore delle infezioni batteriche. Questa proteina è sintetizzata dal fegato, ha un peso molecolare di circa 130KDa ed è costituita da 5 subunità. Generalmente è presente in quantità molto piccole, (<1mg/l nel siero normale) ed è probabilmente coinvolta nel legame di sostanze estranee come polisaccaridi, fosfolipidi e complessi polianionici e nell’attivazione del complemento. Un test specifico per la CRP può evidenziare minime variazioni nella concentrazione della stessa. Variazioni molto piccole della CRP, molto più piccole di quelle che si osservano durante un’infezione acuta, sembrano essere correlate con uno stato di infiammazione cronica di basso grado che può essere associata, per esempio, ad un aumentato rischio di attacco cardiaco. Altre condizioni infiammatorie, come malattie intestinali, diabete di tipo 2 e le sindromi metaboliche conseguenti, aneurisma aortico addominale e prematura rottura delle acque durante il parto sono stati associati a queste piccole variazioni della concentrazione del CRP del siero. 41 4 - IL SANGUE Appunti di BIOCHIMICA – a cura di fabio Zonin 42
Scaricare