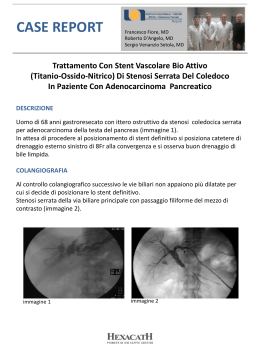
STENT PERIFERICO BIODEGRADABILE Ditta produttrice: KYOTO MEDICAL PLANNING Co., Ltd. – Kyoto- JAPAN Marchio CE: Il dispositivo medico e’ conforme alla Direttiva 93/42 CEE Marchio CE 2105289CE02 Classe di appartenenza: Classe III Ente certificatore: KEMA Medical – Kema Quality B.V. - Netherland Distributore per l’Italia Acilia HS srl Codice CND P0704020299 – Stent vascolari periferici altro Numero Repertorio D.M. Numero progressivo attribuito: 140586/R Presenza/Assenza lattice Prodotto LATEX FREE DESCRIZIONE REMEDY™ è un sistema composto da uno stent periferico caratterizzato dalla sua completa biodegradabilità, e un sistema di posizionamento “delivery” . Lo stent è realizzato con un polimero modificato di acido polilattico biodegradabile ed è dotato di due markes radiopachi , posizionati rispettivamente a 1.5 mm da ogni estremità visto che la natura del materiale lo rende completamente radiotrasparente Lo stent è montato su un pallone su cui è fissato per mezzo di una clip in PTFE posizionata all’estremità prossimale del pallone. Una guaina protettiva ricopre stent e sistema di posizionamento ed ha la funzione di proteggere lo stent durante l’avanzamento nell’anatonia. DESTINAZIONE D’USO Lo stent periferico REMEDY™ (endoprotesi vascolare) è destinato ad essere utilizzato per il trattamento di lesioni stenotiche, tra cui la dilatazione e il supporto dei vasi sanguigni nonché la prevenzione della restenosi, e per il trattamento e la prevenzione di occlusioni acute al fine di migliorare il flusso sanguigno periferico. Rev. n. 2 del 07.10 Pag. 1 CARATTERISTICHE TECNICHE ¾ STENT 1. 2. 3. 4. 5. Materiale: PLLA ( Acido Polilattico Medicale ) Design : elicoidale a zig zag Struttura di maglia: 0.24 mm Stent Deployment Pressure: 6 atm Rated Burst Pressure: 13 atm ¾ SISTEMA DI RILASCIO 1. 2. 3. 4. 5. Sistema OTW Balloon expandable Guaina di copertura e protezione dello stent: 7 F Lunghezza del delivery : 100 cm Compatibilità filo guida: 0.035” per le misure 5 e 6 mm x 36mm e 0.18” per tutte le altre misure 6. Markers del pallone: 2 markers in oro Rev. n. 2 del 07.10 Pag. 2 TABELLA DI COMPLIANZA DEL PALLONE DA PTA e Rated Burst Pressure Diametro del pallone Pallone Pallone Pallone Pallone ø ø ø ø 5 6 7 8 Legenda: mm mm mm mm Pressione di gonfiaggio ( ATM ) 4 5 6 7 8 9 10 11 12 13 14 15 16 4.72 4.88 5.00 5.12 5.23 5.31 5.37 5.44 5.50 5.55 5.61 5.66 5.72 5.68 5.83 6.00 6.14 6.25 6.34 6.41 6.48 6.54 6.60 6.65 6.70 6.76 6.58 6.78 7.00 7.18 7.35 7.46 7.59 7.69 7.81 7.91 8.02 8.12 8.21 7.44 7.75 8.00 8.23 8.44 8.58 8.72 8.85 8.96 9.06 9.18 9.29 Pressione Nominale Rated Burst Pressure ISTRUZIONI D’USO Per tutto quello che concerne le indicazioni, le controindicazioni e le avvertenze per l’uso, si rimanda al libretto di “istruzioni d’uso” contenuto all’interno di ogni singola confezione. COMPATIBILITA’ CON RISONANZA MAGNETICA NUCLEARE Al fine di ridurre al minimo i rischi di migrazione dello stent, le analisi di RMN non devono essere eseguite fino a quando lo stent non abbia subito una completa endotelizzazione. CONFEZIONAMENTO Lo stent Remedy® è confezionato in busta di Tyvek®/PE apribile a strappo, contenuto in scatola di cartone da una unità. STERILIZZAZIONE E DURATA Lo stent Remedy® è sterilizzato ad Ossido di Etilene, ha durata cinque mesi, è monouso, apirogeno e non risterilizzabile. Rev. n. 2 del 07.10 Pag. 3 SMALTIMENTO Dopo l’uso questo dispositivo risulta contaminato e deve essere smaltito secondo le disposizioni di legge relative allo smaltimento dei rifiuti clinici contaminati. MODALITA’ DI CONSERVAZIONE Il prodotto, in confezione integra, deve essere conservato in luogo fresco ed asciutto, evitando temperature estreme, umidità elevata e l’esposizione diretta al sole durante lo stoccaggio. Evitare l’esposizione a temperature superiori a 30°C, alla luce diretta e all’ acqua. CERTIFICAZIONE CE Marchio CE N. 2105289CE02 Il dispositivo medico è conforme alla direttiva 93/42 CEE , classe III CLASSIFICAZIONE CND Codice: P0704020299 – Stent vascolari periferici altro NUMERO DI REGISTRAZIONE NEL REPERTORIO DEI DISPOSITIVI MEDICI Numero progressivo attribuito: 140586/R CONTROINDICAZIONI ¾ Non riutilizzare il prodotto ¾ Non risterilizzare il prodotto ¾ Non usare il prodotto nei DISTRETTI VASCOLARI CAROTIDEI e CEREBRALI del corpo umano ¾ Categorie di pazienti per cui l’utilizzo dello stent periferico REMEDY™ è controindicato: • • • • Pazienti che presentino un aneurisma nell’area dell’occlusione o in prossimità della stessa Pazienti che presentano entrambe le arterie iliache comuni totalmente occluse Pazienti che presentino trombosi multipla acuta o subacuta in prossimità della lesione in oggetto Pazienti con stravaso di mezzo di contrasto e una possibile perforazione del vaso sanguigno Rev. n. 2 del 07.10 Pag. 4 • • • • • • • • • • Pazienti con una trombosi in prossimità del graft trapiantato Pazienti con controindicazioni alle terapie antipiastriniche e/o anticoagulanti Pazienti che presentino una lesione da trattare posizionata in prossimità o in corrispondenza di un aneurisma Pazienti con una lesione altamente calcificata resistente al pallone Pazienti aventi diatesi emorragiche che non rispondono ai trattamenti abituali Pazienti che presentino vasi estremamente tortuosi a livello dell’arteria iliaca tali da compromettere l’impianto dello stent. Pazienti con aneurismi addominali Pazienti con funzionalità renale ridotta Donne in gravidanza o in età fertile e non protette con metodi anticoncezionali adeguati Pazienti che presentino qualsiasi altra controindicazione a essere sottoposti a PTA (Angioplastica Percutanea Transluminale) PRECAUZIONI 1. 2. 3. 4. 5. 6. 7. 8. 9. Questo dispositivo deve essere usato esclusivamente da medici esperti nelle tecniche interventistiche chirurgiche, angiografiche e vascolari percutanee. Le istruzioni per l’uso allegate al prodotto costituiscono solo una guida tecnica, e non ovviano alla necessità di una debita formazione professionale sul corretto posizonamento di questo tipo di stent e il suo sistema di rilascio Non usare il prodotto se l’imballo è aperto o danneggiato Se lo stent viene posizionato in una lesione diffusa o in un’arteria periferica con occlusione totale cronica, si potrebbero verificare complicanze per il paziente Se lo stent viene posizionato in una lesione mediamente o altamente calcifica, del vaso sanguigno, si potrebbe avere una dilatazione insufficiente dello stent, o una rottura del pallone con possibili complicanze La pressione di gonfiaggio del pallone non dovrebbe superare la pressione nominale di scoppio (RBP) Non sottoporre il paziente a test diagnostici , come ad esempio Risonanaza Magnetica (MRI) o altri tipi di procedure che potrebbero provocare la migrazione dello stent, prima che sia completamente endotelizzato Il catetere a palloncino deve essere utilizzato solo durante il posizionamento dello stent Non riutilizzare la guaina protettiva o il catetere a palloncino dopo averli rimossi e/o utilizzati 10. Non forzare il passaggio o ritirare il catetere senza prima determinare la causa della resistenza sotto fluoroscopia. 11. Utilizzare solo gli introduttori consigliati. Introduttori di calibro inferiore potrebbero danneggiare lo stent o il sistema di rilascio Rev. n. 2 del 07.10 Pag. 5 CODICI PRODOTTO Product No. Stent diameter Stent length REM-PE-5036 5.0 mm 36 mm REM-PE-6036 6.0 mm 36 mm REM-PE-7036 7.0 mm 36 mm REM-PE-8036 8.0 mm 36 mm REM-PE-5078 5.0 mm 78 mm REM-PE-6078 6.0 mm 78 mm PRODUTTORE KYOTO MEDICAL PLANNING CO., LTD Stent division FURUHASHI YAMASHINA-BLD 4 KANDACHO SHINOMIYA YAMASHINA-KU , KYOTO 607-8035 GIAPPONE TEL: +81-75-594-5595 FAX: +81-75-594-6444 DISTRIBUTORE PER L’ITALIA ACILIA HS s.r.l. Viale dell’ Industria, 23 35129 Padova Italy Tel.049.8700139 Fax 049.8700298 Rev. n. 2 del 07.10 Pag. 6
Scaricare