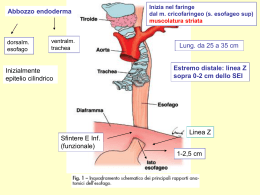
Definition of Gastroesophageal Reflux Disease “The term Gastro-Esophageal Reflux Disease (GERD) should be used to include all individuals who are exposed to the risk of physical complications from gastroesophageal reflux, or who experience clinically significant impairment of health related well being (quality of life) due to reflux related symptoms, after adequate reassurance of the benign nature of their symptoms” The Genval Workshop Report – Gut 1999;44:S1-16 MRGE: ampio spettro di manifestazioni cliniche NERD ERD SINTOMI EXTRAESOFAGEI ESOFAGO DI BARRETT ESOFAGO IPERSENSIBILE MRGE: classificazione Erosive Reflux Disease erosioni Non Erosive Reflux Disease non lesioni Esofago ipersensibile Sintomi E.R.D. N.E.R.D. Esofago ipersensibi le pHmetria patologica Esofagite 40% 35% 25% MRGE: sintomi tipici • PIROSI • RIGURGITO ACIDO Sensibilità 30-60% Specificità 85-90% MRGE: sintomi ESOFAGEI ATIPICI • Disfagia • Odinofagia • Dolore toracico non cardiaco EXTRAESOFAGEI • ORL • Polmonari MRGE: fisiopatologia FLUSSO REFLUSSO Anomalie del LES dell’acidità gastrica Anomalie della motilità gastrica Diminuita secrezione salivare, ecc della pressione intragastrica, ecc. Reflusso biliare MRGE: fisiopatologia • Un’aumentata frequenza di rilassamenti transitori del LES è il meccanismo patogenetico più accreditato • Questo meccanismo aumenta in presenza di ernia jatale Kahrilas PJ, Gastroenterology 2000 The Burden of Digestive Diseases in the United States GERD The third most prevalent GI disorder, in year 1998: 19 million The GI disease with highest total direct and indirect costs, in year 2000: $ 10 billion Total deaths related, in year 1998: 1500 Sandler RS et al.Gastroenterology 2002;122:1500-1 GERD – a spectrum of disease… SEVERE MILD Non-Erosive Reflux Disease (NERD) Erosive Esophagitis (ERD) Stricture Ulceration Barrett’s Esophagus Adenocarcinoma …or should we adopt a new conceptual framework? Non-erosive Reflux Disease Erosive Esophagitis Barrett’s Esophagus Atypical and Extra-esophageal Manifestations Stricture Ulcer GI Bleeding Adenocarcinoma of the esophagus Fass R and Ofman JJ. Am J Gastroenterol 2002;97:1901-9 Global variation in the prevalence of GERD (at least weekly heartburn and/or acid regurgitation) Dent J et al. Gut 2005;54:710-7 Changing prevalence of GERD with changing time Population-based Studies in Singapore Author 1994 2000 Ho KY 1.6% 9.9% Lim SL 5.5% 10.5% Ho KY et al. J Gastroenterol Hepatol 2001;16(Suppl):A132 Lim SL et al. J Gastroenterol Hepatol 2005;20:995-1001 GERD and Genetic factors Twin type Total pairs Monozygotic 928 Dizygotic * p=0.001 ° p<0.001 1032 Pairwise Casewise concordance rate concordance rate 27% * 42 %° (95% CI: 22-32) (95% CI: 36-49) 15% * 26 %° (95% CI: 11-19) (95% CI: 21-32) Mohammed I et al. Gut 2003;52:1085-9 About 31% of the liability to GERD is caused by genetic influences Cameron AJ et al. Gastroenterology 2002;122:55-9 Risk Factors • Gender • Age • Body Mass Index (BMI) • Hiatal Hernia • Cigarette smoking • Coffee • Alcohol consumption • Drugs intake • Helicobacter pylori GERD and Gender GERD Male Female OR (95% CI) OR (95% CI) NERD * 1.0 ERD ° 1.59 0.7 (0.5-1.1) 1.0 (1.38-1.83) * Locke GR III et al. Am J Med 1999;106:642-9 ° Labenz J et al. Am J Gastroenterol 2004;99:1652-6 GERD and Age (11.945 patients) p<0.0001 severe heartburn severe esophagitis Johnson DA and Fennerty BM. Gastroenterology 2004;126:660-4 GERD and BMI OR 95% CI p-Value BMI 25-30 (vs <25) 1.79 0.97-3.0 0.06 BMI>30 (vs<25) 2.44 1.27-4.47 0.007 El Serag HB et al. Am J Gastroenterol 2005;100:1243-50 Ernia hiatale ERD and Hiatus Hernia Frequency of HH (%) Reference Country Kang and Ho UK/Singapore Yeom et al. No patients Patients with esophagitis Patients without esophagitis * 383 64 6 Korea 1010 32 3 Kang et al. Singapore 11943 13 2 Stein-Larson et al. Norway 1224 68 11 Berstad et al. Norway 670 63 8 Wright et al. USA 293 84 13 Cronstedt et al. Sweden 1000 72 9 * Statistically significant Tobacco smoking and GERD Years of daily smoking <1 OR 95% CI 1.0 Reference 1-5 1.2 0.9-1.6 6-10 1.5 1.2-1.8 10-20 1.7 1.5-1.9 >20 1.7 1.5-1.9 Nilsson M et al. Gut 2004;53:1730-35 Alcohol and Coffee use and GERD Alcohol use Drinks/week OR 95% CI None 1.0 - 1-2 1.0 0.6-1.6 3-6 1.3 0.8-2.1 7 or more 1.9 1.1-3.3 No 1.0 - Yes 0.9 0.6-1.4 Coffee use Locke RG III et al. Am J Med 1999;106:642-9 Drugs and GERD Drugs OR (95% CI) Aspirin* 0.8 (0.4-1.7) NSAIDs* 0.9 (0.5-1.6) Nitrates° 1.5 (1.1-2.0) Oral Steroids° 1.3 (1.1-1.5) Anticholinergic drug° 1.5 (1.1-2.0) Hormone Therapy # 1.3 (0.9-1.8) *Locke GR III et al. Am J Med 1999;106:642-9 ° Ruigomez A et al. APT 2004;20:751-60 #Nilsson M et al. JAMA 2003;290:66-72 H.pylori and GERD: a negative association Raghunath A et al. BMJ 2003;326:737-44 Variables associated with GERD in H.pylori-positive patients Covariate OR 95% CI P Corpus gastritis 0.72 0.55-0.95 0.02 cagA-positive status 0.35 0.17-0.58 0.002 IL1B-31 polymorphic genotypes 0.63 0.38-0.99 0.05 IL1RN polymorphic genotypes 0.53 0.29-0.92 0.004 Queiroz DMM et al. Gastroenterology 2004;127:73-9 H.pylori Eradication and de novo Reflux Esophagitis Follow-up Incidence of de novo RE DU (460) 3 years Increased Fallone (2000) DU (98) 1 year Increased Murai (2000) PU,RE,NUD (451) >6 months Not Increased Hamada (2000) DU,GU,GDU,gastritis (572) 3 years Increased Befrits (2000) DU (165) 30 months Not Increased Kim (2001) DU, GU (187) > 6 months Not Increased Laheij (2002) Corpus gastritis (195) 3 months Not Increased Ott (2005) Dyspepsia (157) 12 months Not Increased Author (year) Subjects (n. pts) Labenz (1997) DU:duodenal ulcer;GU:gastric ulcer;PU:peptic ulcer; GDU:gastroduodenal ulcer; NUD:nonulcer dyspepsia;RE:reflux esophagitis MRGE Stenosi/Barrett Gastroenterologo MMG AdenoK Sintomi atipici Esofagite (=sintomi tipici endoscopia neg.) NERD Sintomi lievi Automedicazione 10% popolazione Valutazione endoscopica della severità della esofagite erosiva La valutazione della lunghezza delle erosioni non è affidabile se queste sono più lunghe di pochi mm sull’asse longitudinale esofageo La valutazione della estensione radiale delle lesioni è più affidabile e pertanto è stata adottata come principale criterio di severità 1 cm Lundell et al Gut 45:172-180 (1999) Valutazione endoscopica della severità della esofagite erosiva Le pliche mucose rappresentano i migliori punti di repere endoscopici per la determinazione dell’estensione radiale delle lesioni. Le pliche si osservano meglio dopo insufflazione solo parziale dell’esofago Lundell et al Gut 45:172-180 (1999) Definizione di lesione mucosa “Un area di disepitelizzazione o eritema con una netta linea di demarcazione dalla mucosa normale adiacente”. La classificazione di Los Angeles è stata ideata unicamente per definire la gravità dell’ esofagite • Pertanto l’unico criterio logico è la stima dell’estensione delle lesioni mucose • Le complicanze dell’esofagite come la presenza di stenosi e l’esofago di Barrett non sono misure affidabili della gravità dell’esofagite, e pertanto non dovrebbero essere usate nel formulare un giudizio relativo. Approccio definitivo all’attribuzione di un grado di severità all’esofagite da reflusso • Fare affidamento principalmente sulla estensione radiale dell’esofagite stessa, utilizzando le pliche mucose come repere endoscopico. • I due gradi minori si caratterizzano per: – lesioni mucose che non si estendono a ponte tra due o più pliche – ulteriore differenziazione in funzione dell’estensione assiale • I due gradi più severi sono definiti da: – lesioni mucose che si estendono a ponte tra due o più pliche – ulteriore differenziazione in funzione dell’estensione radiale Classificazione di Los Angeles dell’esofagite da reflusso Grado A: Una o più lesioni mucose di lunghezza inferiore ai 5 mm, che non si estendono a ponte tra due o più pliche mucose Lundell et al 1999 Classificazione di Los Angeles dell’esofagite da reflusso Grado B: Una o più lesioni mucose di lunghezza superiore ai 5 mm, che non si estendono a ponte tra due o più pliche mucose Lundell et al 1999 Classificazione di Los Angeles dell’esofagite da reflusso Grado C: Una o più lesioni mucose che si estendono a ponte tra due o più pliche mucose coinvolgendo non più del 75% della circonferenza Lundell et al 1999 Classificazione di Los Angeles dell’esofagite da reflusso Grado D: Una o più lesioni mucose che si estendono a ponte tra due o più pliche mucose coinvolgendo più del 75% della circonferenza Lundell et al 1999 MRGE: complicanze ESOFAGO DI BARRETT “Cos’è L’esofago Di Barrett?” L’esofago di Barrett è il cambiamento della mucosa esofagea in senso metaplastico,per una qualsiasi estensione. Questo cambiamento deve essere riconosciuto endoscopicamente ma è inoltre necessaria la conferma istologica per la presenza di metaplasia intestinale. ACG Practice Guidelines, Am J Gastroenterol 2002; 97: 1888-1895 Riconoscimento endoscopico dell’esofago di Barrett • Problemi di terminologia • Riconoscimento degli elementi diagnostici endoscopici • Caratteristiche essenziali di una nuova classificazione • Messa alla prova dei nuovi criteri Riconoscimento endoscopico dell’esofago di Barrett Esofago ricoperto di mucosa colonnare Il principale repere endoscopico della giunzione gastroesofagea: la sommità delle pliche mucose gastriche. Sommità della plica Sommità della plica I criteri endoscopici C & M di Praga per l’esofago di Barrett 16 14 12 Distanza in cm dalla giunzione esofagogastrica 10 M = massima estensione longitudinale 8 6 4 2 0 C = estensione circonferenziale Identificare correttamente la giunzione esofagogastrica Riconoscere un’ernia iatale Grading endoscopico dell’esofago di Barrett I criteri C & M di Praga • Pratici e facili da usare • Basati sulla massima estensione longitudinale e circonferenziale • Per un paziente con 2 cm di estensione circonferenziale sormontata da una lingula di 3 cm : C2M5 M5 C2 MRGE: complicanze ADENOCARCINOMA Tendenze Nella Prevalenza Di Cancro Esofageo E Gastrico Dal 1974 al 1994 Devesa, Cancer 1998 ASSOCIATION BETWEEN GASTROESOPHAGEAL REFLUX DISEASE SYMPTOMS AND ESOPHAGEAL ADENOCARCINOMA IN CASE-CONTROL STUDIES Study Author Lagergren et al. 1999 Chow et al. 1995 Farrow et al. 2000 Duration of Symptoms O.R. Frequency of symptoms None < 12 y 12-20 y > 20 y 1.0 7.5 5.2 16.4 None 1 Time/wk 2-3 Times/wk > 3 Times/wk 5.1 6.3 16.7 1.0 1.2 2.5 NR NR NR NR NR NR 1.0 1.6 2.7 2.3 2.7 None 1-2 Times/y 3-12 Times/y 13-104 Times/y 105-364 Times/y >365 Times/y 1.0 0.5 1.2 2.0 3.4 5.5 None 1-5 y >5y None < 10 y 10-20 y 21-30 y > 30 y O.R. 1.0 Shaheen N et al. JAMA 2002; 287(15):1972-1981 Gruppi ad alto rischio di sviluppo di esofago di Barrett • Maschi bianchi • Età maggiore di 50 aa • Sintomi cronici di reflusso G-E da almeno 5 aa • Non rispondono bene alla terapia con IPP • Presentano un sintomo d’allarme: disfagia, calo ponderale inspiegato, anemia) Stima Del Rischio Di Sviluppo Di Cancro in Esofago Di Barrett in Funzione Della Dimensione Dello Studio Shaeen, Gastroenterology 2000 Stadio pTNM in pazienti operati per Ca esofageo in esofago di Barrett (van Sandick JW, Gut 1998; 43:216-222) PROSPECTIVE DEVELOPMENT OF ESOPHAGEAL ADENOCARCINOMA BASED ON GRADE OF DYSPLASIA No. of Patients No. (%) of Patients with Cancer None 150 5 (3) 3.6-10 Low grade 45 8 (18) 1.5-4.3 High grade 115 32 (28) 0.2-9.5 Grade of Dysplasia Lenght of Follow-up (yrs) Pooled Data from Morales, Arch Inter Med 1999; 159: 14111416 Sorveglianza endoscopica regolare per esofago di Barrett • trattare aggressivamente la malattia da reflusso prima della sorveglianza • eseguire biopsie su 4 quadranti ogni 2 cm di estensione longitudinale della metaplasia • biopsiare ogni zona macroscopicamente anomala • eseguire il controllo successivo in funzione del grado di displasia ACG Practice Guidelines, Am J Gastroenterol 1998 Algoritmo diagnostico per la sorveglianza in esofago di Barrett No displasia Sorveglianza ogni 3 anni Displasia a basso grado Sorveglianza a 6 e 12 mesi Persiste Non più evidenza di displasia a displasia basso grado Sorveglianza Sorveglianza ogni 2-3 anni ogni 12 mesi Displasia ad alto grado Conferma da parte di un secondo patologo Nuova EGDS a Esofagectomia 3-6 mesi se paziente anziano Terapia ablativa endoscopica (solo in ambito sperimentale) ACG Practice Guidelines, Am J Gastroenterol 2002; 97: 1888-1895
Scarica