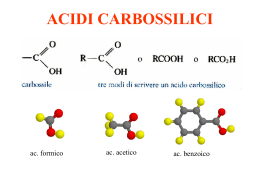
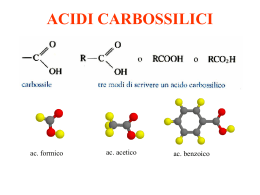
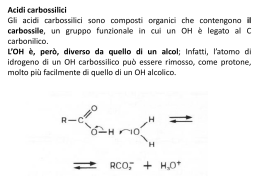
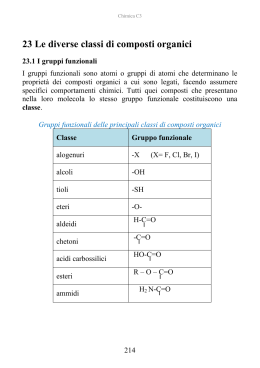
Acidi carbossilici - Acidi grassi Prof. Paolo Abis Lic. Classico “D. A. Azuni” SASSARI Acidi carbossilici Sono caratterizzati dal gruppo carbossilico O C OH Hanno formula generale R—COOH La nomenclatura IUPAC assegna agli acidi carbossilici il suffisso -oico Nomenclatura ACIDI H–C=O Acido metanoico (formico) O-H CH3 – C = O Acido etanoico (acetico) O-H CH3 – CH2 - C = O Acido propanoico o propionico O-H C=O O-H Acido benzoico nome IUPAC N. atomi C ac. metanoico ac. etanoico ac. propanoico ac. butanoico ac. pentanoico ac. esanoico ac. ottanoico ac. decanoico 1 2 3 4 5 6 8 10 nome corrente ac. formico ac. acetico ac. propionico ac. butirrico ac. valerianico ac. capronico ac. caprilico ac.caprinico ossidazione e riduzione R CH2OH alcool riduzione ossidazione O R aldeide C H riduzione ossidazione O R C acido OH caratteristiche Le caratteristiche del gruppo carbossilico dipendono dalla presenza del gruppo ossidrile –OH e del gruppo carbonilico C=O che interagiscono fra loro. gruppo carbonilico O R C OH gruppo ossidrilico L’acidità del gruppo carbossilico è dovuta all’effetto elettron attrattore esercitato dal gruppo carbonilico sul gruppo ossidrilico gruppo carbonilico gruppo ossidrilico Questo fatto determina la polarizzazione elettrostatica della molecola accumulo di carica negativa Ossigeno relativamente basico O - H+ C O accumulo di carica positiva Idrogeno relativamente acido Polarità del carbossile d ..d + R C O .. .. O .. - d+ H Proprietà del carbossile è elettrofilo R C In chimica, un elettrofilo è una specie che prende parte ad una reazione accettando un doppietto elettronico da un'altra specie (il nucleofilo), legandosi ad esso. È pertanto un acido di Lewis. + d .. dO .. .. d+ O .. H è acido acidità R C O + H2O OH O R C + H3O+ O Nel gruppo carbossilico –COOH l’ossigeno legato al carbonio con il doppio legame esercita una forte attrazione sugli elettroni ed indebolisce il legame O-H. Per questo motivo gli acidi carbossilici hanno un comportamento acido: in presenza di una base si dissociano nell’anione corrispondente ed in un idrogenione (H+) Acidità degli acidi carbossilici Nell’anione carbossilato il contributo delle due strutture di risonanza all’ibrido è uguale: i legami C–O hanno la stessa lunghezza (tra un doppio e singolo legame). Questa stabilizzazione porta ad un considerevole aumento dell’acidità. Acidità degli acidi carbossilici —C O - H+ O Proprietà fisiche Gli acidi carbossilici hanno punti di ebollizione eccezionalmente alti dovuti in gran parte alla capacità di associarsi in dimeri che coinvolgono due legami H. Inoltre la struttura planare favorisce la sovrapposizione dei dimeri ottenendo una distribuzione ordinata. il gruppo carbossilico può formare legami H con l’acqua Gli acidi carbossilici a corta catena sono solubili in acqua. L’allungamento della catena li rende praticamente insolubili in acqua ed aumenta la solubilità nei solventi organici apolari. Acido metanoico (Formico) L'acido formico (o acido metanoico) è il più semplice degli acidi carbossilici. Ha formula chimica HCOOH È un liquido incolore dall'odore pungente, è corrosivo e, se tenuto a contatto con la pelle provoca ustioni, distruggendo l'intero spessore del tessuto cutaneo. È miscibile in glicerolo, acetato di etile, metanolo e acqua; è molto solubile in acetone. È un forte agente riducente. Deve il suo nome alle formiche, nel cui organismo viene sintetizzato, che lo usano come veleno urticante. L'uso principale dell'acido formico è come agente conservante ed antibatterico nei mangimi per animali d'allevamento. Acido etanoico (acetico) A temperatura ambiente si presenta come un liquido incolore dal pungente odore caratteristico. È completamente solubile in acqua ed etanolo. È un acido debole; È un composto molto diffuso in natura, gli organismi superiori lo impiegano ampiamente come intermedio di sintesi, è anche il prodotto finale della fermentazione acetica in cui l'etanolo viene ossidato dall'Acetobacter in presenza di aria. La sua presenza determina la trasformazione del vino in aceto, in cui è generalmente presente in quantità variabili comprese tra il 4% e l'8%. L'acido acetico trova vasti impieghi industriali: è usato per la produzione di rayon, materie plastiche, pellicole fotografiche, solventi per vernici e farmaci. Acidi Grassi Si chiamano acidi grassi gli acidi carbossilici alifatici a lunga catena carboniosa. Si suddividono in: saturi insaturi Solo legami semplici Contengono doppi legami nome IUPAC N. atomi C nome corrente saturi ac. tetradecanoico ac. esadecanoico ac. ottadecanoico 14 16 18 ac. miristico ac. palmitico ac. stearico insaturi ac. cis-9-ottadecenoico 18 ac. oleico Strutture degli acidi grassi saturi ed insaturi Ogni atomo di carbonio lega il maggior numero possibile di atomi di idrogeno Contengono doppi legami che influenzano la forma della molecola e quindi della struttura di cui fa parte I Lipidi combinazione di acidi grassi e glicerolo. La maggior parte dei lipidi neutri è rappresentata da trigliceridi. Trigliceridi I saponi Si chiamano saponi i Sali sodici o potassici degli acidi grassi a lunga catena carboniosa Questi sali hanno un particolare comportamento in acqua dovuto alla coesistenza nella stessa molecola di regioni sia idrofile che idrofobe. testa idrofilica o polare coda idrofobica o apolare Acidi grassi nell’acqua Gli acidi grassi sono praticamente insolubili e, per la loro più bassa densità, galleggiano sulla superficie dell’acqua formando uno stato monomolecolare in cui i gruppi carbossilici polari formano legami H all’interfaccia con l’acqua (mentre le catene alchiliche si allineano tra loro allontanandosi dall’acqua), gruppi carbossilici polari catene alchiliche apolari I saponi formano micelle i sali di sodio o di potassio degli acidi grassi sono più solubili e quando concentrati si assemblano reversibilmente in aggregati chiamati micelle. I saponi formano micelle perché le porzioni idrofobe si orientano l’una accanto all’altra nel centro della micella minimizzando la perdita di legami H con l’acqua e permettendo alle porzioni idrofile, gli ioni carbossilato, di estendersi nell’acqua circostante partecipando ai legami H. Azione detergente del sapone Estremità idrofobica micella Meccanismo d'azione dei tensioattivi I tensioattivi attaccano lo sporco e lo sciolgono mediante la loro catena idrocarburica. L'acqua poi lo rimuove. La reazione di saponificazione I saponi sono sali degli acidi carbossilici a lunga catena (da 10 a 20 atomi di C) Si ottengono per idrolisi basica dei trigliceridi. O NaOH CH2O C R2 O CH O C R1 O CH2O C R3 CH2OH O KOH + 3NaOH CH OH CH2OH + 3R C O [Na]
Scaricare