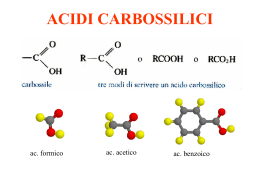
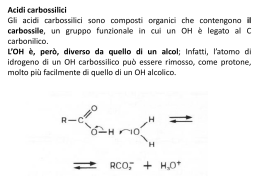
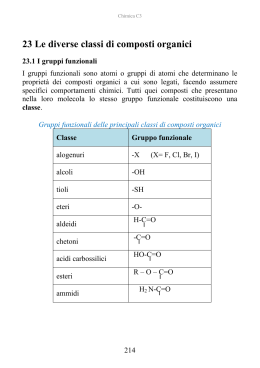
ACIDI CARBOSSILICI ac. formico ac. acetico ac. benzoico Nomenclatura Nomenclatura acido malonico Acidi bicarbossilici a catena alifatica Proprietà fisiche • I primi termini della serie sono liquidi incolori con odori pungenti o sgradevoli. • Composti polari e, come gli alcoli, formano legami idrogeno con se stessi o con altre molecole. • Di conseguenza: punti di ebollizione elevati, più elevati degli alcoli di pari peso molecolare. [es. l'acido acetico e l'alcol propilico hanno lo stesso peso formula (60) e bollono rispettivamente a 118°C e 97°C]. Proprietà fisiche Gli acidi carbossilici formano dimeri nei quali le due unità sono tenute saldamente insieme da due legami idrogeno: BIOCHIMICA DEL LEGAME H È UNA DELLE INTERAZIONI FONDAMENTALI DELL’ORGANIZZAZIONE MOLECOLARE DEI SISTEMI VIVENTI. PUÒ INTERESSARE GRUPPI O-H MA ANCHE GRUPPI N-H CHE INTERAGISCONO CON GRUPPI C=O O CON GRUPPI C-N. PONTI H NELLA STRUTTURA PROTEICA AD a elica I PONTI H SI STABILISCONO LUNGO LA CATENA DI AMINOACIDI TRA IL GRUPPO C=O INTERESSATO AL LEGAME PEPTIDICO CON L’AMINOACIDO SUCCESSIVO ED IL GRUPPO N-H DI UN LEGAME PEPTIDICO CHE SI TROVA 4 AMINOACIDI PIÙ AVANTI. PONTI H NELLA STRUTTURA PROTEICA foglietto b I PONTI H SI STABILISCONO TRA PORZIONI DI CATENE DI AMINOACIDI PARALLELE, APPARTENENTI ALLA STESSA CATENA RIPIEGATA O A CATENE DIVERSE TRA GRUPPI C=O DI UNA CATENA E GRUPPI N-H DELLA CATENA PARALLELA. PONTI H NELL’INTERAZIONE ENZIMA SUBSTRATO Interazione tra L-arabinosio ed ArabinoseBinding-Protein Acidità Gli acidi carbossilici si dissociano nell'acqua per formare un anione carbossilato e uno ione idronio. Occorre ricordare che, quanto più è grande il valore di Ka, o più piccolo il valore di pKa, tanto più forte è l'acido: Costanti di acidità Risonanza Perché gli acidi carbossilici sono tanto più acidi degli alcoli e dei fenoli? Soprattutto per la possibilità di delocalizzare per risonanza la carica, negli anioni che si vengono a formare. es. l'acido acetico è 1011 volte, cioè cento miliardi di volte, più acido dell'etanolo. Risonanza La carica negativa è egualmente dispersa sui due atomi di ossigeno, quindi ogni atomo di ossigeno dello ione carbossilato ne porta soltanto la metà. Nell'acido formico i due legami carbonio-ossigeno hanno lunghezze diverse, mentre nel formiato di sodio i legami carbonio-ossigeno dello ione sono identici (la lunghezza è intermedia fra un legame semplice e un legame doppio carbonio-ossigeno). Effetto induttivo della risonanza • Fra acidi carbossilici le acidità possono variare a seconda degli altri gruppi presenti nella molecola. • es. tra l'acido acetico e gli acidi mono-, di- e tricloroacetico, l'acidità aumenta di 10 000 volte. • È l'effetto induttivo dei gruppi vicini al carbossile. Effetto induttivo della risonanza L’effetto trasmette la carica lungo i legami, polarizzando gli elettroni di legame in direzione degli atomi più elettronegativi (ovvero in direzione opposta rispetto agli atomi più elettropositivi). Salificazione Gli acidi carbossilici reagiscono con le basi forti per formare dei sali. Esempi per la nomenclatura: I derivati degli acidi carbossilici Composti nei quali l'ossidrile carbossilico è stato sostituito da altri gruppi. Esteri e ammidi sono molto diffusi in natura. Hanno la caratteristica di dare, per idrolisi, i corrispondenti acidi carbossilici. Esteri Derivano dagli acidi per sostituzione del gruppo OH con un gruppo OR e danno origine al profumo di molti frutti e fiori. La nomenclatura è analoga a quella dei sali: prima si mette il nome della componente acida, con la desinenza -ico cambiata in -ato, poi quello del radicale R del gruppo -OR. Esterificazione di Fischer la sostituzione nucleofila acilica Se un acido carbossilico e un alcol vengono riscaldati in presenza di un catalizzatore acido (di solito HCI o H,SO,), si instaura un equilibrio tra l'estere corrispondente e l'acqua. L’ossigeno dell’estere non viene dall’H2O ma dall’alcol: Meccanismo dell’esterificazione Meccanismo dell’esterificazione l'acqua si forma dall'ossidrile dell'acido e dall'idrogeno dell'alcol. Non si tratta di una sostituzione diretta è un processo in due stadi: (1) di addizione nucleofila e (2) di eliminazione. Saponificazione ed ammonolisi degli esteri L'idrolisi alcalina degli esteri si chiama saponificazione, perché un processo di questo tipo serve per preparare i saponi dai grassi Il meccanismo è un esempio di sostituzione nucleofila acilica: L'ammoniaca trasforma gli esteri in ammidi per ammonolisi: La saponificazione comporta l'attacco nucleofilo da parte dello ione idrossido, che è un nucleofilo forte, sul carbonio carbonilico dell'estere. Il passaggio chiave è l'addizione nucleofila al gruppo carbonilico. Riduzione degli esteri Gli esteri possono essere ridotti ad alcoli primari dal litio alluminio idruro (LiAlH4). È possibile ridurre il solo carbonile estereo anche in presenza di un legame C=C, nella stessa molecola, che resta inalterato. Per esempio: Composti acilici attivati La maggior parte delle reazioni degli acidi carbossilici, degli esteri e dei loro derivati comporta un attacco nucleofilo sull'atomo di carbonio carbonilico. In genere gli esteri sono meno reattivi delle aldeidi e dei chetoni nei confronti dei nucleofili, perché negli esteri la carica positiva del carbonio carbonilico può essere delocalizzata sull'atomo di ossigeno. il carbonio carbonilico estereo, essendo meno positivo di quello delle aldeidi e dei chetoni, è meno disponibile all'attacco nucleofilo. alogenuri acidi: Anidridi Derivano dagli acidi per eliminazione di acqua (condensazione) da due gruppi carbossilici. Nei confronti dei nucleofili esse sono più reattive degli esteri, ma meno reattive degli alogenuri acilici. Fra le reazioni caratteristiche dell'anidride acetica vi è anche la sintesi dell’aspirina: aspirina Ammidi Le ammidi, fra i derivati degli acidi carbossilici, sono quelli meno reattivi e sono largamente diffuse in natura. Le ammidi più importanti sono le proteine. Le ammidi hanno geometria piana e, sebbene il legame carbonio-azoto venga comunemente scritto come legame semplice, la rotazione risulta parzialmente impedita. La risonanza fa si che il legame carbonio-azoto si comporti come legame doppio. Quindi l'azoto, il carbonio carbonilico e gli atomi ad essi legati giacciono sullo stesso piano. Nelle ammidi il legame C-N misura solo 1,32A ed è molto più corto del comune legame semplice carbonio-azoto (che è di circa 1,47A). Come si può dedurre dalla forma di risonanza dipolare, le ammidi sono composti altamente polari e danno forti interazioni di tipo ponte H. La geometria delle ammidi e la possibilità di instaurare ponti H sono alla base delle strutture secondarie e terziarie di tutte le proteine e quindi delle loro funzioni specifiche. Il legame peptidico delle proteine Le proteine sono catene di aminoacidi uniti tra loro. Il gruppo carbossilico COOH di un AA ed il gruppo aminico NH2 di un altro AA reagiscono formando l’ammide, con un legame denominato peptidico). Formazione dell’ammide (legame peptidico) AA1 AA2 Si libera una molecola d’H2O Gli acidi grassi acido stearico acido oleico acido linoleico acido linolenico
Scaricare