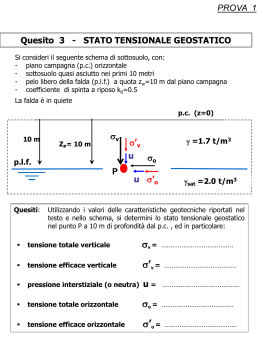
Weekly Summary (6) • Tensione Superficiale • Tensioattivi, Flottazione e capillarità • Membrane Elastiche e legge di Laplace • Embolia gassosa • Meccanismo respirazione I liquidi all’equilibrio In un liquido all’equilibrio agiscono solo forze perpendicolari alle superfici libere (quelle che abbiamo chiamato pressioni). Le forze tangenziali devono essere nulle, altrimenti avremmo movimento, ovvero mancanza di equilibrio!!! Tensione Superficiale La risultante delle forze di coesione che agisce su una molecola all’interno del fluido è nulla per simmetria mentre è diretta verso il basso quando la molecola sta all’interfaccia aria/liquido. Da notare che la forza peso non viene considerata! La superficie di un liquido, e in generale tutte le interfacce, hanno un comportamento anomalo intrinseco, ma per questo molto interessante! Nel caso in figura se vogliamo aumentare la superficie dell’interfaccia, portando delle molecole verso questa, dobbiamo fare lavoro contro le forze di coesione. Tensione Superficiale La superficie si comporta come una membrana elastica tesa, a causa delle forze di coesione tra molecole vicine: per aumentarne la superficie dobbiamo vincere le forze elastiche che sono tangenziali alla superficie e perpendicolari al contorno. Tensione Superficiale nelle lamine liquide Si definisce il coefficiente di tensione superficiale τ come l’intensità della forza per unita di lunghezza, F/l, che agisce lungo il bordo della lamina liquida: F != l La forza F, detta forza di tensione superficiale, non dipende dall’estensione della superficie ma solo dalla lunghezza del contorno. Se raddoppiamo il contorno raddoppia anche la forza ma rimane costante il rapporto tra forza e lunghezza del contorno. L’unità di misura della tensione superficiale è N/m (o dyne/cm nel sistema CGS). Tensione Superficiale Il coefficiente di tensione superficiale può anche essere definito a partire dal lavoro, senza che per questo cambi la sua unità di misura. Per aumentare la superficie libera di ΔS bisogna fare un lavoro contro le forze di tensione superficiale : L != !S Il lavoro fatto dalle forze superficiali per riportare la superficie al valore iniziale dipende solo dal valore iniziale e finali della superficie, L=τ*(Si-Sf), possiamo quindi, in analogia alla meccanica, definire un’energia potenziale superficiale come il lavoro fatto contro le forze di tensione per portare l’area a un valore S: U = !! S Tensione Superficiale L != !S Questa definizione è alquanto interessante perché rappresenta una generalizzazione del concetto di forza. La stessa generalizzazione la troveremo quando faremo i potenziali termodinamici e le forze entropiche. Se analizziamo meglio la tensione superficiale vediamo come sia una forza tangenziale creata da forze molecolari, dirette invece perpendicolarmente alla superficie!!! Quindi si tratta di una forza effettiva, legata al concetto di lavoro necessario a modificare la superficie del liquido. Tensione Superficiale Per il momento abbiamo solo considerato le forze tra molecole dello stesso tipo, fluido-fluido, ma per un liquido in un contenitore esistono anche le forze, dette di adesione, tra il fluido e il contenitore. In ogni caso la risultante delle forze deve essere perpendicolare alla superficie e diretta verso l’interno del liquido (condizione di equilibrio delle superfici), cosi da creare una forza effettiva di superficie. Contatti fluido-fluido Le forze di tensione superficiale all’equilibrio sono tangenziali alle superfici e quando si hanno contatti fluido-fluido, come in figura, le forze sono anche perpendicolari alle linee di contatto, giacciono tutte sullo stesso piano Per una goccia su una superficie ci sono 3 contatti, FτAB=goccia/liquido, FτA=goccia/aria, FτB=liquido/aria. Ciò che determina l’equilibrio, se esiste, è la somma delle tre forze: F! A + F! B + F! AB = 0 Contatti fluido-fluido Come si vede dalla figura a lato nel caso (a) si ha equilibrio delle forze, la forza risultante sulla linea di contatto è zero e la goccia persiste sulla superficie. Invece nel caso (b) la goccia non può persistere perché la forza FτB è molto grande. Cosa vuole dire? Questo è il caso delle gocce d’olio sulla superficie d’acqua: siccome la tensione superficiale aria-acqua è molto intensa, più della somma vettoriale delle altre due, la goccia d’olio tende a spandersi sulla superficie d’acqua sino a raggiungere spessori molecolari. In termini di energia la superficie ariaacqua tende al minimo. F! B > F! A + F! AB Contatti fluido-vetro Le forze di coesione/adesione determinano anche i contatti tra liquidi e solidi, come in figura. Nel caso (a) la forza di tensione superficie/ aria prevale, cioè la superficie di contatto superficie/aria tende a essere minima, il liquido si espande (si dice che bagna la superficie). In (b) la forza di tensione liquido/superficie prevale, cioè la superficie liquido/superficie tende a essere minima, diciamo che il liquido non bagna la superficie e si compatta in una goccia. τ >> => S<< Flottazione La tensione superficiale può in alcuni casi determinare il galleggiamento di corpi con densità maggiore di quella del liquido. Infatti per volumi trascurabili la forza peso e quella di Archimede sono piccole e quindi prevale la componente verticale delle tensioni superficiali. Questo accade quando il liquido non bagna il corpo. Questo perché la tensione superficiale del liquido, essendo elevata, tende a opporsi alla sua rottura, o al suo aumento. Per immergere completamente il corpo la superficie deve aumentare!!! Applicazioni della Tensione Superficiale Anche per la tensione superficiale, un fenomeno prettamente di natura molecolare, gli effetti sono macroscopici. Le proprietà detergenti delle soluzioni dipendono dalla tensione superficiale. I detersivi e i saponi vengono aggiunti all’acqua per diminuire la sua tensione superficiale e fare si che l’acqua si distribuisca meglio sulle superfici da lavare. Come vedremo meglio nella teoria cinetica dei gas, la tensione superficiale diminuisce all’aumentare della temperatura, in quanto l’agitazione delle molecole, la temperatura, disturba le forze di coesione ed adesione. Per questo l’acqua calda lava meglio di quella fredda!!! Tensioattivi I tensioattivi sono dei soluti che sciogliendosi in un solvente ne modificano la tensione superficiale, sia aumentandola che diminuendola. Di solito la variazione di tensione superficiale dipende dalla concentrazione della soluzione: ! soluzione ! ! solvente " C(%) ! soluzione L’aggiunta di NaCl (sale da cucina) aumenta la tensione superficiale dell’acqua, cosi come altri soluti minerali. NaCl 10% ==> τ=77 dyne/cm NaCl 25% ==> τ=84 dyne/cm I soluti organici (acido acetico) solitamente abbassano la tensione superficiale. Il saccarosio, anche ad elevate concentrazioni, non ha effetti sulla tensione superficiale. Dipendenza dalle forze molecolari!!! Tensioattivi Le sostanze tensioattive sono capaci, anche a basse concentrazioni, di abbassare la tensione superficiale dell’acqua. Queste sostanze si miscelano all’acqua in maniera non omogenea, addensandosi alla superficie. Il loro meccanismo di azione viene illustrato in figura: le molecole rosse (tensioattivo) si sostituiscono gradatamente a quelle azzurre (solvente) alla superficie. Mentre le molecole di solvente hanno una forte coesione tra loro, quelle di tensioattivo hanno una forza (di adesione) per il solvente più piccola, che risulta in una diminuzione della tensione superficiale. Tensioattivi Esiste un equilibrio dinamico tra la propensione delle molecole di tensioattivo ad occupare la superficie e l’agitazione termica che tende a rendere omogenea la soluzione, cioè portare le molecole di tensioattivo a distribuirsi omogeneamente in soluzione. Se aggiungiamo una sostanza solida polverizzata all’acqua, l’alta tensione superficiale tende a mantenerla in superficie, flottazione. Se aggiungiamo un tensioattivo la polvere si scioglie nell’acqua. Tensioattivi Questo è il metodo per individuare la presenza di acidi biliari nelle urine. L’urina normale ha una tensione superficiale sufficiente a mantenere in superficie dei granelli di zolfo. La presenza di acidi biliari nell’urina abbassa la tensione superficiale dell’urina e i granelli di zolfo precipitano sul fondo del recipiente. Le sostanze tensioattive vengono anche usate come disinfettanti. Tendono infatti a concentrarsi nello strato di interfaccia che si crea attorno ai batteri quando sono bagnati dalla soluzione. Capillarità: forze molecolari Il valore relativo delle forze di coesione e adesione per le molecole di un liquido in un contenitore concorrono, insieme alla forza peso, a determinare il tipo di interfaccia liquido/solido. Da notare che la forza peso è la più piccola delle tre!!! (a) Se le forze di adesione f2 sono maggiori di quelle di coesione f1 allora il liquido bagna le pareti del contenitore. (b) Viceversa se sono quelle di coesione f1 a prevalere allora il liquido NON bagna le pareti. La risultante R all’equilibrio deve essere sempre perpendicolare alla superficie. Capillarità: forze di tensione Questo fenomeno dà luogo alla capillarità, cioè quando immergiamo un vaso piccolo (capillare) all’interno di un liquido si può avere l’innalzamento o l’abbassamento del liquido nel vaso, rispetto alla superficie libera del liquido. Capillarità È l’equilibrio tra forza peso del liquido e tensione superficiale che determina l’altezza di equilibrio h. Per un vaso cilindrico (sezione circolare) abbiamo Fτ=l*τ: F! = FP 2" r! cos# = dg" V = dg" r 2 h 2! cos# = dgrh Per angoli <90o si ha l’innalzamento (h>0), caso acqua-vetro. Per angoli >90o si ha l’abbassamento (h<0), caso mercurio-vetro. Pensare al movimento della linfa negli alberi o al potere assorbente di alcuni materiali, cotone. Tensione elastica membrana La legge di Hooke ci dice che la deformazione di un corpo elastico, sotto l’azione di una forza esterna, è proporzionale alla forza stessa: f=-kx Ciò vuol dire che ogni corpo si oppone alla deformazione con una forza di reazione uguale e contraria. La forza di reazione si chiama forza elastica. Se consideriamo una membrana elastica, quando viene tesa esistono delle forze interne, dirette tangenzialmente alla superficie, che si oppongono. Queste forze interne si rendono “visibili” quando pratichiamo un taglio alla membrana tesa: sono capaci di dilatare il taglio stesso. Tensione superficiale membrana In analogia a quanto fatto per la tensioni superficiale dei liquidi, possiamo definire una tensione superficiale, o tensione elastica della membrana, come il lavoro infinitesimo per variazione di superficie: dL ! (S) = dS Contrariamente alla tensione superficiale dei liquidi qui la tensione elastica DIPENDE dal valore della superficie stessa della membrana, τ=τ(S) Legge di Laplace La legge di Laplace esprime una condizione di equilibrio tra la tensione superficiale e la differenza di pressione tra esterno e interno di una bolla ad esempio. Per semplicità si può considerare un palloncino sferico come in figura. Dato un punto P le forze di tensione elastica avranno una componente diretta verso il centro della sfera, essendo la componente orizzontale nulla. A questa forza deve fare equilibrio un’altra forza, ovvero la differenza tra la pressione interna e quella esterna. Legge di Laplace Per trovare la condizione di equilibrio si fa ricorso al principio dei lavori virtuali. Poiché all’equilibrio la risultante delle forze deve essere nulla, per un piccolo spostamento il lavoro deve essere anch’esso nullo. Calcoliamo il lavoro per una variazione infinitesima della superficie della sfera, portando il raggio da r a r+Δr. Prima vediamo come cambia la superficie per un aumento del raggio: 2 2 2 4! (r + !r) " 4! r = 8! r!r + 4!!r # 8! r!r Il termine con Δr2 viene trascurato perché sempre più piccolo di quello con Δr (ricordarsi che Δr è molto più piccolo di 1) Legge di Laplace Il lavoro fatto dalle forze di tensione risulta essere: L! = !!S = ! 8" r!r e va considerato con il segno meno perché la forza è diretta verso il centro della sfera! Se vogliamo aumentare il raggio, la differenza di pressione Δp=Pint-Pext compirà un lavoro: LP = F ! "r = "pS"r = "p"r4! r 2 Legge di Laplace Il lavoro totale deve essere: LP ! L! = 0 ! 8" r!r = !p!r4" r 2! !p = da cui risulta: r 2 Questa formula vale per un sistema sferico: maggiore il raggio della sfera minore la differenza di pressione tra interno ed esterno. I palloncini scoppiano quando la differenza di pressione eccede il valore della tensione superficiale, ovvero il regime elastico cessa di valere (in analogia ai fili, si spezzano quando la forza esterna eccede la tensione interna). Legge di Laplace Per le membrane elastiche poiché la tensione superficiale τ dipende dal valore della superficie, qui il raggio della sfera, la formula di Laplace vale solo in maniera implicita: 2! (r) !p = r Legge di Laplace: casi limite Se abbiamo un ellissoide la formula di Laplace si scrive rispetto ai due raggi di curvatura principali: "1 1% !p = ! $ + ' # R1 R2 & Legge di Laplace: casi limite Invece se abbiamo un cilindro, poiché uno dei raggi di curvatura vale infinito allora ricaviamo: $1 1' ! lim !p = !& + )= R2 " # % R1 R2 ( R1 ! !p = R Questa formula viene usata per studiare l’equilibrio dei vasi sanguigni! Salita della linfa negli alberi Quanto può risalire l’acqua (tensione superficiale 72 dyne/cm) lungo un capillare di raggio 10-3 cm? 2! cos" = dgrh Se consideriamo anche la condizione più favorevole, θ=0, otteniamo h=150 cm. Negli alberi più alti il meccanismo dell’osmosi permette la risalita della linfa sino a 30-40 metri. E oltre cosa succede? Si fa ricorso al concetto di pressione negativa. La colonna di linfa nei capillari non viene mai spezzata. Se l’acqua nelle foglie evapora, dovrebbe lasciare spazio libero, ma per le forze di coesione altra linfa viene attratta verso l’alto. Respirazione polmonare Lo stesso concetto di pressione negativa viene utilizzato per la respirazione polmonare: quando la cassa toracica si espande i polmoni seguono questa espansione e all’interno si crea una depressione che genera un afflusso di aria, inspirazione. L’espirazione invece è creata dalla contrazione della cassa toracica che crea una leggera sovrapressione interna che fa defluire l’aria all’esterno. L’embolia gassosa L’embolia è l’ostruzione di un vaso, arteria o vena, causata da un corpo estraneo, detto embolo. Nel caso particolare dell’embolia gassosa il corpo estraneo è una bolla di aria (o di gas). E’ una patologia tipica dei subacquei, ma non esclusivamente. Quando un subacqueo riemerge dopo un’immersione con le bombole, durante la risalita la pressione (ricordare Stevino) diminuisce, provocando la dilatazione di piccole bolle di gas. Se la risalita è molto veloce (più di 10 metri al minuto) le bolle di gas in espansione non riescono a raggiungere i polmoni e rimangono intrappolate all’interno dei vasi. Di solito è l’azoto che crea problemi, perché? Ricordarsi che l’azoto è un gas neutro per l’uomo e si trova a una percentuale alta rispetto ai gas attivi (ossigeno e anidride carbonica). L’embolia gassosa L’ostruzione dei vasi da parte dell’embolo non è semplicemente dovuto all’espansione delle bolle di gas, questo è vero solo nei casi più gravi, quando il subacqueo compie una “risalita a pallone”. Molto spesso l’embolia viene dopo risalite “regolari” e dopo diverse ore dall’immersione. Invece il meccanismo di ostruzione è molto più sottile e viene spiegato dall’applicazione della legge di Laplace e dal principio di Bernoulli. Bernoulli Dobbiamo capire perché una bolla d’aria all’interno del vaso non circola con il sangue ma rimane ferma. La bolla all’interno del vaso ha due menischi, se p1 e p2 sono le pressione all’esterno dei menischi, caratterizzati da un angolo θ1 e θ2, a pressioni uguali devono corrispondere menischi uguali: Δp=p-p1=p-p2=2τ/R Però sappiamo che per avere movimento del sangue, vedere Bernoulli e Poiseuille, a causa dell’attrito dobbiamo avere una differenza di pressione all’interno dei vasi, cioè per un flusso da sx verso dx deve essere p1>p2. Tensione Superficiale In questo caso la differenza di pressione Δp sarà diversa per i due menischi. Poiché p1>p2 ed essendo la pressione interna uguale e maggiore, Δp1 < Δp2, ovvero il raggio di curvatura R della superficie 1 e’ maggiore di quello della superficie 2 per la legge di Laplace Δp=2τ/R, ovvero θ1>θ2. Quindi, come si può vedere dalla figura, il menisco di sinistra tende ad appiattirsi, raggio di curvatura maggiore, mentre quello di destra tende a gonfiarsi, raggio di curvatura minore. Tensione Superficiale Calcoliamo per questa nuova geometria la nuova differenza di pressione p1-p2, cosi come viene modificata dalla tensione superficiale. La forza di tensione superficiale è tangenziale alla superficie della bolla. Consideriamo la sua componente lungo la direzione del flusso, è questa forza che provoca una pressione addizionale!!! Pressione da tensione La forza di tensione, per definizione, è il prodotto tra la tensione superficiale e il contorno, qui il perimetro del vaso (ATTENZIONE, r=raggio del vaso): p1! = F1! ! cos#1 ! 2" r 2! cos#1 = = 2 2 "r "r r Questa pressione va a sommarsi alla pressione p1: 2! cos"1 p1 ' = p1 + p1! = p1 + r Analogamente nel punto 2 avremo: p2 ' = p2 + p2 ! = p2 + 2! cos" 2 r Pressione La nuova differenza di pressione sarà: 2! cos"1 2! cos" 2 !p' = p1 '" p2 ' = p1 + p1! " p2 " p2 ! = p1 + " p2 " = r r 2! = p1 " p2 " ( cos" 2 " cos"1 ) = !p " !p! r Poiché quando p1>p2 abbiamo θ2<θ1, avremo cosθ2>cosθ1, ovvero la pressione Δpτ è positiva. Questo comporta che la nuova differenza di pressione tra il punto 1 e 2, Δp’, deve diminuire ovvero che la forza che mette in moto il fluido diminuisce di Δpτ. Qualche numero Occorre stimare la variazione di pressione Δpτ e vedere quanto vale rispetto alla pressione originaria Δp. Solo quando Δp > Δpτ avremo un flusso!!! 2! !p' = !p " !p! = !p " ( cos! 2 " cos!1 ) r Assumiamo che il sangue abbia la stessa tensione superficiale dell’acqua (72.5 dyne/cm) e che nella peggiore delle ipotesi i due angoli dei menischi siano il primo 90° e il secondo 0o. 145barie !p! = r(cm) Qualche numero 145barie !p! = r(cm) Se abbiamo un capillare con r= 20 μm la pressione di tensione vale 50 mmHg. Se invece abbiamo un vaso di dimensioni maggiori, r= 0.01 cm, la pressione di tensione vale 10 mmHg In entrambi i casi sono differenze di pressione non trascurabili, più importanti per i capillari ma probabilmente meno pericolose per i danni che può provocare. Alveoli polmonari Gli alveoli polmonari si possono descrivere come piccole sfere cave, unite fra loro, costituite da due strati: quello interno è assimilabile a una bolla liquida (condizione generata dal vapor saturo) alla quale aderisce uno strato esterno di materiale elastico. Se esistesse solo lo strato interno liquido, il sistema degli alveoli sarebbe in equilibrio instabile. Una piccola perturbazione porterebbe alla distruzione di tutti gli alveoli. Vediamo perché. Laplace Date due bolle ottenute dalla stessa soluzione ed identiche come dimensioni, per la legge di Laplace la differenza tra pressione interna ed esterna deve essere uguale. Poiché la pressione esterna è costante, la pressione interna deve essere uguale. Detta Δp la differenza di pressione tra p1 e p2 abbiamo Δp=0. 2! !p = R Se le bolle sono uguali Δp=p1-p2=0 Pext P1 P2 Non equilibrio Se il raggio della bolla 1 diminuisce, per la legge di Laplace la differenza tra pressione interna ed esterna aumenta. Al contrario se la bolla 2 aumenta di dimensioni, la sua pressione interna diminuisce. Poiché la pressione esterna deve rimanere costante, deve aumentare la pressione interna nella bolla 1 e diminuire nella bolla 2. 2! !p = R Se le dimensioni cambiano come in figura si ha: p1’>p1 e p2’<p2 Pext P2 P1 Δp’>0 Collasso Siccome i fluidi vanno da pressioni maggiori a pressioni minori, si ha uno spostamento di fluido dalla bolla 1 alla bolla 2, cioè la bolla 1 collassa a spese della bolla 2: le bolle grandi si “mangiano” quelle piccole, abbiamo una situazione di non equilibrio!!! Pext P2 P1 Δp’>0 Strato elastico La presenza negli alveoli dello strato esterno elastico permette di fermare l’espansione delle bolle grosse consentendo una situazione di equilibrio stabile Pext P2 P1 Δp’>0 Alveolo L’alveolo, visto come una bolla che cresce all’estremità di una cannuccia, parte con un raggio di curvatura infinita, che decresce sino ad arrivare al raggio della cannuccia, dopodiché il raggio aumenta di nuovo. Per la legge di Laplace la differenza tra pressione interna ed esterna aumenta sino alla fase III quando, raggiunto il raggio minimo, inizia a decrescere, mentre il volume aumenta. Alveolo Lo strato elastico esterno controlla l’alveolo a volumi maggiori. L’insieme dei due strati si comporta come nella figura sottostante. L’alveolo cresce sino alla pressione critica alla quale si ha lo “scoppio” della bolla e lo strato elastico media le dimensioni (passaggio da A a B). In espirazione la pressione interna diminuisce sino a collassare da C a D. Questo meccanismo si chiama isteresi. Isteresi Si è in presenza di isteresi quando una proprietà (qui il volume) dipende non da un valore della pressione ma dall’andamento della pressione, se ascendente o discendente. L’isteresi nella respirazione è spiegata con l’effetto di un tensioattivo che agisce diversamente sugli alveoli piccoli e grandi. Quando l’alveolo è sgonfio l’alta concentrazione di tensioattivo favorisce la sua espansione (bassa tensione), mentre quando è gonfio la bassa concentrazione di tensioattivo aumenta la tensione favorendone la sua chiusura.
Scaricare