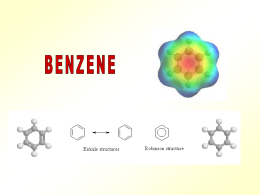
Benzene e derivati Struttura di base: ANELLO con 6 atomi di C e 6 di H BENZENE C6H6 I legami fra i carboni non sono né semplici, né doppi, ma di tipo «ibrido». 2 Strutture di RISONANZA DELOCALIZZAZIONE degli e- La delocalizzazione elettronica è resa possibile dal fatto che tutti e 6 i C hanno ibridazione sp2. Ciò significa che, oltre a tre orbitali ibridi, ogni C si ritrova con un e- in un orbitale p. Questi orbitali p sono disposti nello spazio in modo parallelo. Per tal motivo possono «fondersi» in un unico orbitale molecolare con forma anulare doppia (sopra e sotto il piano dell’esagono). • In quest’anello si ha la maggior probabilità di trovare i 6 e• Tale configurazione rende più stabile il benzene rispetto ad altri alcheni • La presenza di questo anello orbitale è responsabile dell’odore che caratterizza in modo specifico sia questo composto sia ogni suo derivato. • Per tal motivo viene anche indicato come «anello aromatico» Proprietà chimico-fisiche • E' un liquido incolore che evapora molto velocemente caratterizzato da un odore tipico, pungente e dolciastro, che richiama quello di alcune vernici o smalti (infatti è utilizzato come solvente). • Ha proprietà analoghe ad altri idrocarburi (infiammabile, liquido a temperatura ambiente, poco reattivo, solvente neutro) ed è più stabile di altri alcheni proprio per la sua «aromaticità»: la condivisione di elettroni tra tutti e sei i carboni abbassa la tensione dovuta alla loro disposizione anulare, per cui il benzene è più stabile rispetto ad altri composti esaciclici. • Ha sostituito, come antidetonante, il piombo tetraetile della benzina «rossa» trasformandola in «verde». Tuttavia si è dimostrato cancerogeno (soprattutto a livello del midollo rosso) alla pari delle radiazioni ionizzanti per cui vari stati ne stanno riducendo l’uso. • Le reazioni di addizione (per rottura dei doppi legami) sono più difficili rispetto agli alcheni classici. • Molto utilizzate le reazioni si sostituzione degli idrogeni per ottenere vari composti derivati (fenoli, alogeno derivati, nitro derivati ecc) Si ottengono essenzialmente per sostituzione si uno o più dei 6 idrogeni Si distinguono in: Areni i sostituenti sono idrocarburi Composti aromatici i sostituenti non sono idrocarburi Entrambi possono avere un solo anello benzenico (monociclici) o più di uno (policiclici), concatenati o condensati Possono, inoltre, essere monosostituiti (un solo radicale) o polisostituiti (più radicali). Segue le regole generali nominando l’anello principale con Benzene (meglio di 1,3,5 esatriene). Inoltre, se più conveniente, l’anello può essere considerato come radicale; in tal caso si da nome di fenile (benzene senza un H). In caso di più H sostituiti: fen2-ile, fen-3-ile ecc) Un derivato ottenuto per sostituzione di due idrogeni dell’anello principale (benzene) ha tre isomeri possibili che occorre nominare in modo differente utilizzando i seguenti prefissi in base alla posizione relativa dei radicali: -Orto (radicali in posizione 1 e 2) -Meta (radicali in posizione 1 e 3) -Para (radicali in posizione 1 e 4 ) I derivati con più anelli condensati, hanno un nome base specifico Esistono nomi tradizionali accettati dalla IUPAC anche per derivati monosostituiti presi come base per altri composti in quanto difficilmente sradicabili dalle pratiche comuni e che, comunque, il più delle volte rendono semplificano il nome. Fenolo 2,4,6 Tri-Nitro-Toluene o 2,4,6 Tri-Nitro-Toluolo 1 metil-2,4,6 tri-nitro-benzene Toluene o Toluolo Metil-benzene Vinilbenzene (stirene) Molecola base per materie plastiche Ad es. dalla sua semplice polimerizzazione si ottiene il polistirene o polistirolo Usato come solvente di coloranti, per lavorazione di gomma, plastiche. Anche come additivo alle benzine Dimetil benzene Naturali: percentuale minima. Emissioni vulcaniche ed a incendi boschivi. Attività umane: combustione incompleta di carbone, derivati del petrolio (industrie plastiche, motori). Rilascio di vapori da colle, vernici, cere per mobili, detergenti. Industrie: Fino alla seconda guerra mondiale, la quasi totalità del benzene era un sottoprodotto della produzione di carbon coke nell'industria dell'acciaio. Durante gli anni cinquanta, la domanda di benzene crebbe enormemente per le richieste delle neonate fabbriche di produzione di materie plastiche, per cui fu necessario produrre il benzene anche dal petrolio (Reforming catalitico, Steam cracking) Informazioni utili: il benzene è cancerogeno. Il 50% viene assorbito con il fumo di tabacco. Un fumatore medio (32 sigarette/die) ne assorbe circa 10 volte di più di un non fumatore. Anche gli scarichi dei motori ne producono in quantità preoccupante (il benzene è usato come antidetonante: ha sostituito il piombo tetraetile, molto più tossico). In minima percentuale evapora dal carburante e dal serbatoio Sono i più disparati: solventi, coloranti, colle, plastiche, gomme, aromi, profumi, conservanti, antidetonanti, esplosivi….
Scaricare