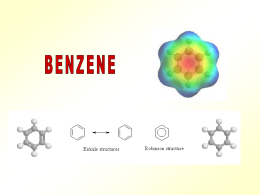
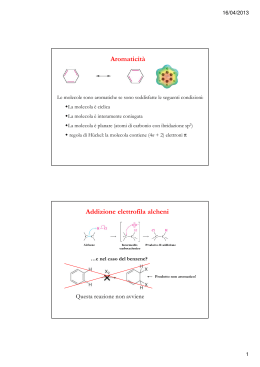
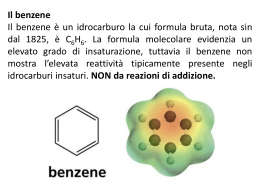
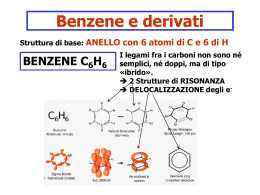
COMPOSTI AROMATICI •Gli alcani ed alcheni hanno diversa reattività chimica. •Vi è un’altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimica diverso dagli alcheni •Sono i composti aromatici •Il benzene è il loro modello Formula C6H6 IL BENZENE GLI ELETTRONI DEI LEGAMI p DELL’ANELLO RISUONANO SULL’INTERA STRUTTURA DISLOCAZIONE ELETTRONICA NEL BENZENE IL BENZENE È UN IBRIDO DI RISONANZA DI QUESTE DUE FORME LIMITE. Il benzene non può essere considerato un cicloesatriene a doppi legami coniugati. Se così fosse, si potrebbe calcolare con buona precisione l’energia scambiata durante il processo di riduzione a cicloesano (o di ossidazione a CO2 e acqua). Il calcolo invece dà un risultato che è di molto superiore al valore che si può sperimentalmente misurare. La differenza fra l’energia calcolata e quella misurata è dovuta alla particolare forma di risonanza che viene indicata con il termine di aromaticità. ENTALPIA DI IDROGENAZIONE Composti aromatici policiclici benzene naftalene antracene fenantrene I 10 carboni del naftalene sono tutti ibridati sp2 e ciascuno di essi contribuisce con 1 elettrone alla aromaticità dell’idrocarburo Regola di Huckel per prevedere il comportamento aromatico di composti ciclici e-p = 4n + 2 n = serie dei numeri naturali (comprendendo lo 0) n 1 2 3 4 . . e-p 2 6 1 14 16 ETEROCICLICI AROMATICI furano piridina Benzene + Pirrolo tiofene pirrolo indolo imidazolo Pirimidina + Imidazolo purina Esempi di composti non aromatici ciclooctatetraene ciclobutadiene La tendenza a preservare l’aromaticità o a guadagnarla è una caratteristica dei composti ciclici che permette di comprendere molte delle loro proprietà chimiche NOMENCLATURA LA POSIZIONE DEI SOSTITUENTI PUÒ ESSERE INDICATA COME orto, meta, para Quando sono presenti piu’ di due sostitenti si usano i numeri ARENI È IL NOME DELLA CLASSE • • GRUPPO ARILE (AR) IMPORTANTI SONO IL GRUPPO FENILE E QUELLO BENZILE Il benzene ed in generale i composti aromatici danno reazioni di SOSTITUZIONE ELETTROFILA AROMATICA Meccanismo generale di sostituzione elettrofila aromatica addizione elettrofila eliminazione Carbocatione arilico stabilizzato per risonanza Perché un composto aromatico da reazioni di sostituzione e non di addizione come negli alcheni ? Nu- addizione En. di risonanza 4 Kcal/mole sostituzione Il nucleofilo si comporta da base En. di risonanza 36 Kcal/mole Esempi di reazioni di sostituzione elettrofila aromatica SOSTITUZIONE ELETTROFILA AROMATICA SOSTITUZIONE ELETTROFILA AROMATICA NITRAZIONE SOLFONAZIONE Nitrazione del benzene Meccanismo di nitrazione Formazione della particella elettrofila nitrobenzene Solfonazione del benzene alogenazione I CATALIZZATORI POLARIZZANO LA MOLECOLA DI ALOGENO (ES. CLORO) E LA TRASFORMANO IN UN ELETTROFILO FORTE. L’ELETTROFILO ATTACCA GLI ELETTRONI p DEL BENZENE MECCANISMO DELLA SOSTITUZIONE ELETTROFILA LA CARICA + DEL CARBOCATIONE RISULTANTE È DELOCALIZZATA SUI CARBONI IN orto E para: VIENE ESPULSO UN PROTONE: Meccanismo generale: Nel caso in cui il benzene è “sostituito”, qual è l’effetto del sostituente sulla reattività dell’anello aromatico? La reattività aumenta o diminuisce? La posizione occupata dal sostituente E2 è casuale? Effetti del sostituente I principali effetti “elettronici” che un sostituente può esercitare sull’anello aromatico sono di due tipi: MESOMERICO (o di risonanza) – si esercita attraverso gli elettroni p e può essere rappresentato da strutture di risonanza. • + m: quando il sostituente può trasferire elettroni p verso l’anello aromatico. • - m: quando il sostituente può estrarre elettroni p dall’anello aromatico. INDUTTIVO – si esercita attraverso elettroni s ed è causato dalle caratteristiche relative di elettronegatività. • + i: quando il sostituente può spingere elettroni s verso l’anello aromatico. • - i : quando il sostituente può attrarre elettroni s dall’anello aromatico. Effetto mesomerico +m -m SOSTITUENTI ATTIVANTI E DISATTIVANTI. L’ossidrile fenolico esercita effetto elettron-attrattore sull’anello ma, per l’effetto mesomerico, le posizioni meno impoverite di elettroni sono le posizioni orto e para. OH OH -OH è attivante e orto-para orientante OH OH Il doppietto elettronico dell’azoto del gruppo amminico è delocalizzato nell’anello. Ciò produce due effetti: 1. le ammine aromatiche sono meno basiche delle ammine alifatiche, 2. La densità elettronica è maggiore nelle posizioni 2, 4 e 6 dell’anello che nelle posizioni 3 e 5. NH2 NH2 -NH2 è attivante e orto-para orientante NH2 NH2 L’effetto elettron-attrattore e l’effetto mesomerico impoveriscono di elettroni sopratutto le posizioni 2,4 e 6 dell’anello aromatico. O N O O N O -NO2 è disattivante e meta orientante O N O O N O I gruppi alchilici legati al benzene aumentano la disponibilità di cariche elettriche negative delocalizzate nell’anello aromatico H H C H - effetto induttivo, attivante e orto-para orientante CH3 I SOSTITUENTI CHE ATTRAGGONO GLI ELETTRONI DELL’ANELLO DI RISONANZA BENZENICO SONO DISATTIVANTI, QUELLI CHE LI RESPINGONO SONO ATTIVANTI. Orto- para- E meta- ORIENTANTI ALCUNI GRUPPI ORIENTANO IN orto E para ALTRI IN meta Gruppi orto- para- orientanti: GRUPPI ALCHILICI. Gruppi orto- para- orientanti: GRUPPI CON UN DOPPIETTO ELETTRONICO LIBERO orto-nitrofenolo 2,4,6 tribromo anilina META ORIENTANTI Acido para-aminobenzoico UN GRUPPO È meta ORIANTANTE QUANDO L’ATOMO LEGATO ALL’ANELLO AROMATICO È CARICO POSITIVAMENTE (O È LEGATO AD ATOMI PIÙ ELETTRONEGATIVI). FINE
Scaricare