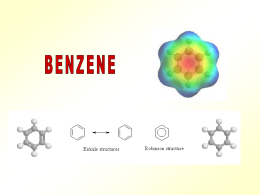
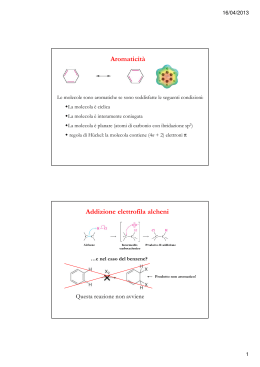
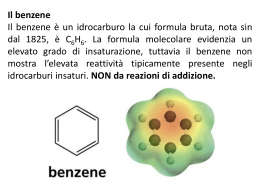
COMPOSTI AROMATICI •Gli alcani ed alcheni hanno diversa reattività chimica. •Vi è un’altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni •Sono i composti aromatici •Il benzene è il loro modello Formula C6H6 GLI ELETTRONI DEI LEGAMI p DELL’ANELLO RISUONANO SULL’INTERA STRUTTURA: di seguito sono disegnate le due formule limite di risonanza Nell’immagine sono rappresentati i legami σ e π Energia di risonanza: si può valutare dal confronto dei calori di idrogenazione, cioè dall’energia che libera in seguito all’addizione di idrogeno ai doppi legami. Il calore di idrogenazione teorico per l’ipotetico cicloesatriene è di 85,8 Kcal/mole, quello reale del benzene è di 49,8 kcal/mole. La differenza di 36 Kcal/mole è l’energia di risonanza del benzene: questo composto è più stabile rispetto a quanto si poteva ipotizzare teoricamente. Composti aromatici policiclici benzene naftalene antracene fenantrene I 10 carboni del naftalene sono tutti ibridati sp2 e ciascuno di essi contribuisce con 1 elettrone alla aromaticità dell’idrocarburo Regola di Huckel per prevedere il comportamento aromatico di composti ciclici e-p = 4n + 2 n = serie dei numeri naturali (comprendendo lo 0) Un composto è aromatico se è ciclico, planare e se ha un numero di elettroni π che rientra nella serie seguente: n 1 2 3 4 . . e-p 2 6 1 14 18 Esempi di composti non aromatici ciclooctatetraene ciclobutadiene NOMENCLATURA LA POSIZIONE DEI SOSTITUENTI PUÒ ESSERE INDICATA COME orto, meta, para Quando sono presenti piu’ di due sostitenti si usano i numeri Il benzene ed in generale i composti aromatici danno reazioni di SOSTITUZIONE ELETTROFILA AROMATICA Meccanismo generale di sostituzione elettrofila aromatica addizione elettrofila eliminazione Carbocatione arilico stabilizzato per risonanza Perché un composto aromatico da reazioni di sostituzione e non di addizione come negli alcheni ? Nu- addizione Il composto è un diene coniugato, l’En. di risonanza è 4 Kcal/mol, il composto non è aromatico sostituzione Il nucleofilo si comporta da base En. di risonanza36 Kcal/mole, il composto aromatico è più stabile del diene coniugato ESEMPI DI SOSTITUZIONE ELETTROFILA AROMATICA ESEMPI DI SOSTITUZIONE ELETTROFILA AROMATICA Nitrazione del benzene Meccanismo di nitrazione Formazione della particella elettrofila nitrobenzene Solfonazione del benzene alogenazione I CATALIZZATORI POLARIZZANO LA MOLECOLA DI ALOGENO (ES. CLORO) E LA TRASFORMANO IN UN ELETTROFILO FORTE. L’ELETTROFILO ATTACCA GLI ELETTRONI p DEL BENZENE MECCANISMO DELLA SOSTITUZIONE ELETTROFILA LA CARICA + DEL CARBOCATIONE RISULTANTE È DELOCALIZZATA SUI CARBONI IN orto E para: VIENE ESPULSO UN PROTONE: Meccanismo generale: Nel caso in cui il benzene è “sostituito”, qual è l’effetto del sostituente sulla reattività dell’anello aromatico? La reattività aumenta o diminuisce? La posizione occupata dal sostituente E2 è casuale? Effetti del sostituente I principali effetti “elettronici” che un sostituente può esercitare sull’anello aromatico sono di due tipi: MESOMERICO (o di risonanza) – si esercita attraverso gli elettroni p e può essere rappresentato da strutture di risonanza. • + m: quando il sostituente può trasferire elettroni p verso l’anello aromatico. • - m: quando il sostituente può estrarre elettroni p dall’anello aromatico. INDUTTIVO – si esercita attraverso elettroni s ed è causato dalle caratteristiche relative di elettronegatività. • + i: quando il sostituente può spingere elettroni s verso l’anello aromatico. • - i : quando il sostituente può attrarre elettroni s dall’anello aromatico. SOSTITUENTI ATTIVANTI E DISATTIVANTI. L’ossidrile fenolico esercita effetto elettron-attrattore sull’anello ma, per l’effetto mesomerico, le posizioni meno impoverite di elettroni sono le posizioni orto e para. OH OH -OH è attivante e orto-para orientante OH OH Il doppietto elettronico dell’azoto del gruppo amminico è delocalizzato nell’anello. Ciò produce due effetti: 1. le ammine aromatiche sono meno basiche delle ammine alifatiche, 2. La densità elettronica è maggiore nelle posizioni 2, 4 e 6 dell’anello che nelle posizioni 3 e 5. NH2 NH2 -NH2 è attivante e orto-para orientante NH2 NH2 L’effetto elettron-attrattore e l’effetto mesomerico impoveriscono di elettroni sopratutto le posizioni 2,4 e 6 dell’anello aromatico. O N O O N O -NO2 è disattivante e meta orientante O N O O N O I gruppi alchilici legati al benzene aumentano la disponibilità di cariche elettriche negative delocalizzate nell’anello aromatico H H C H - effetto induttivo, attivante e orto-para orientante CH3 I SOSTITUENTI CHE ATTRAGGONO GLI ELETTRONI DELL’ANELLO DI RISONANZA BENZENICO SONO DISATTIVANTI, QUELLI CHE LI RESPINGONO SONO ATTIVANTI. Orto- para- E meta- ORIENTANTI ALCUNI GRUPPI ORIENTANO IN orto E para ALTRI IN meta
Scaricare