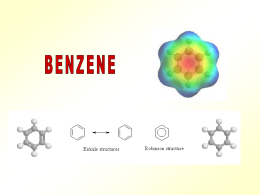
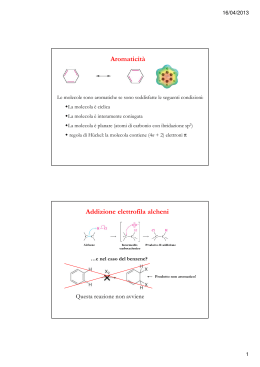
Il benzene Il benzene è un idrocarburo la cui formula bruta, nota sin dal 1825, è C6H6. La formula molecolare evidenzia un elevato grado di insaturazione, tuttavia il benzene non mostra l’elevata reattività tipicamente presente negli idrocarburi insaturi. NON da reazioni di addizione. Aromaticità Il benzene è il capostipite di tutta una classe di composti che presentano nella propria struttura molecolare un anello a sei atomi di carbonio con un sistema di elettroni p delocalizzati. Molti di questi composti sono caratterizzati da particolari fragranze, e per questo motivo, quando sono stati isolati, a partire dal XIX secolo, è stato dato loro il nome di composti “aromatici”. Attualmente, nella terminologia chimica, l’aggettivo “aromatico” non individua una specie caratterizzata da un odore gradevole, ma un composto che abbia reattività e caratteristiche strutturali analoghe a quelle del benzene. La risonanza Il benzene è una molecola coniugata con elettroni p delocalizzati. La descrizione della risonanza nel benzene viene fatta con due strutture di Lewis equivalenti definite strutture limite di risonanza. La struttura reale del benzene è rappresentata dall’ ibrido di risonanza. Delocalizzazione elettronica I sei carboni del benzene sono ibridati sp2, hanno geometria planare con gli angoli di legame di 120°. Ogni atomo di carbonio ha un orbitale p che si estende sotto e sopra il piano della molecola definito dai legami σ. I 6 orbitali p adiacenti si sovrappongono, delocalizzando i 6 elettroni sui sei atomi dell’anello e rendono il benzene una molecola coniugata. La delocalizzazione elettronica π viene normalmente rappresentata con due ciambelle sopra e sotto il piano dell’anello benzenico. Caratteristiche del benzene •Molecola ciclica e planare •Tutti i carboni ibridati sp2 •Tutti i legami C-C hanno la stessa lunghezza Resonance energy of benzene Resonance (or delocalization) energy is the amount of energy needed to convert the true delocalized structure into that of the most stable contributing structure. The empirical resonance energy can be estimated by comparing the enthalpy change of hydrogenation of the real substance with that estimated for the contributing structure. The complete hydrogenation of benzene to cyclohexane via 1,3cyclohexadiene and cyclohexene is exothermic; 1 mole benzene delivers 208.4 kJ (49.8 kcal). Hydrogenation of one double bond delivers 119.7 kJ (28.6 kcal), as can be deduced from the last step, the hydrogenation of cyclohexene This measured resonance energy is the difference between the hydrogenation energy of three 'non-resonance' double bonds and the measured hydrogenation energy: (3 × 119.7) − 208.4 = 150.7 kJ/mol (36 kcal). Note: The values used here are from the article of Wiberg, Nakaji, Morgan (1993). Values from other sources may differ. In the Soviet Union, resonance theory — especially as developed by Linus Pauling — was attacked in the early 1950s as being contrary to the Marxist principles of dialectical materialism, and in June 1951 the Soviet Academy of Sciences under the leadership of Alexander Nesmeyanov convened a conference on the chemical structure of organic compounds, attended by 400 physicists, chemists, and philosophers, where "the pseudo-scientific essence of the theory of resonance was exposed and unmasked" Alexander Nikolayevich Nesmeyanov (Russian: Александр Николаевич Несмеянов) (September 9, 1899, Moscow - January 17, 1980, Moscow) was a prominent Soviet chemist and academician (1943) specializing in organometallic chemistry. He obtained his degree in chemistry in 1920 from Moscow State University where he thereafter served as lecturer, professor, and eventually rector. He was the President of the Soviet Academy of Sciences in 1951–1961. As the rector of the Moscow State University in 1948–1951, he oversaw the construction of its new campus at Sparrow Hills. He was twice awarded the title Hero of Socialist Labor (1969, 1979). Requisiti per l’aromaticità Un composto per poter essere classificato come aromatico deve soddisfare i seguenti criteri: •Nuvola elettronica π ininterrotta. Questo richiede che la molecola sia ciclica, planare e con tutti gli atomi ibridati sp2 •Numero dispari di coppie di elettroni π Regola di Hückel Perchè un composto planare e ciclico sia aromatico, la sua nuvola continua di elettroni deve contenere (4n + 2) π elettroni, dove n è un numero intero positivo compreso lo zero. Annuleni Gli idrocarburi monociclici con un’alternanza di legami singoli e doppi sono chiamati annuleni. Il ciclobutadiene non è aromatico perché non ha un numero dispari di coppie di elettroni. Il ciclooctatetraene non è aromatico perché non ha un numero dispari di coppie di elettroni e tra l’altro non è planare. Esempi Il ciclopropene non è aromatico perché possiede un carbonio ibridato sp3 e quindi perde il requisito indispensabile della nuvola π ininterrotta. Il catione ciclopropenile è aromatico: numero dispari di coppie elettroniche π (una), tutti i carboni sono ibridati sp2 (compreso il carbonio carico positivamente) quindi rispetta i 2 requisiti per l’aromaticità. L’anione ciclopropenile non è aromatico perché ha un numero pari (2) di coppie elettroniche π. Esempi Anche il cicloeptatriene e il ciclopentadiene, come il ciclopropene, non sono molecole aromatiche per la presenza di un carbonio ibridato sp3 che interrompe la coniugazione Idrocarburi policiclici aromatici Esistono anche idrocarburi policiclici aromatici. Per stabilire se un idrocarburo policiclico è aromatico si applicano gli stessi criteri visti per gli idrocarburi monociclici. Naftalene, fenantrene e crisene sono esempi di idrocarburi policiclici aromatici. Composti eterociclici aromatici Esistono composti aromatici che non sono idrocarburi in quanto contengono uno o più atomi diversi dal carbonio. Si definiscono composti eterociclici. Un composto eterociclico è un composto ciclico in cui uno o più atomi dell’anello sono diversi dal carbonio. L’atomo diverso dal carbonio si chiama eteroatomo. Gli elementi comunemente presenti sono azoto, ossigeno e zolfo. La piridina La piridina è un composto eterociclico aromatico. Tutti gli atomi dell’anello, compreso l’azoto, sono ibridati sp2 e ogni atomo possiede un orbitale p. La coppia elettronica di non legame presente sull’azoto è in un orbitale sp2 e non partecipa al sistema π. La piperidina è un composto organico di formula (CH2)5NH. È un'ammina eterociclica con un anello a sei termini con cinque unità metilene e un atomo di azoto. È un liquido incolore, fumante, con un odore descritto come ammoniacale, pepato; il nome deriva dal genere Piper, che è la parola latina per pepe. La piperina è l'alcaloide responsabile del gusto piccante del pepe nero . Con il termine alcaloide si intende una sostanza organica di origine vegetale avente gruppi amminici tali da impartire alla struttura un carattere basico, e dotata di grandi effetti farmacologici in relazione all'assunzione di piccole dosi di sostanza . (E,E)-1-[5-(1,3-benzodioxol-5-il)-1-oxo-2,4pentadienil]piperidina Il pirrolo Anche il pirrolo è aromatico. La coppia di elettroni solitaria presente sull’atomo di azoto, ibridato sp2, si trova in un orbitale p e quindi partecipa al sistema π. In totale abbiamo 3 coppie elettroniche π (2 per ogni doppio legame C-C e una sull’atomo di azoto). Delocalizzazione elettronica nel pirrolo Le strutture limite di risonanza mostrano chiaramente come gli elettroni della coppia solitaria partecipano al sistema π del pirrolo. Furano Anche nel furano, l’ossigeno è ibridato sp2. Delle 2 coppie solitarie, solo quella presente nell’orbitale p partecipa al sistema π del furano. L’altra coppia è localizzata in un orbitale sp2. Altri composti eterociclici aromatici Esistono composti eterociclici aromatici policiclici come la chinolina e l’indolo. Inoltre è possibile la presenza di più eteroatomi come nella purina e nella pirimidina. La pirazina eterociclico è un composto organico aromatico La piperazina è un composto eterociclico esa-atomico in cui sono presenti due atomi di azoto in posizione 1,4. La pteridina è un composto organico aromatico eterociclico. Deriva formalmente dalla fusione di un anello di pirimidina e uno di pirazina. Le flavine (dal latino flavus, giallo), sono un gruppo di composti organici basati sulla pteridina. Struttura della isoalloxazina in forma ossidata Riboflavina La molecola è costituita da tre anelli condensati, che formano il cosiddetto il gruppo isoallosazinico della flavina, il quale è a sua volta legato al ribitolo (aldolo a cinque atomi di carbonio, ovvero il composto derivato dalla riduzione del ribosio) tramite l'atomo di azoto (N) dell'anello centrale. FMN: flavin mononucleotide FAD: flavin adenin dinucleotide FAD: flavin adenin dinucleotide Ricapitolando Perché un composto sia aromatico esso deve: 1.Essere ciclico 2.Essere planare 3.Possedere una nuvola continua di elettroni π (deve essere totalmente coniugato) 4.Possedere 4n+2 elettroni π (un numero dispari di legami π) Antiaromaticità Un composto è antiaromatico se è planare, ciclico e possiede una nuvola continua di elettroni π, ma contiene un numero pari di coppie di elettroni π. Un composto antiaromatico è meno stabile di un composto con elettroni π localizzati. Reattività del benzene Il benzene, per la presenza di elettroni p, si comporta da nucleofilo. Reagisce quindi con elettrofili formando un intermedio carbocationico (figura 1). Questo stadio è analogo al primo stadio della reazione di addizione elettrofila degli alcheni (figura 2). Reattività del benzene L’intermedio carbocationico può, in linea di principio, evolvere in 2 modi: •a) Dare reazione di addizione con il nucleofilo (stesso meccanismo degli alcheni). In questo caso si forma un prodotto finale non più aromatico. •b) Dare reazione di eliminazione (il nucleofilo Z- si comporta da base strappando un protone al carbonio che ha legato l’elettrofilo). In questo caso il prodotto della reazione è aromatico. Reazione di sostituzione elettrofila aromatica Riassumendo: il percorso b corrisponde a un reazione di addizione elettrofila mentre il percorso a corrisponde a un reazione di sostituzione elettrofila. Il benzene da solo reazioni di sostituzione elettrofila. Meccanismo generale Quindi quando il benzene, o generalmente un composto aromatico, reagisce con un elettrofilo (Y+) si forma un prodotto di sostituzione: un idrogeno viene sostituito dall’elettrofilo. La reazione è definita sostituzione elettrofila aromatica. Sostituzione elettrofila aromatica Sono 5 le reazioni di sostituzione elettrofila aromatica: •Alogenazione: un idrogeno è sostituito da un atomo di alogeno. •Nitrazione: un idrogeno è sostituito da un gruppo nitro (NO2). •Solfonazione: un idrogeno è sostituito da un gruppo solfonico (SO2H). •Alchilazione: un idrogeno è sostituito da un gruppo alchilico (R). •Acilazione: un idrogeno è sostituito da un gruppo acile (RC=O). Meccanismo Tutte queste reazioni procedono secondo lo stesso meccanismo generale a due stadi. •reazione con l’elettrofilo e formazione dell’intermedio carbocationico; •una base strappa il protone dall’intermedio con conseguente rigenerazione del sistema aromatico. Meccanismo generale della reazione di sostituzione elettrofila aromatica Generazione dell’elettrofilo I cinque tipi di reazione di sostituzione elettrofila aromatica differiscono solo per la natura dell’elettrofilo (Y+) e per il modo con cui quest’ultimo è generato. Infatti nei meccanismi che di seguito andremo a delineare dobbiamo prevedere una reazione iniziale che riguarda la produzione dell’elettrofilo. Alogenazione E’ possibile sostituire un atomo di idrogeno del benzene con un atomo di bromo, cloro oppure iodio Generazione dell’elettrofilo Nella reazione di bromurazione e clorurazione è necessaria la presenza di un acido di Lewis (FeBr3 oppure FeCl3). L’acido di Lewis, accettando una coppia elettronica dalla molecola di alogeno, indebolisce il legame alogeno-alogeno, rendendo disponibile l’elettrofilo necessario a far partire la reazione di sostituzione. Generazione dell’elettrofilo Nella reazione di iodurazione, l’elettrofilo I+ viene ottenuto per aggiunta di un agente ossidante (ad esempio acido nitrico, HNO3). Nitrazione La reazione di nitrazione è realizzata con acido nitrico in presenza di acido solforico come catalizzatore. Nitrazione A cosa serve l’acido solforico? Tra l’acido nitrico e l’acido solforico avviene una reazione acido base secondo il meccanismo delineato in seguito con formazione dello ione nitronio, un potente elettrofilo. Nota bene: acido nitrico e acido solforico sono acidi di forza differente. L’acido solforico, più forte, accetta una coppia di elettroni dall’acido nitrico che quindi si comporta da base. Formazione del nitrobenzene Lo ione nitronio reagisce poi secondo il meccanismo generalmente delineato in precedenza portando alla formazione del nitrobenzene. Solfonazione La solfonazione viene realizzata con acido solforico concentrato a caldo. E’ l’unica tra le reazioni di sostituzione elettrofila aromatica ad essere reversibile. Acilazione e alchilazione Le reazioni di alchilazione e acilazione di Friedel-Crafts consentono di introdurre sull’anello aromatico rispettivamente un gruppo alchile (R) oppure un gruppo acile (RC=O). Sono importanti reazioni che consentono di introdurre una catena carboniosa sull’anello aromatico. Acilazione: lo ione acilio Nella reazione di acilazione, l’elettrofilo è lo ione acilio che si forma per reazione di un cloruro acilico con un acido di Lewis come AlCl3. Alchilazione Nella reazione di alchilazione si genera un carbocatione alchilico per reazione tra un alogenuro alchilico e un acido di Lewis. La reazione tra il carbocatione e il benzene porta alla formazione di un alchilbenzene. Nel caso in cui il benzene è “sostituito”, qual è l’effetto del sostituente sulla reattività dell’anello aromatico? La reattività aumenta o diminuisce? La posizione occupata dal sostituente E2 è casuale? SOSTITUENTI ATTIVANTI E DISATTIVANTI. I SOSTITUENTI CHE ATTRAGGONO GLI ELETTRONI DELL’ANELLO DI RISONANZA BENZENICO SONO DISATTIVANTI, QUELLI CHE LI RESPINGONO SONO ATTIVANTI. Effetto dei sostituenti sulla reattività La velocità di una reazione di sostituzione elettrofila aromatica dipende molto da un eventuale sostituente già presente sull’anello aromatico. Un sostituente capace di donare elettroni all’anello aromatico facilita da un punto di vista cinetico la reazione di sostituzione elettrofila ed è definito attivante. Un sostituente a richiamo elettronico diminuisce la velocità di reazione ed è definito disattivante. Effetti del sostituente I principali effetti “elettronici” che un sostituente può esercitare sull’anello aromatico sono di due tipi: INDUTTIVO – si esercita attraverso elettroni s ed è causato dalle caratteristiche relative di elettronegatività. • + i: quando il sostituente può spingere elettroni s verso l’anello aromatico. • - i : quando il sostituente può attrarre elettroni s dall’anello aromatico. MESOMERICO (o di risonanza) – si esercita attraverso gli elettroni p e può essere rappresentato da strutture di risonanza. • + m: quando il sostituente può trasferire elettroni p verso l’anello aromatico. • - m: quando il sostituente può estrarre elettroni p dall’anello aromatico. Effetto di risonanza La donazione elettronica può verificarsi anche quando l’anello aromatico è legato a un gruppo in grado di donare elettroni per risonanza (esempio l’anisolo). Esistono poi casi in cui il sostituente richiama elettroni per risonanza. Sostituenti fortemente attivanti: donano elettroni per risonanza e richiamano elettroni per effetto induttivo. Sostituenti attivanti Sostituenti debolmente attivanti: donano elettroni per effetto induttivo. Nota bene: la donazione o il richiamo elettronico è molto più efficace quando avviene per risonanza e non per effetto induttivo. Sostituenti disattivanti Sostituenti disattivanti: rendono l’anello benzenico meno reattivo nella reazione di sostituzione elettrofila. Gli alogeni sono debolmente disattivanti: donano elettroni per risonanza, richiamano elettroni per effetto induttivo. Sostituenti disattivanti Effetti dei sostituenti sull’orientazione Il sostituente già presente determina la posizione del nuovo sostituente Due sono le possibili orientazioni: •il sostituente orienta orto-para (si forma una miscela dell’isomero orto e dell’isomero para); •il sostituente orienta meta (si forma solo l’isomero meta). L’ossidrile fenolico esercita effetto elettron-attrattore sull’anello ma, per l’effetto mesomerico, le posizioni meno impoverite di elettroni sono le posizioni orto e para. OH OH OH -OH è attivante e orto-para orientante OH Il doppietto elettronico dell’azoto del gruppo amminico è delocalizzato nell’anello. Ciò produce due effetti: 1. le ammine aromatiche sono meno basiche delle ammine alifatiche, 2. La densità elettronica è maggiore nelle posizioni 2, 4 e 6 dell’anello che nelle posizioni 3 e 5. NH2 NH2 NH2 -NH2 è attivante e orto-para orientante NH2 L’effetto elettron-attrattore e l’effetto mesomerico impoveriscono di elettroni sopratutto le posizioni 2,4 e 6 dell’anello aromatico. O N O O N O O N O -NO2 è disattivante e meta orientante O N O I gruppi alchilici legati al benzene aumentano la disponibilità di cariche elettriche negative delocalizzate nell’anello aromatico H H C H - effetto induttivo, attivante e orto-para orientante CH3 NOMENCLATURA LA POSIZIONE DEI SOSTITUENTI PUÒ ESSERE INDICATA COME orto, meta, para Quando sono presenti piu’ di due sostitenti si usano i numeri ARENI È IL NOME DELLA CLASSE • • GRUPPO ARILE (AR) IMPORTANTI SONO IL GRUPPO FENILE E QUELLO BENZILE
Scaricare