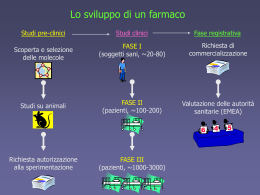
......................................................................................................................................................................................................................... Trasparenza e promozione delle sperimentazioni cliniche nell’ Azienda Ospedaliero‐Universitaria Careggi: a web‐based approach ......................................................................................................................................................................................................................... Tesi di laurea dello studente Gabriele Nuti Firenze ‐ 2011 Sommario Sviluppo di un farmaco........................................................................................... 1 Sperimentazione preclinica................................................................................ 2 Sperimentazione clinica...................................................................................... 3 Fase 1.................................................................................................................. 3 Fase 2.................................................................................................................. 4 Fase 3.................................................................................................................. 4 Richiesta di Autorizzazione all’Immissione in Commercio (AIC) ............... 5 Fase 4.................................................................................................................. 5 La registrazione delle sperimentazioni cliniche................................................... 7 Registri delle sperimentazioni cliniche ............................................................ 11 Clinicaltrials.gov .............................................................................................. 14 Portale della Ricerca Clinica sui Farmaci –Osservatorio Nazionale sulla Sperimentazione Clinica dei Medicinali ..................................................... 21 Razionale................................................................................................................. 31 Obiettivo.................................................................................................................. 32 Materiali e metodi ................................................................................................. 32 Risultati ..................................................................................................................... 36 Conclusioni.............................................................................................................. 37 Note Bibliografiche ................................................................................................ 39 Sviluppo di un farmaco La sperimentazione clinica può essere definita come uno studio sull'uomo finalizzato a scoprire o verificare gli effetti clinici di uno o più interventi sanitari con l'obiettivo di accertarne la sicurezza e/o l'efficacia. Tale intervento clinico può avere delle finalità preventive, diagnostiche o terapeutiche e può essere rappresentato da farmaci, dispositivi medici, metodi diagnostici, fitoterapici, medicine complementari, nutraceutici, interventi chirurgici, procedure riabilitative e qualsiasi altro tipo di intervento. In tutte le sperimentazioni cliniche gli interventi sanitari vengono valutati anche per la loro sicurezza e per la loro tollerabilità. Infine la sperimentazione clinica può valutare altre aspetti degli interventi sanitari, come l’esistenza di fattori genetici che predispongano ad una migliore risposta o ad una maggiore probabilità di sviluppare reazioni avverse (farmacogenetica) o, ad esempio, la loro efficienza in termini di allocazione delle risorse economiche (farmacoeconomia ed health technology assessment). In Italia la sperimentazione con farmaco è attualmente quella più normata e a cui sono stati posti maggiori vincoli e prescrizioni e quella per cui la riflessione metodologica è stata più rilevante. Un farmaco è una sostanza o un'associazione di sostanze che presenta proprietà profilattiche, curative o diagnostiche per una specifica malattia. Lo sviluppo di un farmaco consta di due momenti distinte: la ricerca e lo sviluppo (R e S; in inglese, Research & Development ,R&D). La Ricerca rappresenta l’invenzione, l’esplorazione di nuove molecole che si abbozzano in una prima fase e di cui poi gradualmente se ne approfondisce il profilo. Identificata una molecola di interesse, avente il potenziale di diventare un farmaco innovativo, si procede con lo Sviluppo, la parte sicuramente più lunga e costosa del processo che porta eventualmente alla commercializzazione di nuovi medicinali. È un 1 passaggio fondamentale dopo la fase di ricerca e condizionato da diversi fattori critici tra cui l'efficacia, la sicurezza i tempi ed i costi di sviluppo. Per valutare le caratteristiche del medicinale e quantificare il rapporto tra gli eventuali rischi e i benefici che possono derivare dalla sua assunzione, il potenziale farmaco è sottoposto ad una lunga serie di studi, condotti prima nell'animale e successivamente nell'uomo. Tale processo si articola in diverse fasi: Sperimentazione preclinica studi in vitro, ex vivo ed in vivo sugli animali, che rappresentano la fase di sperimentazione preclinica Sperimentazione clinica studi di fase 1, di fase 2, di fase 3 eseguiti sull'uomo, che rappresentano la sperimentazione clinica richiesta alla autorità competente della' Autorizzazione all'Immissione in Commercio (AIC), seguita dall’eventuale rilascio dell’AIC studi di fase 4 post-commercializzazione, definiti anche come studi di farmacovigilanza Sperimentazione preclinica È utile per studiare come si comporta e qual è il livello di tossicità del potenziale farmaco su tessuti e su organismi viventi complessi e per definirne la farmacocinetica e la farmacodinamica. Inizialmente sono eseguiti gli studi “in vitro” al fine di comprendere le caratteristiche della molecola chimica che si vorrà utilizzare come farmaco. Gli studi in vitro permettono di valutare le caratteristiche chimico-farmaceutiche e di adattarle per sviluppare un farmaco utilizzabile nell’uomo e consentono di iniziare a testare gli effetti del farmaco su colture cellulari. Dopo le prove in vitro vengono fatti esperimenti “ex vivo”, ovvero su tessuti prelevati da animali, consentendo di raccogliere ulteriori dati sulle caratteristiche farmacologiche del composto in studio. Soltanto quando si è appurato in 2 laboratorio che la molecola possiede potenziali effetti biologici si può passare alla sperimentazione sugli animali, definita “in vivo”. Nonostante l’accuratezza dei dati raccolti nei vari modelli di laboratorio, sia in termini di efficacia che di sicurezza, è necessario studiare i nuovi potenziali farmaci anche sull’uomo, attraverso la sperimentazione clinica. Una volta disponibili il profilo farmacologico ed i risultati dei primi studi tossicologici, se essi soddisfano le condizioni preliminari di efficacia e di sicurezza, si richiede alle autorità sanitarie di poter iniziare le fasi della sperimentazione clinica. Sperimentazione clinica Il percorso della sperimentazione clinica inizia con un disegno sperimentale accurato che include vari aspetti critici fra cui l’ipotesi scientifica, il modo di condurre lo studio, gli end-points primari e secondari, la scelta dei soggetti (criteri di inclusione e di esclusione), le dosi di farmaco, la durata del trattamento, i criteri di valutazione clinica dell’efficacia e della fattibilità, l’analisi statistica. Questo processo di sviluppo, che dura in genere almeno dieci anni, è a carico del “proprietario” del farmaco, rappresentato il più delle volte dall'industria farmaceutica e si articola in varie fasi. Fase 1 Rappresenta l'inizio della sperimentazione clinica in cui si valuta il principio attivo sull'uomo,generalmente ma non esclusivamente coinvolge un numero limitato di volontari sani (20-80), in età non avanzata, per i quali è documentata l’assenza e valutata la non predisposizione a malattie. L'obiettivo principale è la individuazione delle dosi di farmaco tollerate in base alla valutazione della tossicità e la valutazione della farmacocinetica e della farmacodinamica del farmaco. Se il farmaco dimostra di avere un 3 livello di tossicità accettabile rispetto al beneficio prevedibile allora può alle essere utilizzato nelle successive fasi della sperimentazione. Fase 2 Definita anche terapeutico-esplorativa, indaga in via preliminare l’efficacia e la sicurezza del farmaco, ovvero la sua capacità di produrre sull'organismo umano, gli effetti desiderati e quelli indesiderati. Serve, inoltre, a comprendere quale sarà la dose migliore da sperimentare nelle fasi successive. Questa fase di sperimentazione coinvolge soggetti volontari affetti dalla patologia per cui il farmaco è indicato. In questa fase è coinvolto un numero maggiore di pazienti, generalmente tra i 300-600, suddivisi in due gruppi per avere un confronto tra il nuovo farmaco e il placebo, o tra il nuovo farmaco ed uno già utilizzato per la stessa indicazione terapeutica e che viene considerato lo standard di trattamento. Fase 3 Definita anche terapeutico-confirmatorio, ha l’obiettivo di definire in maniera conclusiva l’efficacia e la sicurezza del farmaco. In questa fase di sperimentazione i pazienti coinvolti sono generalmente qualche migliaia (1000-5000) a seconda della diffusione della malattia. L’obiettivo è di confermare l’efficacia e la sicurezza in condizioni il più possibile assimilabili a quelle di utilizzo su larga scala. Nella fase 3 si eseguono studi randomizzati in doppio cieco, valutando effetti a breve o lungo termine (da 1 a 6 mesi) in confronto alla terapia considerata standard di riferimento per la patologia in esame. L'efficacia del farmaco è quindi confrontata con quella di un placebo, cioè una sostanza priva del principio attivo, o con altri già in uso o con nessun trattamento. Anche durante questa fase vengono controllate l'insorgenza, la frequenza e la gravità degli eventi avversi e la loro correlazione con la assunzione del farmaco sperimentale Quando i dati sono disponibili ed inviati alle autorità sanitarie, durante il 4 percorso necessario per l’esame del “dossier di registrazione”, si prosegue con la fase 3b. Richiesta di Autorizzazione all’Immissione in Commercio (AIC) Per quanto riguarda l’autorizzazione finale all’uso del farmaco ci sono procedure particolarmente complesse. Completate tutte le fasi della sperimentazioni cliniche, i dati sono raccolti all'interno di un dossier che viene sottoposto all'autorità regolatoria, per richiederne l’A.I.C. La valutazione dei dossier viene fatta da FDA negli Stati Uniti o nell’Unione Europea dalla European Medicines Agency (EMA). A livello nazionale, invece, l’autorità regolatoria è rappresentata dall’Agenzia Italiana del Farmaco (AIFA). Per l’ottenimento dell’AIC, possono essere seguite a livello di EMA diverse procedure, fermo restando che, attualmente, affinchè un farmaco possa essere commercializzato sul territorio italiano il parere di AIFA è necessario. Il processo di registrazione del farmaco avviene a seguito dell’analisi dei dati e di interazioni fra esaminatori da una parte ed esperti dell’azienda farmaceutica dall’altra. Alla fine del processo si può arrivare alla approvazione del farmaco con precise indicazioni terapeutiche e per il trattamento di patologie ben definite. Fase 4 Definita come fase di farmacovigilanza, viene svolta successivamente alla commercializzazione del farmaco. Quest’ultima fase si avvale di sperimentazioni cliniche che valutano il profilo di effectiveness del farmaco utilizzato in pratica clinica. La sperimentazione clinica è, quindi, un processo molto articolato utilizzato per valutare il profilo farmacologico complessivo di un farmaco. La complessità di tale processo è dovuta anche al fatto che ciò vede il coinvolgimento diretto di soggetti umani, che si mettono volontariamente a disposizione per partecipare alla sperimentazione. A livello internazionale 5 sono state elaborate norme per la tutela dei diritti, della sicurezza e del benessere dei soggetti coinvolti nella sperimentazione, le Good Clinical Practice (GCP), cioè Norme di Buona Pratica Clinica, che regolano la ricerca clinica assicurandone l’eticità e garantendo uno standard di qualità ottimale per la scientificità. Le GCP contengono sia i propri principi ispiratori che vere e proprie indicazioni pratiche per la sperimentazione clinica. Le GCP stabiliscono che prima che una sperimentazione abbia inizio devono sempre essere valutati rischi e inconvenienti prevedibili rispetto al beneficio atteso sia per il singolo individuo della sperimentazione, sia per la collettività, affermando che una sperimentazione clinica può proseguire solamente se i benefici previsti giustificano i rischi. Per tale motivo, prima che il soggetto sia sottoposto a sperimentazione è necessario acquisirne il consenso libero, specifico ed informato. La sperimentazione deve essere condotta in conformità ad un protocollo, preventivamente rivisto ed approvato dal Comitato etico (CE) della struttura sanitaria interessata dalla sperimentazione, cioè un organismo formato da personale sanitario e non, indipendente rispetto alla struttura sanitaria presso cui opera e a cui afferiscono i pazienti che saranno coinvolti nella sperimentazione, con il compito di valutare il profilo scientifico, etico e la fattibilità di ogni sperimentazione. Dopo l’approvazione da parte del CE, la sperimentazione clinica deve essere formalmente autorizzata dall’Autorità competente. Tutte le informazioni sulla sperimentazione devono essere trattate e conservate in modo tale da poter essere comunicate, interpretate e verificate in maniera precisa, anche dagli organismi sanitari e regolatori di controllo. 6 La registrazione delle sperimentazioni cliniche L'altruismo e la fiducia sono al centro della sperimentazione clinica, infatti gli individui che si prestano volontariamente alla ricerca lo fanno spinti da un sentimento di altruismo e di fiducia, in quanto credono che la loro partecipazione contribuirà al miglioramento della salute degli altri e, allo stesso tempo, hanno fiducia che i ricercatori ridurranno al minimo i loro rischi durante il corso della sperimentazione. In cambio di questa fiducia e altruismo che rendono possibile la ricerca clinica, il gruppo di ricerca ed il promotore hanno l'obbligo di condurre una ricerca in maniera eticamente corretta e di riferire sui risultati in maniera onesta e trasparente, intendendo con questi due ultimi termini la diffusione per mezzo di pubblicazioni scientifiche di eventuali risultati negativi. L' Evidence Based Medicine (EBM) o medicina basata sull'evidenza rappresenta il paradigma generale della medicina indicando che è necessario basare le proprie decisioni diagnostiche e terapeutiche anche sulla valutazione critica dei risultati reperibili dalla letteratura scientifica. Quindi, nel contesto della EBM, la completezza della pubblicazione dei risultati delle ricerche cliniche, ovvero la disponibilità di tutte le evidenze realmente disponibili in merito ad un certo intervento sanitario, è un elemento fondamentale perché le scelte cliniche siano effettivamente appropriate. Purtroppo però tale completezza è tutt’altro che realizzata. Infatti, i risultati di sperimentazioni cliniche con esito negativo, ovvero diverso da quello atteso, vengono pubblicati sistematicamente meno frequentemente di quelli di sperimentazioni con esito positivo. I ricercatori e le riviste scientifiche sono generalmente più interessati alla pubblicazione di studi clinici che mostrano un grande effetto di un nuovo trattamento, cioè delle sperimentazioni positive, o l'equivalenza del nuovo trattamento rispetto a quello già esistente, ovvero la sua non inferiorità, mentre sia 7 ricercatori che riviste di solito sono meno entusiasti di pubblicare report di studi clinici che dimostrano che un nuovo trattamento è inferiore al trattamento standard, cioè prove negative, o comunque sono meno interessati a studi che non sono né chiaramente positivi né chiaramente negativi, in quanto le prove sono inconcludenti per cambiare la pratica già esistente. A prescindere dal loro interesse scientifico, i risultati delle sperimentazioni sono soggetti anche ad interessi finanziari e per questo particolarmente suscettibili a rimanere inediti e nascosti alla vista del pubblico. Spesso infatti gli interessi dello sponsor o degli autori dello studio prevalgono sul fatto che chiunque dovrebbe essere in grado di apprendere l'esistenza di qualsiasi studio clinico e delle sue caratteristiche più importanti. Un ulteriore problema della pubblicazione selettiva degli studi clinici ricade anche sulla normale pratica clinica che non si basa sul singolo studio ma è data da un insieme di indizi derivati da più studi, perciò va da sé che una pubblicazione parziale incide anche sulla normale pratica clinica, soprattutto se tutti gli studi con un certo tipo di risultato vengono sistematicamente non pubblicati. La non pubblicazione dei risultati degli studi clinici può influenzare l’attività dei clinici, di altri ricercatori e di esperti che scrivono le linee guida per la pratica clinica o comunque di tutti quei professionisti che operano in accordo alle evidenze disponibili. Da questo problema è nata la necessità di trovare strumenti adeguati a favorire la pubblicazione dei risultati degli studi clinici, indipendentemente dalla direzione del loro risultato. Uno degli strumenti ideati a tal proposito è stato quello della registrazione delle sperimentazioni cliniche prima del loro inizio in registri pubblicamente disponibili. Se tutti gli studi clinici, infatti, venissero registrati sistematicamente prima del loro inizio su un archivio pubblico sarebbero disponibili informazioni per ogni studio clinico e sarebbe possibile presumere un tempo ragionevole in cui attendersi la pubblicazione dei loro risultati. 8 Il primo passo verso la realizzazione di tali registri è avvenuta negli Stati Uniti grazie al National Institutes of Health che attraverso il suo National Library of Medicine (NLM) e con la partecipazione della Food and Drug Administration (FDA) e di altri organi, ha sviluppato la Clinical Trials Data Bank resa disponibile liberamente in Internet il 29 Febbraio 2000, a seguito di una riforma di modernizzazione legislativa (Modernization Act) voluta dalla stessa FDA nel Novembre del 1997. Al fine di garantire che le informazioni disponibili nella Clinical Trials Data Bank fossero in una forma facilmente comprensibile si è stabilita che per ogni sperimentazione clinica fossero fornite informazioni descrittive del farmaco, informazioni sul reclutamento dei pazienti, l'ubicazione e i contatti delle strutture sanitarie coinvolte ed i dati amministrativi. La registrazione degli studi clinici era, comunque, in gran parte volontaria e l'accesso alle informazioni per il pubblico era molto variabile e comunque i registri contenevano solo una piccola parte delle sperimentazioni cliniche realmente effettuate. D’altra parte l’utilità dello strumento, dipende in maniera stringente dalla diffusione del suo utilizzo. Quindi, dopo un dibattito che ha coinvolto tutta la comunità scientifica, nel 2005 attraverso un editoriale pubblicato contemporaneamente su tutte le riviste scientifiche affiliate al International Committee of Medical Journal Editors (ICMJE), si è stabilita la obbligatorietà di una completa registrazione di tutti gli studi clinici come soluzione al problema della diffusione selettiva dei risultati ed è stato annunciato che tutte le 11 riviste facenti parte del ICMJE avrebbero adottato una politica a favore della registrazione dei trials per promuovere questo obiettivo. Le riviste membro del ICMJE richiedono, come condizione vincolante alla considerazione alla pubblicazione, la registrazione dello studio clinico in un registro pubblico. Le sperimentazioni devono essere registrate prima dell’inizio del reclutamento dei pazienti. Questa politica viene applicata a qualsiasi sperimentazione clinica che ha avuto inizio dopo il 1 Luglio 2005, mentre per gli studi clinici che hanno avuto inizio prima di tale data, l'ICMJE richiede la registrazione a partire dal 13 9 Settembre 2005 prima di considerare una loro eventuale pubblicazione. L’ICMJE ha poi ampliato il concetto con il quale possiamo definire una sperimentazione clinica, ovvero come un qualsiasi progetto di ricerca che assegna in maniera arbitraria soggetti umani in gruppi di interventi o di confronto per studiare la causa-effetto tra un intervento medico. Per l’ICMJE non rientrano in questa definizione studi volti ad altri fini, come studiare la farmacocinetica o conoscere effetti tossici come, ad esempio gli studi di Fase 1. L’ICMJE non sostiene un particolare registro, ma le sue riviste membro richiedono agli autori dello studio di registrare il loro trial clinico in un registro che soddisfa determinati criteri. Anzitutto il registro deve essere accessibile al pubblico gratuitamente, deve essere aperto a tutti i potenziali dichiaranti, gestito da una associazione senza fini di lucro e deve garantire la validità dei dati registrati, permettendo inoltre agli utenti la consultazione elettronica. Un registro deve comprendere una base standard di informazioni che riguardano lo studio clinico: 9 un numero unico di identificazione dello studio 9 intervento/i sanitario/i sperimentale/i e su quello/i di confronto 9 ipotesi dello studio 9 outcome primario e secondari 9 criteri di eleggibilità 9 date chiave della sperimentazione (data di registrazione, data d’inizio arruolamento, data di conclusione) 9 dimensione della popolazione in studio 9 fonti di finanziamento 9 contatti degli sperimentatori principali. La registrazione obbligatoria di ogni studio clinico è solo una parte di un progetto più grande che si prefigge la completa trasparenza nei confronti della esecuzione e del reporting degli studi clinici. 10 Registri delle sperimentazioni cliniche Negli ultimi anni la registrazione di sperimentazioni cliniche ha ottenuto sempre maggiore attenzione ed a livello internazionale il numero di registri è cresciuto progressivamente. Tra i registri elettronici pubblici internazionali, certamente quello più noto è Clinicaltrials.gov, redatto a livello statunitense. Per quanto riguarda il panorama nazionale italiano, da alcuni anni è stato istituito l’Osservatorio sulla Sperimentazione Clinica dei Medicinali, recentemente ampliato con la sezione Portale della Ricerca Clinica dei Farmaci, redatto a livello italiano. Oltre a questi abbiamo anche altri registri: Eudract - European Union Drug Regulating Authorities Clinical Trials (Figura 1); database di tutte le sperimentazioni cliniche nella Comunità Europea (CE) dal 1 Maggio 2004 in avanti. Si accede a seguito di una registrazione dei propri dati. I codici di identificazione delle sperimentazioni cliniche dovrebbero essere i soliti di quelli di clinicaltrials.gov, per questo adesso il registro si trova in fase di revisione. Attualmente in Europa è in via di sviluppo un sistema che permette di armonizzare, regolare e controllare tutto l’iter informativo riguardante le sperimentazioni cliniche sui medicinali. 11 Figura 1. Home page del portale https://eudract.ema.europa.eu/ ISRCTN - International Standard Randomised Controlled Trial Number (Figura 2); è un registro che contiene un set di informazioni base attraverso le quali è garantito il monitoraggio delle sperimentazioni cliniche in tutto il loro corso, dal protocollo iniziale alla pubblicazione dei dati. Ad ogni sperimentazione clinica viene assegnato un numero identificativo ISRCTN di 8 cifre. I dati presenti non sono mai cancellati dal registro ISRCTN, salvo nei casi di duplicazioni. Questo assicura che le informazioni sulle sperimentazioni registrate con un ISRCTN risultano sempre disponibili. Il registro ISRCTN è conforme ai requisiti stabiliti dall'Organizzazione Mondiale della Sanità (OMS) nell’ International Clinical Trials Registry Platform (ICTRP) e alle linee guida dell’ ICMJE. 12 Figura 2. Home page del portale http://isrctn.org/ ICTRP - International Clinical Trials Registry Platform (Figura 3); è il registro della World Health Organization (WHO) ed ha lo scopo di assicurare una visione completa della ricerca a tutti coloro che sono coinvolti nel processo decisionale di assistenza sanitaria e permette di migliorare la trasparenza della ricerca. 13 Figura 3. Home page del portale http://apps.who.int/trialsearch/ Clinicaltrials.gov Clinicaltrials.gov è un portale nato nel 2000 per iniziativa della NIH che, attraverso il suo National Library of Medicine (NLM), ha sviluppato il sito in collaborazione con la FDA, a seguito della modernizzazione del pacchetto legge della FDA stessa avvenuto nel Novembre del 1997. Clinicaltrials.gov funge da registro e banca dati delle sperimentazioni cliniche gestite dal NIH statunitense, con lo scopo di registrare tutte le informazioni relative alle sperimentazioni cliniche in corso finanziate sia da strutture pubbliche che private. Clinicaltrials.gov fornisce informazioni costantemente aggiornate di sperimentazioni cliniche per una vasta gamma di malattie e condizioni. All'interno del sito web sono facilmente consultabili informazioni come lo scopo e lo stato della sperimentazione, chi può partecipare allo studio, il luogo e i contatti telefonici per ottenere maggiori informazioni. Il progetto 14 fu accolto con favore dagli operatori della sanità perché, per la prima volta, si poteva accedere liberamente alle informazioni riguardanti le sperimentazioni cliniche. Nel 2004 la ICMJE ha annunciato che i dati provenienti dalle sperimentazioni cliniche sarebbero da quel momento stati presi in considerazione per la pubblicazione sulle maggiori riviste medico scientifiche esclusivamente nel caso di trial registrati sul portale clinicaltrials.gov. Tolleranza zero, perché il termine massimo di registrazione era stato fissato dalla ICMJE al 13 Settembre 2005. Attualmente questo registro contiene 111.142 sperimentazioni cliniche sponsorizzate dal NIH, da altre agenzie o dall'industria privata; gli studi elencati nel database vengono effettuati in tutti i 50 Stati membri e in 174 Paesi extra-US. Il registro riceve in media 65000 visitatori al giorno, contando una media di 50 milioni di pagine visitate ogni mese. Nella pagina iniziale (Figura 4) del sito si possono trovare le informazioni principali: Descrizione generale (Figura 5): che cosa è il portale e quali sono gli obiettivi che si prefigge. Figura 4. Home page del portale http://clinicaltrials.gov/ 15 Figura 5. Schermata di visualizzazione descrizione generale Ricerca di sperimentazioni cliniche: aprendo questo link si trova un ulteriore gamma di scelta con grado di finezza diverso per impostare la ricerca di una sperimentazione. Infatti è possibile effettuare: una ricerca base (Figura 6) in cui si inserisce una parola o una frase che contenga il nome di una condizione medica o un intervento 16 Figura 6. Schermata di visualizzazione di una ricerca base su http://clinicaltrials.gov/ct2/search una ricerca avanzata (Figura 7) in cui invece sono disponibili una serie di parametri maggiori per affinare la ricerca come ad esempio filtrare la ricerca per: ◦ reclutamento chiuso/aperto ◦ studi con risultati/senza risultati ◦ studi interventistici/osservazionali ◦ malattia ◦ farmaco/dispositivo/vaccino ◦ sponsor ◦ sede della sperimentazione ◦ sesso ed età ◦ fase di sperimentazione ◦ ultimo aggiornamento 17 Figura 7. Schermata di visualizzazione di una ricerca avanzata una ricerca per argomento (Figura 8) in cui possiamo scegliere tra 6 diverse categorie: ◦ condizioni, in ordine alfabetico per categoria (es. I ipertensione) ◦ principio attivo, in ordine alfabetico (es. L lansoprazolo) ◦ sponsor, in ordine alfabetico ◦ sede della sperimentazione, suddivisa a sua volta, in aree geografiche (es. Europa) ◦ malattie rare, in ordine alfabetico ◦ integratori alimentari, in ordine alfabetico 18 Figura 8. Schermata di visualizzazione di una ricerca per argomento una ricerca per area geografica (Figura 9) attraverso planisfero Figura 9. Schermata di visualizzazione di “ricerca per area geografica” 19 Istruzioni per gli sperimentatori e gli sponsor (Figura 10): in questa sezione sono descritte le istruzioni su come registrare le sperimentazioni cliniche. Figura 10. Schermata di visualizzazione delle istruzioni per gli sperimentatori e gli sponsor Una volta all'interno del link si trovano: istruzioni più dettagliate per lo sperimentatore e lo sponsor in cui si afferma che il primo step obbligatorio da seguire per l'avvio e la conduzione di una sperimentazione clinica è quello di inviare i dati a Clinicaltrials.gov utilizzando il Protocol Registration System (PRS). US Public Law 110-85 (FDAAA): la Food and Drug Administration Amendments Act del 2007,approvata il 27 Settembre 2007. La legge richiede la registrazione obbligatoria e la pubblicazione dei risultati delle sperimentazioni cliniche di farmaci, prodotti biologici e dispositivi medici. Attraverso un ulteriore link si può accedere alla pubblicazione della legge vera e propria. 20 Informazioni di base (Figura 11): in questa sezione si possono trovare ulteriori informazioni sulle sperimentazioni cliniche e su come utilizzare Clinicaltrials.gov o accedere ad altre informazioni sulla salute dei consumatori del NIH statunitense. Figura 11. Schermata di visualizzazione delle informazioni di base In conclusione, clinicaltrials.gov rappresenta uno strumento sviluppato da e per gli operatori del settore come strumento per garantire la trasparenza della sperimentazione clinica, ma è stato costruito in modo da consentire il libero accesso a tutti i potenziali utenti, operatori del settore e non, ad informazioni riguardanti le sperimentazioni e la loro realizzazione. Portale della Ricerca Clinica sui Farmaci –Osservatorio Nazionale sulla Sperimentazione Clinica dei Medicinali Nel 2000 il Ministero della Sanità ha stabilito la necessità di raccogliere tutti i dati riguardanti le sperimentazioni cliniche in un unico 21 centro collettore centralizzato, l’Osservatorio Nazionale sulla Sperimentazione Clinica dei Medicinali (OsSC). Attingendo da questo registro riservato agli operatori del settore è stato possibile costituire il Portale della Ricerca Clinica sui Farmaci (PRC) che rappresenta una fonte di informazione pubblica sulle sperimentazioni cliniche dei medicinali condotte in Italia, sulle norme ed i principi etici che regolano la ricerca, sulle iniziative in materia di sperimentazione promosse dall'AIFA (Figura 12). L'obiettivo principale del PRC è quello di aumentare la trasparenza e di promuovere la conoscenza sulla ricerca clinica farmacologica a beneficio dei pazienti, della comunità scientifica e del pubblico in generale. A differenza di clinicaltrials.gov, nel PRC, si possono trovare informazioni solo sulle sperimentazioni cliniche che riguardano i farmaci, non trovando invece informazioni su sperimentazioni cliniche per dispositivi medici. Il PRC si articola in un'area di consultazione pubblica e in un'area riservata agli operatori professionali, disponibile anche in lingua inglese. Figura 12. Home page del Portale di Ricerca Clinica dell’AIFA http://ricercaclinica.agenziafarmaco.it/it/node/1 22 Area Pubblica L'area pubblica, rappresentata dal PRC, consente la consultazione dei dati dei protocolli delle sperimentazioni cliniche sostenute in Italia dal 1 Maggio 2004 fino ad oggi con l'eccezione degli studi di fase 1. Tali dati sono sotto la responsabilità dei promotori delle sperimentazioni, delle organizzazioni delegate dai promotori e degli organismi pubblici preposti alla valutazione dei protocolli (Comitati etici, autorità regolatorie). All'interno del PRC sono disponibili per la consultazione le norme che regolano la sperimentazione e i principali documenti internazionali di riferimento, come la Dichiarazione di Helsinki e la Convenzione di Oviedo. Inoltre, sono consultabili il glossario dei termini, l'archivio della newsletter e tutte le attività editoriali AIFA, tra cui il rapporto annuale sulla sperimentazione e le campagne di comunicazione istituzionali. All'interno del portale si possono avere informazioni su: Progetto: con informazioni di base sulla funzione PRC e sui suoi obiettivi, con l'elenco dei soggetti che vi partecipano Normativa: all'interno del quale è reperibile una raccolta di norme in materia di sperimentazione clinica con medicinali Area Documentale: in cui si possono trovare: ◦ Pubblicazioni dell'OsSC come il Bollettino delle prove cliniche di farmaci in Italia nell'anno corrente ◦ Bandi di Ricerca AIFA ◦ Comunicazioni al cittadino Ricerca Studi Clinici: all'interno del link è possibile effettuare una ricerca libera per visualizzare i dati sulle sperimentazioni cliniche effettuate in Italia dal 1 Maggio 2004. I dati vengono forniti dai Promotori delle sperimentazioni o dalle organizzazioni delegate. Le informazioni reperibili al potenziale partecipante, sono sotto la responsabilità dello 23 sperimentatore che opera presso il centro clinico dove la sperimentazione a luogo. La ricerca può essere effettuata adoperando diversi filtri di ricerca: ricerca libera (Figura 13): permette di impostare la ricerca utilizzando almeno una parola/frase della sperimentazione che interessa trovare, oppure tutta la frase, ad esempio digitando la parola “ipertensione” si trovano tutte le sperimentazioni cliniche che riguardano questa patologia. Figura 13. Schermata di visualizzazione di ricerca studi clinici ricerca avanzata (Figura 14): permette di impostare una ricerca più fine, in cui le opzioni disponibili sono: ◦ tipo di studio ◦ stato dello studio ◦ area terapeutica ◦ condizione clinica ◦ fase dello studio (1 sui minori, 2, 3 o 4) 24 ◦ studio profit o no profit ◦ età ◦ sesso ◦ area geografica ◦ promotore ◦ identificativo dello studio ◦ anno dello studio Figura 14. Schermata di visualizzazione di ricerca avanzata studi clinici ricerca geografica (Figura 15): permette una ricerca sulla cartina italiana dove è riportato il numero delle sperimentazioni cliniche condotte in ciascun regione; selezionando una regione è possibile visualizzare la distribuzione delle sperimentazioni cliniche per provincia. 25 Figura 15. Schermata di visualizzazione di ricerca geografica studi clinici Tutti i dati delle sperimentazioni che si trovano all'interno del sito sono inserite all'interno di una tabella in cui compare: ◦ Codice identificativo Eudract di 8 cifre ◦ Tipologia dello studio ◦ Stato dello studio, se è concluso o aperto ◦ Titolo del protocollo di studio ◦ Condizione clinica ◦ Dettaglio dello studio, rappresenta un ulteriore link al cui interno si trovano: informazioni riassuntive sulla sperimentazione, elenco dei farmaci in studio, l'elenco dei centri partecipanti, la descrizione dello studio, l'eleggibilità e ulteriori informazioni come il codice ISRCTN, il codice OsSC, la data del protocollo o la data del rilascio del parere unico. 26 Consultazione registri all'interno di questo link è possibile trovare: ◦ Comitati etici istituiti con una ricerca per area geografica, avanzata o lista completa ◦ Centri privati con gli stessi parametri di ricerca di sopra ◦ Laboratori privati ◦ CRO autocertificate attraverso la consultazione di un elenco ordinato alfabeticamente o con un criterio Italia/Estero. Area riservata L'area riservata, rappresentata dalla sezione “Utenti abilitati” di OsSC (Figura 16), è accessibile esclusivamente agli organismi pubblici responsabili della valutazione dei protocolli, che sono il Comitato etico (CE) e/o l'autorità competente, ed alle organizzazioni responsabili della gestione, dell'avvio e dell'eventuale finanziamento degli studi, che sono i promotori e le CRO. Possono accedervi anche le regioni e le province autonome attraverso i vari Assessorati della Sanità per la consultazione delle sperimentazioni cliniche che si svolgono nel loro territorio di competenza. In accordo alla normativa vigente ogni utente, tramite le credenziali rilasciate all'AIFA, user id e password, è obbligato a comunicare per via telematica i dati di competenza relativi ai protocolli di ricerca. Tali dati costituiscono il supporto informativo dell'OsSC e del Registro degli Studi Osservazionali (RSO). 27 Figura 16. Home page del registro OsSC http://oss-sper-clin.agenziafarmaco.it/ Tale registro ha l'obiettivo di garantire la sorveglianza sulle sperimentazioni cliniche dei medicinali sperimentali condotte in Italia; raccoglie ed elabora tutti i dati delle sperimentazioni e ne divulga i resoconti attraverso delle pubblicazioni periodiche. Il ruolo dell'OsSC vuole essere quello di semplificazione e armonizzazione delle procedure e delle documentazioni necessarie ad iniziare, emanare, concludere e riportare i risultati delle sperimentazioni, oltre che la realizzazione di iniziative di formazione con le regioni e le province autonome. L’OsSC ha costituito una rete di comunicazione fra gli utenti con l’obiettivo di rendere più facile lo scambio di informazioni e quindi metodi più efficaci e più semplici per reperirle ed ha sviluppato dei forum dove si possono scambiare opinioni o dove portare avanti discussioni su temi specifici. All'interno del sistema informativo dell'OsSC esiste un alto livello di sicurezza sulle informazioni e sull'accesso a garanzia della riservatezza delle informazioni trattate; inoltre la circolarità delle informazioni specifiche sulle sperimentazioni è limitata ai soggetti coinvolti. Per semplificare il percorso 28 delle ricerche ed il funzionamento delle banche dati l’OsSC ha messo in rete una piattaforma di e-learning, facilmente reperibile dal sito, nella quale viene spiegata modalità di navigazione all’interno del database e l’uso dei molteplici strumenti alla disposizione degli utenti. In conclusione, il PRC rappresenta uno strumento elettronico di libero accesso costituito grazie ai dati provenienti dal registro OsSC, attraverso il quale gli operatori del settore possono garantire una maggiore trasparenza nell’ambito della sperimentazione clinica. Il registro, pur non rendendo pubblici tutti i dati raccolti, è in grado di offrire agli interessati una selezione significativa di informazioni sulle sperimentazioni cliniche. Una problematica comune a tutti i registri attualmente utilizzati riguarda la loro fruibilità da parte dell’utente. Infatti, il reperimento di queste informazioni disponibili online può non risultare facile sia per la poca informazione che viene fatta se non all'interno del settore, sia per le difficoltà pratiche che un cittadino medio può incontrare nell'utilizzo del mezzo informatico. Nello specifico, le principali differenza tra PRC-OsSC e clinicaltrials.gov, sono: 9 in PRC-OsSC sono presenti esclusivamente le sperimentazioni cliniche su farmaci, mentre sono esclusi tutti gli altri tipi di studio, come quelli su dispositivi medici, presenti invece a livello di clinicaltrials.gov. 9 nel registro italiano si ha l’esistenza di una area riservata accessibile solo agli operatori ed un'area pubblica che consente il libero accesso a tutti i potenziali utenti, operatori del settore e non, ad informazioni riguardanti le sperimentazioni e la loro realizzazione. Questa suddivisione implica una complessità maggiore del sito del registro italiano andando soprattutto a discapito della sua usabilità da parte di soggetti che non siano operatori del settore. 9 in PRC-OsSC non sono disponibili indicazioni precise sui centri clinici in cui la sperimentazione viene condotta, né i contatti dello sperimentatore principale della sperimentazione. 29 Quindi, sebbene i due registri offrano un set di informazioni lievemente ma non trascurabilmente diverso, la struttura di Clinicaltrials.gov, rende le informazioni disponibili più fruibili anche da parte di cittadini che non operino nel settore, dando anche la possibilità di entrare in contatto direttamente con i centri sperimentali. A livello pratico la ricerca di una sperimentazione clinica sui due registri si articola in maniera differente: 9 nel registro PRC-OsSC sono 7 operazioni per arrivare alla visualizzazione dei contatti di una sperimentazione clinica di un farmaco per la patologia che a noi interessa 9 nel registro clinicaltrials.gov sono invece 4 operazioni per ottenere lo stesso risultato. Per comprendere in maniera ancora migliore la differenza di utilizzo tra i due registri, vediamo come la ricerca di una sperimentazione clinica per un farmaco (es. anti ipertensivo) si articola. PRC-OsSC 1. digitare www.agenziafarmaco.gov.it/it 2. cliccare sul link “entra nel sito” al centro della pagina 3. cliccare sulla finestra “ricerca clinica” che si trova in basso a sinistra 4. cliccare sul link “ricerca studi clinici” di colore giallo in alto a sinistra della pagina 5. inserire la patologia di interesse nel campo “ricerca libera”, quindi nel nostro esempio ipertensione e cliccare “cerca” 6. cliccare sul “codice Eudract” della sperimentazione clinica di interesse 7. cliccare sul link “elenco centri partecipanti” Clinicaltrials.gov 1. digitare www.clinicaltrials.gov 2. cliccare sul link “search for clinical trials” 3. inserire la patologia nel apposito campo e cliccare “search” 4. cliccare sul titolo della sperimentazione clinica di interesse 30 Razionale Sebbene attraverso il portale PRC dell'AIFA si renda pubblicamente disponibile una panoramica delle sperimentazioni cliniche approvate, o in corso di approvazione nell'area geografica selezionata, ancora non si dispone di informazioni sufficientemente dettagliate tali da garantire agli operatori sanitari e/o al paziente interessato l'eventuale accesso alla sperimentazione, ovvero non ci sono nominativi e/o recapiti a cui fare riferimento per contattare il centro sperimentale selezionato. Inoltre, lo “stato” di una sperimentazione clinica, così come è riportato nell'area pubblica del PRC, riflette unicamente l'espressione del parere del comitato etico del Centro Coordinatore e non lo stato reale della sperimentazione nel centro sanitario di interesse (attivazione del centro, inizio arruolamento, fine arruolamento). Nonostante lo sforzo prodotto dall'AIFA nell'aprire al pubblico parte dell'OsSC, il registro rimane uno strumento dedicato principalmente agli addetti ai lavori e, pertanto, di non semplice consultazione da parte del comune cittadino. Infine all'interno del PRC risultano registrate esclusivamente le sperimentazioni cliniche dei medicinali, ma non le sperimentazioni interventistiche non farmacologiche, come ad esempio le sperimentazioni con dispositivi. Se la raccolta e la pubblicazione delle suddette informazioni pone ovvi problemi logistici a livello centrale da parte dell'AIFA, l'attività di informazione nei confronti dei cittadini sulle sperimentazioni cliniche in atto e sulle modalità di accesso alle stesse può e deve essere svolta a livello locale, da parte delle Regioni e/o delle Aziende Ospedaliere, con l'apporto dei CE che nell'ambito della loro attività raccolgono tutte quelle informazioni necessarie e sufficienti per indirizzare correttamente il paziente alle strutture sanitarie partecipanti alle sperimentazioni cliniche. 31 Obiettivo Il nostro progetto si prefigge come obiettivo quello di garantire la trasparenza delle sperimentazioni cliniche in corso nell’Azienda Ospedaliero Universitaria di Careggi e di promuovere la conoscenza sulla ricerca clinica a beneficio dei pazienti e degli operatori sanitari attraverso la pubblicazione online sul sito dell’AOUC delle sperimentazioni stesse ampliando il carnet di informazioni disponibili. Materiali e metodi Individuazione sperimentatori responsabili di sperimentazioni cliniche in AOUC attraverso la consultazione dei registri del Comitato etico Coinvolgimento degli sperimentatori responsabili delle sperimentazioni cliniche svolte in AOUC tramite l’invio di una mail informativa sul progetto e della tabella da compilare (Figura 17) Figura 17. Tabella inviata a medici responsabili di sperimentazioni cliniche in AOUC 32 Raccolta dati ed organizzazione: le informazioni ricevute sono state esaminate e riorganizzate attraverso la suddivisione delle sperimentazioni cliniche in classi terapeutiche. Costruzione sito: all’interno del portale dell’AOUC (http://www.aoucareggi.toscana.it/internet/index.php) (Figura 18) è stato inserito un link “sperimentazione clinica” attraverso il quale è possibile accedere alla sezione online appositamente dedicata alla pubblicazione delle informazioni raccolte tramite l’iniziativa (Figura 19). Figura 18. Home page del sito dell’AOUC http://www.aou- careggi.toscana.it/internet/index.php Aggiornamento dati: i dati presenti all’interno del sito vengono aggiornati con frequenza trimestrale, a seguito di un lavoro di monitoraggio presso i medici responsabili delle sperimentazioni cliniche già pubblicate in modo da garantire l'accesso ad informazioni che siamo il più aggiornate possibile. 33 Figura 19. Schermata di visualizzazione della sezione “sperimentazione clinica” nel sito dell’AOUC Una volta all'interno del suddetto link, dopo una breve descrizione del concetto di sperimentazione clinica e della mission del nostro progetto, sono presenti le sperimentazioni cliniche suddivise in dieci aree terapeutiche differenti: Ematologia Farmacologia/Tossicologia Gastroenterologia Malattie endocrine e metaboliche Malattie dell'apparato muscolo-scheletrico Nefrologia-urologia Neurologia Oftalmologia Oncologia Reumatologia 34 Per ciascuna sperimentazione sono pubblicate alcune informazioni sullo studio contenute all'interno di una tabella standard (Figura 20); le informazioni che si ritrovano nelle tabelle sono ben più dettagliate rispetto a quelle del PRC dell'AIFA e soprattutto presentano i contatti diretti del medico responsabile della sperimentazione e il numero telefonico del centro sperimentale. Nel dettaglio possiamo trovare: ◦ Titolo della sperimentazione clinica, in italiano e in lingua inglese ◦ Fase di sperimentazione ◦ Codice protocollo ◦ Promotore ◦ Condizione clinica ◦ Reparto ◦ Stato delle sperimentazione ◦ Reclutamento ◦ Contatti ◦ Telefono 35 Figura 20. Schermata di visualizzazione di una delle sperimentazioni cliniche che si trovano pubblicate nel sito dell’AOUC sezione “Sperimentazione clinica” Risultati La raccolta dati è stata avviata a marzo 2011. Gli sperimentatori progressivamente contattati sono stati 89, con il coinvolgimento iniziale dei centri clinici in cui si svolge un numero maggiore di sperimentazioni. La sezione “Sperimentazione clinica” è stata ufficialmente rilasciata on line il 12 aprile 2011. Attualmente (13 settembre 2011) le sperimentazioni contenute nel sito sono in totale 109. Il numero di sperimentazioni cliniche per le diverse aree terapeutiche è indicato nella Tabella 1. Le informazioni contenute sono in corso di integrazione e di continuo aggiornamento, pertanto le informazioni pubblicate sul sito non riflettono esattamente il numero totale delle sperimentazioni cliniche in corso in AOUC. 36 Tabella 1. Numero di sperimentazioni pubblicate per area terapeutica Area Terapeutica Numero sperimentazioni pubblicate (%) Ematologia 30 (27,5) Farmacologia – Tossicologia 1 (1) Gastroenterologia 7 (6,5) Malattie endocrine e metaboliche 11 (10) Malattie dell’apparato muscolo- 7 (6,5) scheletrico Nefrologia - Urologia 4 (4) Neurologia 8 (7) Oftalmologia 9 (8) Oncologia 26 (24) Reumatologia 6 (5,5) Conclusioni La pubblicazione di informazioni facilmente accessibili sulle sperimentazioni cliniche in corso in un’azienda ospedaliera e dei contatti diretti dei medici che ne sono responsabili, è l’elemento qualificante del nostro progetto poiché, oltre promuovere la trasparenza delle sperimentazioni cliniche svolte in AOUC, viene fornita una informazione ad operatori sanitari e pazienti sulle sperimentazioni cliniche in atto, informazione che assume particolare importanza soprattutto per patologie per cui non esistano ancora trattamenti autorizzati o terapie standard con efficacia soddisfacente. Nei primi 50 giorni di esistenza, la sezione “Sperimentazione clinica” del sito dell’AOUC è stata oggetto di 1664 accessi, a testimonianza indiretta dell’interesse per le informazioni pubblicate. Nel contesto generale della sperimentazione clinica, l’iniziativa realizzata, oltre all’impatto sulla trasparenza e quindi sull’eticità del 37 processo, può sicuramente favorire il reclutamento dei pazienti per le sperimentazioni cliniche in corso e promuovere la collaborazione tra i ricercatori. 38 Note Bibliografiche - Agenzia Italiana del Farmaco (AIFA): http://www.agenziafarmaco.gov.it/it - Azienda Ospedaliera Universitaria di Careggi (AOUC): http://www.aoucareggi.toscana.it/internet/index.php - Clinicaltrials.gov: http://clinicaltrials.gov/ - De Angelis C.D. Drazen J.M. Frizelle F.A. et al. Clinical trial registration: a statement from the International Committee of Medical Journal Editors. JAMA. 2004 Sep 15;292(11):1363-4 - European Union Drug Regulating Authorities Clinical Trials (Eudract): https://eudract.ema.europa.eu/ - International Clinical Trials Registry Platform (ICTRP): http://www.who.int/ictrp/en/ - International Standard Randomised Controlled Trial Number (ISRCTN): http://isrctn.org/ - Miller J.D. Registering clinical trial results: the next step. JAMA. 2010 Feb 24;303(8):773-4. - Osservatorio Nazionale sulla Sperimentazione Clinica dei Medicinali (OsSC): http://oss-sper-clin.agenziafarmaco.it/ - R.Paoletti, S.Nicosia, F.Clementi, G.Fumagalli. Farmacologia generale e molecolare. Terza edizione, Utet 2004. 39
Scarica