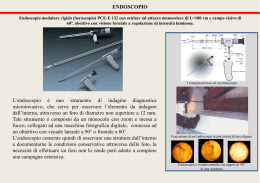
Aiienda Os ped a lìera di Caserta S.ant'An:na e San s.ebastiano di tili1:·;4 n;:i2ionalv è di ..aa spN'i.tlina:i:ione Deliberazione n°_ _ d~i-...1i--\------ del -----'2"'--""""-5_._l-l.LIJ.JJ.,G~2;. OH-14--4 -t - - ---- OGGETTO: Presa d'atto subentro ditta Speciality European Pharma ltaly srl nella -·--·- ------·-- ·-·-----..--------·---··--·--·---·- ---·-·--·- -·--·-·---·-·- ·-··----··----·--- - - - - -- Fornitura lotto 1O - delibera 361/2014. Il Direttore U.O.C. Provveditorato ed economato Premesso: Che con deliberazioni n. 361 del 08.06 .201 4 è stata aggiudicata la fornitura d i dispositivi per Urologia; )> Che in data 03.04 2014 la Ditta Johnson & Johnson Medicai spa, aggiudicataria del lotto 10 della suddetta fornitura con un prodotto denominato B ukit ha comunicato di aver cessato nel frattempo la distribuzione in Italia della linea Bulkamid cui il prodotto fa capo; )> Che la ditta Johnson ha anche comunicato che la Commercializzazione di detto prodotto è stata affidata in Italia alla Speciality E uropean Pharma Italy srl(SEP Italy); )> Che per quanto sopra ai si è proceduto a richiedere alla SEP Iltaly srl di trasmettere dichiarazioni inerente i requsiti generali e tecnico economici di gara; )> Che la ditta ha trasmesso la suddetta Comunicazione; )> Che nei confronti della stessa sono stati effettuati i controlli ai sensi dell ' art.48 del DLgs 163/06; )> Che le dichiarazioni inerenti i requisiti tecnico economici sono risultati veritieri come da documentazione agli atti di questa UOC; Ritenuto per quanto sopra : di prendere atto della Comunicazione di cessione di distribuzione della linea Bulkamid effettuata dalla ditta Ditta Johnson & Johnson Medicai spa; di autorizzare il subentro nell'affidamento del lotto 10 della procedura di gara di fornitura '··biennale di dispositivi per Urologia della Ditta Speciality E uropean Pharma Italy srl(SEP ItaJy) nuova distributrice in italia della linea Bulkamid; )> l ~I' Considerato, infine, che la presente proposta di deliberazione è formulata previa istruttoria e può essere pubblicata integralmente; PROPONE )> ~ 2 di prendere atto della Comunicaz ione di cessio ne di distribuzione della linea Bulkamid effettuata dalla ditta Ditta Johnson & Johnson Medicai spa; d i autori zzare il subentro nell'affidamento del lotto I O de lla procedura di gara di fornitura bienna le di d ispositivi per Urologia della Ditta .Spec iality European Pharma ltaly sr~ nuova distributrice in Italia della linea Bulkamid alla ditta Johnson & Johnson Medicai spa aggiudicataria di detto lotto con il prodotto Bukit appartenente a detta linea; ~ di trasmettere copia del presente atto all 'UOC Gestione Economica - finanziaria e della Progettualità Europea, I all 'UOC Farmacia ed al Collegio Sindacale come per legge. ~ di pubblicare integralrri.ente la presente deliberazione ; il direttore U.O.C. ........ -~..,,- torato ed economato nietta Costantini IL DIRETTORE GENERALE dott. Luigi Muto, tale nominato con D.G.R.C. n° 195 del 05/06/2014 e successivo D.P.G.R.C. n° 141 del 26/06/2014 ed ai sensi e per gli effetti del D. Lgs. n° 502 del 30/12/1992 e della L.R.C. n° 32 de 03/1111994 e loro successive modificazioni ed integrazioni; • letta la su estesa proposta del Direttore della u.o.c. Provveditorato ed Economato e ritenuto di voler procedere a quanto nella stessa motivatamente descritto; • considerate esaustive l'istruttoria e la estensione della proposta di cui trattasi e ritenuta, quest'ultima, inoltre, redatta conformemente alla normativa legislativa vigente in materia; • sentito il parere favorevole, espresso nel merito dal Direttore Sanitario DELIBERA approvarsi la narrativa e, per l'effetto: ~ ~ ~ ~ di prendere atto della Comunicazione di cess ione di distribuzione della linea Bulkamid effettuata dalla ditta Ditta Johnson & Johnson Medica} spa; di autorizzare il subentro nell'affidamento del lotto 10 della procedura di gara di fornitura biennale di dispositivi per Urologia della Ditta Speciality European .Pharma Italy srl(SEP Italy) nuova distributrice in Italia della linea Bulkamid alla ditta Johnson & Johnson Medicai spa aggiudicataria di detto lotto con il prodotto Bukit appartenente a detta linea; di trasmettere copia del presente atto all'UOC Gestione Economica - finanziaria e della Progettualìtà Europea, all'UOC Farmacia ed al Collegio Sindacale come per legge. di pubblicare integralmente la presente deliberazione ; 1useppe Mata - ~~ 3 Roundcube Webmail :: Fwd: Re: Bulkamid Oggetto Fwd: Re: Bulkamid Mittente Desti natario <[email protected] Provved iterato < provveditorato@ospedale. caserta. it > Data 03-04- 2014 11: 51 • • .• • • • • • • • Pagina I di 2 Comunicazione clienti cambio distributore Linea Bulkamid.pdf (143 KB) Lettera_clienti_Bulkamid.pdf (33 KB) 2012-03-12 product list .pdf (45 KB) 2013 GMDN CODES .pdf (421 KB) EC Annex II 697 612 .pdf (110 KB) DGM.pdf (110 KB) BUKIT + BUlO.pdf (414 KB) DESCRIZIONE DEL PRODOTTO I Bulkamid® Hyd rog el è un gel non riassorbilbile.docx (148 KB) BUOP IFU.pdf (299 KB) Dati identificativi SEPI.pdf (259 KB) -- --- ---Cara Carmela, vi invio l a email ricevuta per gli opportuni provvedimenti . Saluti Gabriella Caiola Ge n tile Dr.ssa Ca iol a , 01dSo. ' 1:· ~J.~ - ~ ~, .\ ~1~'!° ' ·) ~;, J ~ . ~~· ' Ho provato a mettermi in contatto con Lei in quanto ho saputo da un Product Specialist di J&J che Bulkamid è risult'ato vincente nella gara sui DM per uro - ginecologia . - -· Ovviamente essendo la gara effettuata da J&J sarà necessario effettuare "ùn subentro contrattuale da parte di Speciality European Pharma Italy come già avvenuto per altre strutture sanitarie nel 2013. (spero che J&J informi la Vs struttura ospedaliera come pure noi in tempi brevi) Le allego pertanto tutti gli allegati necessari sia alla Farmacia Ospedaliera, sia alla Vs . Amministrazione (di c ui non ho riferimenti) per mettere l 'Ospedale di Caserta nelle co ndi zioni di avere già la documentazione pronta. Nel l a fattispecie Le allego: - Subentro da parte di Speciality European Pharma Italy Ethicon nella distribuz i one di Bulkamid (Lettera firmata da J&J + lettera a i clienti inviata dal nostro legale rappresentate Dott . Stefano Ceccarelli) - Certifie.àti CE di Bulkami d e della rel ativa ottica dedic·a·t a alla procedura di bulking - Schede tecniche - Dati identificativi Aziendali Per ogni eventuale necessità sono a Sua disposizione ai miei r1ferimenti i calce. Grazie per l'attenzione e un buon pomeriggio. Ciro Cipriani Dr . Ciro Cipriani Sales Manager Speciality European Pharma Via Dante Alighieri, 3 03100 Frosinone Tel: +39-0775 83 50 46 Fax: +39-0775 83 46 43 Mob : +39- 334 36 75 793 ~ Thi s email has been scanned by th e Symantec Email Security . c l oud . service . htto://webmai l.osoedale.caserta. it/? task=mai l& ac.tinn= nrint& 11irl= ??'i 1?!& mhm(= () 1/04/?()1 4 \ I I \ \ Organismi a ccredilali da ACCREDIA - UHI EH JSO 9001 ~2008 CltJ)Of.l.WJY f # J:.,M'O CltUA '!N'MlXl!llfOfO MEDICAL lP.A. W 'ttM.l DI (;tf110M[ OUAUTA n :ir:rtftCA.10 Spett.le Alla e.a. Direzione Amministrativa Pratica di Mare, 29 Luglio 20 13 - OGGETIO: DISTRIBUZIONE LINEA BULKAMJD Gentile Cliente, La presente per informarla che dal 4 agosto 20 13 Johnson & Johnson Medicai SpA cesserà di distribuire in Italia la Linea Bulkamid, che sarà commercializzata dalla società Speciality Europ_ean Phanna.IWì'...~2J_(SEP Italy), nuovo distribu tore italiano della ditta produttrice, Contura AS. '~ · · , Per effetto di tale. ~essazione, a partire dalla suddetta data del.f:!. agosto 2013 Vi invitiamo ad indirizzare i Vostri ordini di acquisto per i seguenti prodotti alla Speciality Euro2ean Ph~lUily-s:r.1 (SEP Italy), della quale includiamo di seguito tutte le informazioni operative utili.per Ffìltili~o;;-t~tt(él;·à·gglomame-nto della Vs. Anagrafica. Codici Prodotto Descrizione BUKIT~ BUIO BUSC BUOP URETHRAL BULKING SYSTEM HYDROGEL I ML STERILlZATJON CONTAINER URETHRASCOPE(REUSABLE) Denominazione legale: Sede Legale: P. IVA e CF/CCIAA.: Banca: IBAN: Speciality European Pharma Italy S.r.l (SEP ltaly) Via Dante Alighieri,3 - 03100 Frosinone 09714071009 CREDEM - Filiale di Frosinone -Via Adige, 03100 Frosinone IT09M03032148000!0000002083 Recapiti telefoniéi : Servizio Clienti: Dr. Ciro Cipriani Telefono. +39-334 36 75 793 - Fax. 0775 834643. Cogliamo l'occasione per inviarle i nostri migliori saluti. Salvatore D'Ambrosia Business Unit Director Divisione Ethicon Surgical Care Gynecology Johnson & Johnson Medicai S.p.a. Sodo legoio: V .1 ·J«~ ~!:;•1.:!. .'.f~ ooc.10P'!J1.(;:i 01 tt;.\le • Por-,e:•<" f~h·_ , fct ·•·39 CO 0119,,1 Fi~ ...... 3~ OG s.n:s,~ xw Sodi opòraOvo: V·:-, .;e; Mif."e. 51'1 (;O:)t. 0 P:;i:1çà di Marn · P.-;me;1a (R/.'~ Trii ~~ 06 ~1~9·11 F~> .. ig03 {~1 ~:1-1?~0 • \1,z. C>iit>:è", ;.: X•l?é IN~·" Td .-3g O'? €·l'i'·l'l! F>:i•. +-39 zy;~.1~!?..30 !O'..:.".:· :.in)Co f?E.A J(J'/2UJA N• lst:r. reo. lmpr, A'ama I C.F. I P. I. 0.SQS:!.!f. '.(.\U3 N. Iscrizione Rogistro A.E.E. H(lS;j·irY.J.'<JOM-;;?~ N. Lscr02iono Registro Nazlon~lo Pilo 1 T001)~·:.>fi)ùi)ll(;?"TO Cnp. Soc. 4Z 6.l'<'ll:C'4.J(j_(JC "'" (cr, -r I ·· ~'IJ~ .,,speciality .., ---· -- .. _.... ___ --· - ..:- $pocioli:y Evr~eon Phorrno ho!y S d Ewropean Via Doni~ Afighiori. 3 - 03100 h o~inc>o e Vl\tt \V,s pcdo~1ycvrop conphof mo. corn Pharrna Frosinone, 02/08/2013 Oggetto: LINEA BULKAMID® dispositivo medico chirurgico Variazione del distributore in Italia Gent.ma Prof.ssa; Egr. Professore Gent.ma Dott.ssa; Egr. Dottore Spett.le Farmacia Interna Con la presente si comunica che a partire dal 4 Agosto 2013, Speciality European Pharma ltaly S.r.l. sarà il nuovo distributore in Italia di BULKAMID® (Sistema di «Bulking lntra Uretrale con Agente Volumizzante» per l'incontinenza urinaria da sforzo -IUS), subentrando all'attuale distributore Johnson & Johnson Medicai SpA. Informazioni relative al Sistema Bulkamid: : -~, Codice/:·Prodotto _ , BU10 , ·~:·. {~. :- .;· -l~~-~_f,~\- · ~t .,l~~~-{'~~' ·,,. : .- - .:S~-~:;:_~~-~::ì~:' ~~: ~~'~:ç~~~ _.;\·:~ .~ -{_ -.:,'. ~~i.'.~~l/. 1~~:~:~~}~~~ \,•'~-~:-.., -~:-~ ' Deni:i'rninazione '; .,;~f''"'Descriiiohe'··'» ''v ;.;:':. .'," Confezionamento.. ~'•· r''IVA;·';, 1 BUOP BULKAMID HYDROGEL BULKAMID BULKING SYSTEM BULKAMID URETHROSCOPE BUSC BULKAMID BUKIT GEL INIETIABILE PER IUS SISTEMA CON GEL·PER LA IUS BULKAMID URETROSCOPIO BULKAMID CONTEN. PER STERIL. CONFEZ. DA 1 PEZZO 4,00% CONFEZ. DA 1 PEZZO 4,00% CONFEZ. DA 1 PEZZO 21,00% CONFEZ. DA 1 PEZZO 21 ,00% Per i Vostri ordini e informazioni commerciali Vi invitiamo a contattarci ai seguenti numeri: Ordini: tel. 0775 835046 fax: 0775 834643 Direzione Commerciale e servizio clienti: Dr. Ciro Cipriani Cell.: 334 3675793 Email: ciro.cipriani@spepharma .com RingraziandoVi per la gentile attenzione cogliamo l'occasione per inviare i nostri più cordiali saluti. Benoit Cabanes Vice Presiden t South Europe Speciality European Pharma Speciality European Pharma ltaly S.r. l. - Via Dante Alighieri, 3 - 03100 Frosinone. ltaly Cap. Soc. 10.000,00 € i.v. -Codice Fiscal.e/Partita !VA/Reg. Imprese FR n. 0971407 1009 Te!. 0775 835046; Fax 0775 834643 ; e-mai! [email protected] \ DG.· Product List The following products are covered by DGM-697: Product Class Date for placing on the market (with CE Mark) Product family on DGM-697 covering the device Rectamid181 Anoscope Bulkamidw Rotatable Sheath Bulkamid'81 Hydrogel ls ls 2007-09-26 2007-06-25 Anoscooe Cystoscope llb 2010-06-29 Bulkamid llb 2010-02-09 1,6 - 3,4% Cross-linked Polyacrylamide; 96,6 - 98.4 % Water for lniection Aquam id llb 2010-06-29 Aquamidi!lJ 1 ml · ~ r:~ .. Aquam1d · ~ 'l{econstruction 1 ml .. " '~ "38\;t'() ".:r.•"w.· .... . ., 7d . \~. : --- - ·' 1,6 - 3,4% Cross-linked polyacrylam ide; 96,6 - 98,4 % Water for lniection I V r "The products on this list have been accepted by DGM" Date: 2012-03-12 Name and signature: Nina Christensen Title: Technical Assessor Kollegievej 6 DK-2920 Charlottenlund © OGM 2011-02-15 BL 1 1-023E v6.0 Denmark Phone: Fax: + 45 72 24 59 00 + 45 72 24 59 03 E-mail: [email protected] www.dgm-nb.org DS Certificering NS Notified Body No. 0543 Page 1 of 1 '\ I I \ Page I of 2 GMDN Home Page About GMDN My GMDN Search Terms ~embership l'Javlgator i\ll I s~i~ct Lang>.1'19"' I ;\"5 English FAQ Information Contact Us Basket Logout Request a Code MyTerms Records 1-4 from 4 ~~----·-·--·------------~-------------·-----------··----···-··-··--------···----- Term GMDN Source Code Code Definition l. Hypodennic needle, single-use, sterile 59230 A sterile, sharp bevel-edged, hollow tubular metal device intended to be used in conjunction with syringes, secondary medication sets, or phlebotomy equipment (e.g ., blood collection adapters or holders) to prepare and administer fluids/medications/drugs to a patient and/or to withdraw(aspirate) fluids from a patient. This ìs a single-use device. See also: Microneedle 2. Rigid urethroscope 35423 An endoscope with a rigid inserted portion intended for the visual examination and treatment of the urethra (the muscular tube that leaves the urinary bladder for the excretion of urine). It is inserted through the external urethral orifice during urethroscopy. Anatomica! images are transmitted to the user by the device through relayed lens optics or a fibreoptic bundle. This device is commonly used to examine the mucous membrane and to treat lesions of the urethra. This is a reusable device. 3. Surgical irrigation/aspiration system 41978 An assembly of devices used to intermittently or continuously irrigate and/or aspirate body cavities and wounds during a generai surgical procedure. It provides for the removal of loose tissue, fluids, and other debris to keep the surgical site clear, helping to optimize visualization and access. The assembly typically includes a malns electricity (AC-powered) pump, collection bottles, tubing, and connectors. It may be used together with an irrigation catheter. It is not intended to be used for the administration of parenteral fluids, infusion of drugs, or for any lìfe sustaining purposes . See also: Surqical irriqation/aspiration system pump; Surgical irriqation/aspiration tubing set 4. Urologica! surgical procedure kit, non- 46418 A collection of various sterile urologica! surgical instruments and the necessary materials used to perform a urologica! surgical procedure. It does not contain any pharmaceuticals. This is a single-use device. medicated, single·- ·-· ___use- .. Records 1-4 from 4 http: //www.grndnagenéy.com/AccountTenm.aspx 29-08-20 13 \ '· \ This is to certify that the quality system of: Contura lnternational A/S Sydmarken 23 2860 S0borg Denmark has been approved in conformity with the requirements of: Annex Il, section 3.2 - Full quality assurance system of Council Directive 93/42/EEC concerning medicai devices as transposed into Danish law excluding Annex Il, section 4. The certificate covers the following activities: Design, development and manufacture of implantable hydrogel products in class llb. Design, development and manufacture of guidance devices in class ls intended to be used with implantable hydrogel products The EC certificate is valid provided thai the quality system continues to conform to the above-mentioned scope and provlded thai the company does noi introduce substantial changes to the quality system without the approvai of Presafe Denmark AJS. This EC certificate is issued pursuant to the Presafe Denmarl< AJS' terms and conditions for the certification of medicai devices and entitles the manufacturer to affix the CE mark. The certificate is based on successful audit of the manufacturer. The manufacturer is subject to periodica! audits as per the Directive. Date of issue: 2013-09-26 Expires: 2016-10-24 Jnitial date of issue: 2010-02-09 Reference: aur2a 1108v170f612 Presafe Oenmark AJS Notified Body, ldentification No. 0543 Tuborg Parkvej 8, 2900 Hellerup, Denmark AONVt. NEMKO COMPANY CIOGM201l ·08· 1S Bl 11 0-008( vl'1 O DG ~4 Page 1 of2 .' I I \ - The following product families in class ls are covered by the certificate : Anoscope Cystoscope The following product families in class llb are covered by the certificate: Aquamid Aquamid Reconstruction Bulkamid Certificate number: OGM - 697 Date of issue: 2013-09-26 Certificate type: Expires: 2016-10-24 lnitial date of issue: 2010-02-09 Reference: aur2a 1108v170f612 EC Certificate AOllV & NEMKO COMPAH'f Page2of2 i:>OGMlOlHll· l S BL11.0.008Ev17.0 ·EC Certific.ate _ . ' This is to certify that the quality system of: Contura lnternational A/S Sydmarken 23 2860 S0borg Denmark has been approved in conform ity with the requirements of: Annex Il, section 3.2 - Full quality assurance system of Council Directive 93/42/EEC concerning medicai devices as tra nsposed into Danish law excluding Annex Il, section 4. The certificate covers the following activities: Design, development and manufacture of implantable hydrogel products in class llb. Design, development and manufacture of guidance devices in class ls intended to be used with implantable hydrogel products The EC certificate is va/id provided that the quality system continues to conform to the above-mentioned scope and provided thai the company does not introduce substantial changes to the quality system without the approvai of Presafe Denmark NS. This EC certificate is issued pursuant to the Presafe Denmar1< NS' terms and conditions for the certification of medicai devices and entitles the manufacturer to affix the CE mari<. The certificate is based on successful audi! of the m anufacturer. T he manufacturer is subject to periodica I audits as per the Directive . Date of issue : 2013-09-26 Expires: 2016-10-24 l nitial d ate of issu e: 2010-02-09 Reference: aur2a11 08v170f612 Presafe Denmark AJS Notified Body, ldentification No. 0543 Tuborg Parkvej 8, 2900 Hellerup, Denmark AONV & NEMKO COMPANY Cl OGM 20 l l ·DB- l !I Bl 111)008[vl10 Page 1 of2 \ / \ I I / I '' ~.__:..._ I \ \ I I / ,-....... '~ · :~ '* /,, <YJ~I / .. / I ·o ~ i"' . " /-il; / The following product families in class ls are covered by the certificate : Anoscope Cystoscope The following product families in class llb are cover.ed by the certificate: Certificate number: OGM - 697 Date of issue: 2013-09·26 Certificate type: Expires: 2016-10-24 EC Certificate lnitial date of issue: 2010-02-09 Reference: aur2a 11oav170f612 ADNV e.NEMKO COMPAHY Page 2 of 2 e OGM 2013-<l! -lS 8l 11.0.008fv17.0 \ \ I I I / I ì t ·I l ,! iI I I I / I I I I I - n :i: ii .J.:# . ·- Ì' . r; I I f I I I I \ \ \ @~;;:~:::.:.~..:'.:'~--":,==:-::':::;:..::i·.=~":~"~;:: ~~ ~::~~::.: ~;;.:t"';;;:;-;'.::;: ~;::."~::-:.".::;-:;.; , .... -"'....1"°'........ © ::.r..·:;:..:-:.~::t:'.-::.::.:=..-1~::.:il:::;.:-:;.·:::::~..; .......... -... ....... , ...., ... ~ .l ..Jir-•""' !:t;Y •::::.:~t:~w:.,-:_~,':!;.":,."":;;;:':.;:.J;,~~~~=:;-:;::.;::;;:; ................ \ \ I / \ \\ .,.'MJ.? " 1 Speciality Bulkamid® European Pharma DESCRIZIONE DEL PRODOTTO Bulkamid® Hydrogel è un gel non riassorbilbile, iniettabile, trasparente e idrofilo per la volumizzazione uretrale. Bulkamid® Hydrogel è costituito per circa il 2,5 3 da poliacrilammide reticolato e per il 97,5 3 da acqua apirogena. È biocompatibile e non biodegradabile. Bulkamid® Hydrogel è fornito in siringhe sterili preriempite da l ml, sigillale con un raccordo Luer lock. Deve essere iniettato con un ago sterile 23G x 12 cm. Ogni siringa è provvista di un'etichetta suddivisa in tre parti sulla quale compare il numero di lotto. Incollare una parte dell'etichetta sulla cartella della paziente al fine di garantire la tracciabilità del prodotto. Bulkamid® Hydrogel deve essere utilizzato con Bulkamid® Rotatable Sheath. FUNZIONAMENTO ulkamid® Hydrogel viene iniettato nel tessuto sottomucoso della porzione media prossimale ~ 'uretra. Bulkamid® Hydrogel è indicato per favorire la coaltazione uretrale. B~ amici® Hydrogel è usato come agente volumizzante uretrale per il trattamento dell'incontinenza urinaria femminile p revalentemente da sforzo. CONTROINDICAZIONI Non somministrare Bulkamid® Hydrogel a pazienti affette da cistiti e uretriti acute. Non somministrare Bulkamid® Hydrog el a pazienti affette da malattie autoimmuni o che stanno ricevendo trattamenti sistemici di corticosteroidi. Non somministrare a pazienti affette da herpes genitalis attivo. AVVERTENZE I PRECAUZION I Durante la procedura di volumizzazione, i vasi sanguigni devono sempre essere visibili nel sito di iniezione per prevenire il rischio di necrosi. Non somministrare Bulkamid® Hydrogel p er via endovascolare. Prima del trattamento, valut are le condizioni del tessuto (es. durezza, edema, ematoma, a trofia) nel sito di iniezione . Non somministrare se il tessuto è danneggiato. Non esistono dati sugli effetti di Bulkamid® Hydrogel durante la gravidanza, il parto e l'allattamento. Le pazienti alle quali viene somministrato un trattamento che interferisce con la coagulazione del sangue sono a rischio maggiore di ematoma o emorragia uretrale. Pazienti che hanno recentemente subito un intervento c hirurgico devono essere trattate con estrema prudenza. Pazienti affette da infezioni acute o croniche in altre parti del corpo devono essere trattate con estrema prud enza. Le pazienti affette da diabet e potranno ricevere un trattamento con Bulkamid® Hydrog el solamente se il loro diabete è ben co ntrollato. Non somministrare Bulkamid Hydrogel in altre parti d el corpo. L'intervento può provocare infe zioni d el tratto urinario e graffi all'uretra e alla vescica. È consigliabile somministrare antibiotici in profilassi. Bulkamid®O Hydrogel deve essere so mministrato esclusivam ente da personale medico qualificato, com e ginecologi, urologi o uroginecologi. Non mescolare Bulkamid Hydrogel con altre sostanze. \ \ \ I Bulkamid® Hydrogel viene forni to sterile. Utilizzare Bulkomid® Hydrogel e gli altri componenti di Bulkamid® Urethral Bulking Syste m solo se la confezione e i prodotti appaiono intatti e non da nneggia ti. No n risterilizzore Bulka mid® Hydrogel. Eliminare tutti i materi ali/ prodotti non usati secondo il protocollo o lo procedura in uso nella struttura sanitario. Tutti i componenti di Bulkomid® Urethral Bulking System sono monouso e sono destinati all'uso su uno sola paziente. Non riutilizzare. Non usare a lcun com ponen te di Bulko mid® Ure thral Bulking System d opo lo d oto di scadenzo indicata sull a confezione . Lo sicurezza e l'efficacia di Bul kamid® Hydrogel non sono state testa te in p azienti al di sotto dei 18 anni. EFFETTI INDESIDERATI Dop o l'intervento, è possibile che si presentino sintomi transi tori come disuria, ema turia, edema, infezioni del trott o urinario e ritenzione acuto nonché dolore durante la minzione. È improbabile che si presen tino e ffetti indes iderati a lungo termine qua li ritenzione no n ac uto, formazione di ascesso, fibrosi (indurimento del tessuto), migrazione e necrosi. INFORMAZIONI PER LE PAZI ENTI Le p a zienti devono essere informa le sull'uso previsto, risultali attesi, controindica zioni, precauzioni, avvertenze e potenziali effetti collaterali. MEboo DI SOMMINISTRAZIONE: FASE PRE-OPERATORIAO È necessario eseguire un esame delle urin e per escludere infezioni del trotto urinario (UTI). Non proce d ere in presenza di un 'infezione. La p aziente deve essere sistemata in p osizione litotomica . Disinfettare secondo lo procedura ordinario locale. Applicare un gel anestetico a ll 'interno dell'uretra, e/o iniettare 5 ml-10 ml di lidocaina allo 0,5 3-1 3 con adrenalina, o simili, do entrambi i lati della mucosa lungo l'uretra (in posizione ore 3 e ore 9) 5- l O minuti p rima dell 'intervento. FASE PERIOPERATORIA Utilizzare Bulkamid Rototoble Sheo th seguendo le apposite istruzioni per l'uso. Rimu overe il cappuccio p ro te ttivo dallo siringo di Bulkamid® Hydrogel. Inserire bene l' ago 23G nel raccordo Luer lock. Assicurarsi che l'ago sia inserito correttamente. Assemblare Bulkomid® Urethroscope (con teleca mera) e Bulka mid® Rotatoble Sheath inserendo Bulka mid® Urethroscope, con il collegamento dello fonte luminosa allineato ai condotti dell' acqua su Bu lko mid® o Rota loble Sheat h. Collegare Bulkomid Rotota ble Sheoth al set di infusione utilizzando il raccordo Luer lock sul tubo più corto per l'afflusso dell 'acqua. Posizionare il tubo più lungo del de flusso in un recipiente o in un tubo per il drenaggio delle acque di scolo. Introdurre il sistemo così assemblato nell 'ure tra e nello vescica e ovviare l'afflusso e deflusso dell' acqua per l'irrorazione e l'ispezione. Svuo ta re lo vescica separando l' ottica do Bulkamid® Rototable Sheoth o interrompendo l'afflusso e ovviando il deflusso. Introdurre l'ago fissato sullo siringo nei c anali operativi d i Bulkomid® Rototoble Sheoth. La punto dell'ago non deve a ncora apparire sullo schermo. Avviare l' a fflusso, interrompere il deflusso e posizionare lo p unta di Bulkomid® Rotata ble Sheoth sul collo della vescica. Ruotare lo parte mobile di Bulkomid® Rota table Sheoth o ore 6. Ri trarre il sistema di circo 2 cm dal collo della vescica. Spingere l'ago fino a renderne visibile lo p unta. Spingere il sistema p arallelamente a lla parete ure trale in modo tale c he la mucosa si trovi di fron te a llo punta dell'ago. Non inclinare il sistema. L'inclinazione del sistema potrebbe causare un'iniezione troppo profonda o troppo superficiale. Inserire l'ago nel tessuto sottomucoso fino a I \ I J\ \ quando la marca tura che indica 1 cm sull'ago non sia allin eata alla superficie della mucosa. Iniettore 0,3 ml-0, 6 ml di Bulkamid® Hydrogel assic urandosi che i vasi sanguigni restino sempre visibili per prevenire il rischio di necrosi. Durante l'iniezione fare affluire acqua per dilatare l'uretra, in mod o da avere una visibilità sufficiente durante l'iniezione. A secondo della forma e dello posizione del deposito in posizione ore 6, ripet ere la procedura o ore 2 e ore 1O oppure a ore 3 e ore 9, al fine di ottenere un riempimento uniforme lungo tutta la c irconferenza del sito. Limitare il numero di perforazioni per prevenire il rischio di fuoriusci ta di materiale. As sicurarsi di ritrarre l'ago prima che Bulkamicf'.Bl Rotatable Sheath venga ruotat o o rimosso. Se necessario, cambiare la siringa durante il trattamento e ripetere le iniezioni assicurandosi di non effettuare più di un'iniezione per sito, d al momento c he la quantità di Bulkomid® Hydrog el utiliua ta normalmente è di 1,5 m l-2,0 ml. Se necessario, aprire il deflusso tra un'iniezione e l'altra per prevenire sintomi di urgenza. Per fare ciò, interrompere l'afflusso e aprire il deflusso o separare l'ottico da Bulkomid® Rotatable Sheath. Infine, svuotare la vescica rimuovendo l'ottico da Bulkamid® Rototable Sheoth. FASE POST-OPERATORIA O Tenere sotto osservazione la paziente fino alla prima m1nz1one nella quale sia possibile misurare un residuo di urina < 100 ml, misurazione ottenuto svuotando il catetere o esaminando la vescica. In caso di cat e terizzazione intermittente, utilizzare un catetere C h 10-12. Se necessario. ripetere il trattamento .do~ 2-3 mesi. Speciality European Pharma Italy S.r.l Via Dante Alighieri, 3 03100 Frosinone Italia Tel: +39 0775 83.50.46 Fax: +39 0775 83.46.43 Mail: [email protected] Conta tti commerciali Dr. Ciro Cipria ni Sales Dir ector Email ciro.cipriani@spe pharma.com Mobil e te!: +39 334.36.75.793 I I I ,/ I / I I I I I \ \\ ENDOSCOPES USER MANUAI fi'J!.lf.lftf? :fiflfJ MANUEi D'UTll/SATIDN POUR LES ENDOSCOPES NAVOO K BETRIEBSANLEITUNG FUR ENDOSKOPE ENDOSKOOPIDE KASUTUSJUHEND MANUALE PER UTILIZZATORE PER Gll ENDOSCOPI ENDOSKOOPPIEN KAYTTOOPAS BllUGSANVISNING TIL ENDOSKOPER AZ ENDOSZKOPOK FELHASZNALOI KÉZIKONYVE pout1rl ENDOSKOPU ErXEIP/tllO XPH:CH:C ENtlO:CKOntQN UIJ./?J Al@ e!U/1'1 AIANUAL DEL USUARIO DE LOS ENDOSCOPIOS ENDOSKOPfl NAUDOJIMO VADOVAS GEBRUIKERSHANDLEIDING ENDOSCOPEN ENDOSKOPU L/ETOTAJA ROKASGRAMATA BRUKERHANDBOK FOR ENDOSKOPER PR/RUèKA POUt/VATEl:A ENDOSKOPOV ENDOSKOPY - PODRfiCZNIK UtYTKOWNIKA END OSKOP KULLA NIM KltAVUZU MANUAI DO UTlllIJIDOR DE ENDOSCOP/OS wmttneftf:fifl/J BRUKSANVISNING FOR ENOOSKOP UHCTPYKijUR no 3 KcnnYATAijUU 3HAOCKOnA '~~p~ ~.M EG_...P ~· '"''''''''""""-.,"<'*'"'*W,,,.....,~, ·.-.. -~ a '~ ; . ;·' ...~. ·-~··· -- ~- ~ :"'('~ . . .. • ~~ • !-~ - "-4. "1'" \ \ \ \\ \\ \ J ' I ì I Ia i I \ I \ I I I ENDOSCOPES USER M.ANUAL ,- MANUEL O'UTILISATION POUR LES ENOOSCOf>ES 12 BETRIEBSANlEITUNG FUR ENDOSKOPE 20 MANUALE PER UTILIZZATORE PER Gli ENDOSCOPI 28 BRUGSANVISNING Tlt ENDOSKOPER 36 HXEIPl410 XPHIHI EN40IKOOUlN 44 MANUAL DEL USUARIO DE LOS ENDOSCOPIOS 52 GEBRUIKERSHANOLEIOING ENOOSCOPEN 60 BRUICERHANDBOK FOR ENDOSKOPER 68 ENDOSKOPV - PODR~QNIK UZVTKOWNIKA 76 MANUAL DO UTILIZADOR DE ENDOSCÒPIOS 84 BRUKSANVISNING FOR ENOOSKOP 92 11HCTPYKLU1SI no 3ncnJ1YATAl.UH13HAOCKOflA 100 ~ lit ifHH F 108 =f. flH NAVOD K POUZITf ENDOSKOP0 116 ENOOSKOOPIOE KASUTUSJUHENO 124 ENDOSl<OOPPIEN l<AYTTOOPAS 132 AZ ENDOSZKÒPOK FELHASZNALOI KÉZIKONYVE 140 UlAI~ N~ ,- . \.~~~ -~ -w ·-....,.., 4 e.!- LH M 148 ENDOSKOPV NAUDOJIMO VADOVAS 156 ENDOSKOPU LIETOTÀJA ROKASGRAMATA 164 PRiRUèKA POUilVATHA ENDOSKOPOV 172 ENDOSKOP KULLANIM l(ILAVUZU 180 ~~ii{! ffl =f. fffi 188 \ \ \ / I I / ·-~1 -~ 4 ~ I \\ / \ \ \\ \ \ INDICE DESCRIZIONE DEL PRODOTIO INFORMAZIONI GENERALI 28 DESCRIZIONE DEL PRODOTTO 29 L'uso con prodotti d'altri fabbricoti IN DICAZIONI D ' AVVERTENZ A 30 IST RUZIONI D ' USO GENERALI 31 Controlli e avvertenze Combinazioni Gli endoscopi SOPRO-COMEG sono strumenti ottici fabbricati con sistemi d i lenti ottiche d 'alto qual ità. Si usa l'endoscopio per la visualità delle incavature degli organi e le cavità del corpo, per la diagnosi e/o in collegamento con accessori endoscopici per la terapia in diverse discipline medicinali come lo chirurgia, la ginecologia, l'urologia, l'ortopedia, ORL e per la bocca, la mascella ed il viso. Ogni endoscopio SOPRO-COMEG é stato sviluppato per una fun zione specifica e deve essere usato solo per questa fun zione. Nei diversi cataloghi si trovano con l'aiuto del codice dell'articolo i campi di funzione delle ottiche SOPRO-COMEG e le specificazion i corrispondenti. PULIZIA E DISINFEZIONE . 32 Tecnica ad ultrasuoni Qualità dell'acqua Mezzi per lo pulizia e lo disinfezione Pulizia manuale Pulizia meccanico Tutti gli endoscopi SOPRO-COMEG sono fabbricati secondo la norma DIN EN 4600 l e la normo d i prodotti medici e provvisti del marchio CE. STERILIZZAZIONE . . . . . . . . . . . 34 Sterilizzazione o gas Sterilizzazione o vapore INFORMAZIONI DI SICUREZZA .. ... ... . . . . . . . 35 Secondo i campi di funzione e l'uso gli endoscopi SOPRO-COMEG hanno la caratteristica seguente: Marchio Uso CE Prodotti inva sivi per uso temporaneo CE 0123 Prodotti invasivi e chirurgici-invasivi Metodo di pulizia, disinfezione e sterilizzazione Temperature Informazioni di sicurezza Deposito Servizio ~,·-··--- · " r-... ... ~tf-fi•1·~~ ! -- ....•: --·· '·-... - - - ,.. 1. ---~~\.~~~~,_,;..:;,- .... ...- ~ per us.o a breve termine L' USO CO N PRODOTTI D ' ALTRI FA BBRICATI Gli endoscopi SOPRO-COMEG possono essere usati solo con accessori previsti per questo modo d 'uso e che corrispondono ai doti tecnici importanti. Gli endoscopi SOPRO-COMEG sono attrezzati con padiglioni oculari di normo . Perciò si possono INFORMAZIONI GENERALI raccordare tutli gli obiettivi lV o i sistemi di camere che corrispondono a questo norma . il padiglione oculare é di materio p lastica non conducente che isolo l'endoscopio sufficientemen te contro il sistema Podtgliona ocular e ' -..... Pone pt1nc1pola fobo ' •r_ di camera. i~l~~~ . .... ~ ~' Ob1enivo c:on l1ncs110 di,.tole in z.off110 Altuco P"' 1 coY• di _....,,, ----' k'o1.mlmone 'vcc tACMI) ~ Rocc01do ~' i covi di lromiin~ k.tce, 1.v1tobil1 (WO\.Ft RO«.OJdo J>41f ì COVI D _-r · ' d1 h'own•n·o~ lvce, )v11ob•li -""' ISTORI. Olymp.i) -~ Anello con codice 0 colore Pef indicare io d1re:u1one di vuto verde - o· . blu = 12•. 15• • JO" arancione gioito -•s· .. 10· • 90° ~ 29 I I / / I I I I I ' I \ I ' I \ ~ ;:; e: iiì N N o I II I I I I \ • INDICAZIONI D'AVVERTENZA fil ISTRUZIONI D'USO GENERALI L'istruzione d 'uso e le specificazioni 'degli occessori de i prodotti do usare in combinazione L'endoscopio deve essere usato solo per la suo indicazione e da personale qual ificato . devono euere osserva te il più preciso possibile. Queste istruzioni devono essere osservate per ottenere uno durato di vita lunga. Queste istruzioni però non possono essere viste come istruzioni per esegui re visite endoscopiche o interventi o per a llenamenti d 'uso. & Sindrome di Cre utzfeldt-Jacob e TSE/ BSE Per evitare danni si devono assolutamente osservare le istruzioni generali seguenti dura nte la manutenzione, il depos ito e il trasporto. Se si sospetta o si diagnostica la Sindrome di Creutzfeldt-Jacob si devono prendere immediatamente provvedimenti che impediscano il contagio d'altri pazienti, applicatori o terzi. In questo coso entrano in vigore le leggi e le prescrizioni dei paesi specifici. Queste istruzioni volgono sia per gli endoscopi nuovi che per quelli già utilizzati: - G li endoscopi, come ogni strumento ottico, sono molto fragili e devono essere quind i & Gli endoscopi SOPRO-COMEG in nessun coso devono essere esposti ai raggi GAMMA. Lo qualità ottica ne potrebbe essere influenza ta negativamente. & L'endoscopio non s'invio sterilizzato e deve essere pulito, disinfettato e sterilizzato primo e dopo ogni uso. & La sicurezza tecnica senza pericoli in combinazione con altri prodotti medici é solo doto maneggiati con cura. - Mantenere sempre /'endoscopio o/l'oculare o alla porte principale. - Non curvare o piegare /'endoscopia. - Evitare contatti dell'obiettivo con altri strumenti o superfici. - Depositare e imballare gli endoscopi singolarmente. - Dopo ogni util izzo, disinfettare e sterilizzare /'endoscopio. I -- . se è espressivamente legittimato nelle rispettive indicazioni d' uso CONTROLLI E AVVERTENZE - se il modo d'uso e la specific azione tecnico, /'ammette. L'endoscopio deve essere controllato subi to dopo il ricevi mento, prima e dopo l'uso e dopo il processo di pulizia, disinfezione e sterilizzazione per verificare eventuali presenze di danni, g raffi e diletti sulle & fil & & & superfici meccaniche e ottiche dell'endoscopio. L'endoscopio deve essere sempre mantenuto a ll'oculare o alla parte principale. Sul/' intero endoscopio non devono esserci danni come per esempio superfici ruvide, spigoli vivi o parti sporgenti che potrebbero causare severi dann i al paziente, all'operolore o a terzi. Per garantire una durata di vita lunga del prodotto si devono evitare i contatti tra le superfici di vetro (distali e prossimali) ed altri strumenti. Si devono esegui re successive verifiche della qualità dell'immag ine (nitido e p riva d i d istorsioni) e dello trasmissione dello luce tramite le fibre ottiche. Per eseguire ciò si deve puntare il collegamento del covo a fib re ottiche verso una luce non abbagliante (non una sorgente di luce fredda) . L'endoscopio non deve essere curvato o piegato. Il sistema preciso delle lenti ottiche si può dannegg iare . Se le fibre di vetro presento no macchie nere sull'estremità distale (fibre d i vetro rotte), è possib ile c he lo luce fornito sia insufficiente. Nel caso che dovrebbe sorgere uno delle irregolarità menzionate in alto, /' endoscopio non deve Se si vedono dei danni in ogni caso /'endoscopio non può p iù essere usato. essere p iù usato e deve essere mondato indietro per riparazione a l fabbricante o a d un'officina di riparazione autorizzato. L'endoscopio non si deve sterilizzare insieme al tubo di sicurezza di trasporto. Prima del montaggio, le superfici dei rubinetti devono essere finemente spa lmate con g rosso d i silicone sicuro per l'uso medicinale. (çQ Osservare queste istruzioni d'uso primo d'usare /' endoscopio. COMBINAZ IONI Per usare diversi prodotti in combinazione devono corrispondere la funzione e i dati rilevanti tecnic i I~ .J/-;:-::--«·-· . (lunghezza, diametro, collegamenti, etc.). Il p rodotto può essere solo usato con le combinazioni e gli accessori e/o pezzi di ricambio rappresentati nei nostri ca taloghi. Altre combinazioni, accessori e pezzi di ricdmbio possono solo essere usoti, se questi sono stabiliti specificamente per l'uso previsto e non influenzano lo capacitò I e /' esigenza di-sicurezza . 30 '""~07 -~<t~ -· - ----'l ,.11 - \ \ I / \ \ \ \ I PULIZIA E DISINFEZION E Tecnica ad ultrasuoni Pulizia meccanica Si raccomando d i scegliere con curo i mezzi chimici e i programmi di lavagg io per lo pulizia . Utilizzare solo macchine per la pulizia, soluzioni chimiche e programmi che sono stati raccomanda ti specificamente dal fabbricante. Non pulire gli endoscop i SOPRO-COMEG con lo tecnico od ultrosuoni. Qualità dell'acqua L'ocquo do usare per lo pulizia d ell'endoscopio e lo produzione del detergente deve avere almeno Devono essere usati processi termici neutri, che lavorano con un pH neutro (p .e. soluzioni per pulizia enzimatiche). lo quolitò dell'acqua del rubinetto potabile. Attenzione, persino l'acqua potabile, secondo lo provenienro ,B!!Q_çontenere sostanze che possono guastare l'endoscopio. Si raccomando quindi l'uso d'acqua demineralizzato. Lo temperatura non deve superare i 95 °C. Mezzi per la pulizia e la disinfezione I dispositivi nello macchino devono permettere uno postazione sicuro degli endoscopi e devono evita re danni durante il programmo di lavaggio. Noi raccomandiamo solo l'uso d i detergenti e mezzi di disinfezione raccomandati dal fabbricante degli endoscopi. Per lo preparazione e l'uso di soluzioni detergenti si devono seguire le istruzioni del Gli endoscopi con canali d ' irrigazione devono essere collegati tra i canali e i raccordi d i lavaggio dello macchino. Tutte le superfici devono essere bagnate completamente. produttore riguardo olla proporzione e allo durato. Il tempo massimo d'immersione degli endoscopi in soluzione é di 30 min. N on superare ta le periodo. Un tempo d'immersione più lungo può causare Non lasciate più o lungo del necessario gli endoscopi nello macchino per evitare danni tra mite residui. danni agli endoscopi . Pulizia manuale Attenzione : 1. L'endoscopio deve essere pulito subito dopo l'uso, togliendo accuratamente tutti i residui Se dopo il processo di lavaggio dovessero trovarsi residui sulla superficie delle fib re o ttiche p otrebbe dall'endoscopio. esserci il pericolo utilizzando uno fonte di luce freddo che questi residui brucino lo superficie e q uind i 2. Nel coso che ciò non é passibile, si deve immergere l'endoscopio in uno combinazione di influenzino le libre e lo trasmissione dello luce. soluzione detergente e di disinfezione . 3. Si devono smontare tutte le porti mobili come i collegamenti del covo o fib re ottiche, rubi netti o guarnizioni. 4 . Quando s'immerge l'endoscopio nello soluzione detergente, bisogno assicurarsi muovendolo e inch inandolo che evadi l'aria dall'interno dell'endoscopio. Solo così può essere garantito uno completo disinfezione di tutte le superfici. 5. Bisogna rimuovere le incrostazioni attentamente con spazzole di plastico e panni privi di filuzzi. Non usare mai oggetti duri che possono graffiare l'endoscopio e le superfici di vetro. 6. Pulire le aperture distali e prossimali, nonché il supporto luce con un batuffolo di cotone (solo applicatori in legno) inumidito di alcool isopropilico (70 %) o acetone oppure con un panno morbido. L' acetone deve essere utilizzato conformemente olle normative locali . In alternativa è possibile utilizzare un detergente neutro. 7. Per non danneggiare le parti ottiche bisogna evitare qualsiasi contatto d iretto con altri endoscopi o strumenti. 8. Infine, bisogno sciacquare l'endoscopio con acqua demineralizzato e asciugarlo con un panno morbido o aria compresso. Fare molto attenzione ai canali in funzione o di flusso. \ 32 ~-='j>~Ò."7" ~ / I / I I I I I / / I I i ' I I \ Il INFORMAZIONI DI SICUREZZA STERILIZZAZIONE A Importante : L'endoscopio deve esse re pulito attenta mente prima della sterilizzazione (vedi cop . 6) . È importante che il mezzo di sterilizzazione, per esempio gas o vapore, entri in contatto con tutte le su perfici d all'endoscopio. 11 mezzo di sterilizzazione deve poter entrare nelle ca vità do tutte e due le parti. I rubinetti devono essere smonta ti. G li endoscopi d evono essere sterilizzati in imballaggi adatti al procedimento come per esempio in sacchetti di corto e nel cestello di sterilizzazione . l'endoscopio deve essere imballa to in tal modo da far evitare il confatto con parti di metallo che potrebbero far aumentare la temperatura locale dell'endoscopio e causare danni allo strumento. Gli endoscop i devono essere posti con cura durante la sterilizzazione e devono essere protetti contro carich i meccanici. STER ILI ZZAZ IONE A G A S Metodo Steris™, Sterrad, sterilizzazione a vapore [vedi sopra), ETO, CIDEX, Henkel-Ecolab Sekumatic FRE. Tempe ratu re Gli endoscopi e le fonti di luce collegate, non devono essere in servizio continuo più che q uattro ore, a ltrimenti sì potrebbe provocare un a umento della temperatura dell'endoscopio in confallo con il paziente. Informazioni di s icure z za Gli e ndoscopi devono essere ste rilizzati secondo il metodo di sterilizzazione in a ccordo con i metodi specifici dell'ospedale . Ciascuno strumento deve essere imballato in modo appropriato per lo sterilizzazione. Il grado dell'isolamento elettrico é stabilito dal fa bbricante dei prodotti che si usano in combinazione con gli endoscopi e gli a ccessori SOPRO-COMEG. ::l I ' \ Of'Et\ li metodo di steri lizzazione seguente è approvato: (Generolmente b isog no osserva re le indicazion i i f • r-.~-: i T! •· ~·" . De posito del fabbricante dei mezzi di sterilizzazione o gas usa ti! ) Gli endoscopi SOPRO-COMEG dovrebbero essere depositati nell'imballaggio P rocesso di sterilizzazione ad ossid o d 'etilene, DMB-Sterivit-Automatic Gas: Pressione: Temperatura: Tempo di sterilizzazione: Imballo: Metodo d i pulizia, disinfezione e s terilizzazione G li endoscopi SO PRO-COMEG sono compatibili con i metodi seguenti: originale o in un cestello d i sterilizzazione. In og ni caso devo no essere deposita ti in 6 % ossido d 'etilen e, 94 % C02 1, 7 h Pa 55 ·e 120 min Standard, s acchetti di ste rilizzazione in cart a lamin ato I un posto sicuro. Per gli endosco pi con un diametro piccolo 13,0 mm e meno) si raccomanda di usare i tubi di protezione disponibili olio SOPRO-COMEG per evitare danni sulle superfici o ttiche e per evitare che il tubo dell'endoscopio si curvi. Dopo lo sterilizzazione l'endoscopio deve rimanere o temperatura ambiente (ca. 20 °C) per min . 24 ore. Un aumento della temperatura (max. 60 ·q accorcio il tempo d'aerazione. Se rvizio Solo le officine di riparazione autorizzate espressivamente do SOPRO-COMEG sono STERILIZ ZAZION E A VAPOR E in g rado d i eseguire uno riparazione con porti di ricambio o riginali e mantenere lo Gli endoscopi devono essere sterilizzati in accordo con i metodi di sterilizzazione o vapore dell'ospedale. Ciascuno strumento deve essere imballato in modo appropriato per la steriliza zzione. standard di qualità della SOPRO-COMEG. Sole queste riparazioni garantiscono lo A sicurezza d 'uso degli endoscopi. Atte nzio n e : Solo gli endoscopi marcati "Autoclav" possono essere sterilizzati a vapore. I metodo di sterilizzazione a vapore seguente è approvato: (Generalmente bisogno osservare le indicazioni del fabbricante dei mezzi di sterilizzazione a vapore usati!) l -- Parametro: Tempo di sterilizzazione: Imballo: 134 l a gar an:z:ia e la re spons abilità p e r la sicure :z::z:a d e i prodotti SOPRO-COMEG sca d e quando si e segue una r ipar a :z:ione in un' o fficina di riparazione non autori:z:zat a. Meto do vacuo fra zionato ·e Pulire e sterili:i::z:are gli e ndos copi e strume nti SOP RO-COMEG prima di r estitu irli. 5- 20 min Ceste llo di steriliz:z:azione in m e tallo, imballo proprio in sa cche tti di ste r ili:z::z:a:z:ione in car ta laminato Dopo la sterilizzazione e prima d'aprire l'imballaggio bisog na lasciare raffreddore gli e ndoscopi temperatura ambiente. Non é pe rmesso d'accelerare il tempo d'aerazione, siccome può provoca. danni e accorciare la durata dello vita dell'endoscopio. 34 ,,,,,,,,'!;? .,. - -- ~~· %1fzi'= ___ :~- .~ - -·' ___:znr! ~ \ \ \ \ \ \ \\ \ \\ \ '\ \ I \ \ ,/ z o-; m \ \ \ \ \ \ \ \ \ / I \ \\ \ \ \ ~ I " Ill. g_ ~ ~ ~ . ~ 11 I• i 11 .!: i J ~ I - o - i • ~ I ~ I f "~ ~ ~ " i CE Scope Se rvice <:enter USA Endoscopy lnc. 7808 Cherry Creek Drive Soulh, Unii 21 3 Denver, Colorado 80231 ~e~\1-720-213-0123 Fox+l -720-213.0124 [email protected] www.s9pro-comeg.com D Q§so _ PR_O COMEG _ ,\ .. . . ''.; "' I•, . ·~~:~· SOPRO-COMEG GmbH Dornierslr. 55 D - 78532 Tuttlingen Germony Tel. +49(0)-7461-9344-0 ~ Fox +49(0)-7461-9344-20 _,r~ [email protected] / ~- /~· ~.sop'.o-co~,eg . c?m ' [ - . . . ._ \ I \ \ \\ \ \ \ \ \ \ I ( \ \ I \ \ \ \ \ \ \ \ \ \ \ D.' I TI /f) L\'TI F / C I /'! J '/ f) r:fJ 'f.\/l ' RCS.·1 AL LEGATO E OGG ETTO Denominazione e ragione sociale : Spec1ality European Pharma ltaly S r I Codice fiscale 09714071009 Partita I V.A. 097 14071009 Codice attività : 51461 Sede legale : Via Dante Alighieri 3 C.A.P . 03100 Loca lita Frosinone Prov FR N. telefono 0775/835046 N. fax 0775/834643 Sede amministrativa I co mm erciale : Via Dante Alighieri 3 C.A.P. 03100 Local ita Frosinone Prov. FR N. telefono 0775/835046 N fax 0775/834643 Coordinate bancarie : Istituto d'appoggio CREDEM - CREDITO EMILIANO S p.A. c/c dedicato n. 1000 0002 083 CODICE IBAN IT09M030 3214 8000 1000 0002 083 minativo ST EFANO CECCARELLI BE N OIT CABAN ES C.F CCCSFN61008D81 OS C.F . CBNBNT 58A12Z110R C.F Nominativo C.F. Nominativo del rappresentante di zona : Ciro Cipriani Recapito telefonico: 334/3675793 Fax Luogo di trasmissione ordini: Via Dante Alighieri 3 C.AP. 03 100 Località Frosinone Prov FR N. telefono 0775/835046 N. fax 0775/834643 Sinciality EoropesnPbannaltaly S.r.l. Dr. Stefano Ceccarelli ,. (lì Procuratore71c1a/e i\ ~~t'oL~ pe 1 ia :J,it,.'I ;urnl,;t-O e i1t!na) \ \ \ / / \ \ '\ I I I I I \ \\ \ \ ìI \ I
Scaricare