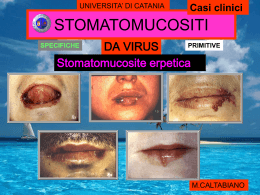
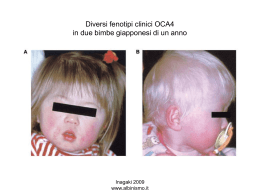
Servizi farmaceutici per studi clinici Gli studi clinici sono nell’ambito dello sviluppo dei prodotti farmaceutici un passaggio complesso e di rilevanza strategica dove la priorità assoluta è quella di garantire la sicurezza e l’efficacia di una nuova entità molecolare. Uno degli aspetti più critici è la gestione della logistica dei trial clinici, soprattutto per gli studi che coinvolgono sia l’industria farmaceutica che i centri di ricerca. Eurofins BioPharma Product Testing grazie alla sua pluriennale esperienza, offre soluzioni specifiche nella gestione degli aspetti logistici degli studi clinici. Siamo in grado di supportare i nostri clienti grazie alla versatilità dei nostri molteplici servizi in ogni specifica fase: ricerca & sviluppo, commercializzazione e studi clinici dalla fase I alla fase IV. Gli studi vengono eseguiti da un team di esperti altamente qualificati con una profonda e consolidata conoscenza dei mondi GDP e GMP. Il livello di qualità garantito e la strutturazione di ogni progetto secondo le specifiche esigenze del cliente sono la garanzia di un servizio altamente specializzato e affidabile. Storage Le nostre strutture sono dotate di moderne e sofisticate camere climatiche in condizioni controllate (+20°C, +5°C, - 20°C e -80°C). Il controllo delle condizioni di stoccaggio comprende la registrazione in continuo della temperatura. Il software è convalidato in accordo al 21 CFR Part 11 e gli impianti vengono qualificati annualmente. Distribuzione Manufacturing I nostri laboratori sono qualificati come centri specializzati per i servizi di logistica clinica e sono in possesso delle autorizzazioni necessarie per l'importazione di medicinali ad uso clinico, per il rilascio lotti e per i servizi di confezionamento secondario e di etichettatura. Il nostro punto di forza consiste nella garanzia di tempi rapidi di consegna entro 24/72 ore in Europa grazie all’utilizzo di vettori specializzati. Garantiamo un sistema di trasporto validato e siamo in grado di gestire anche la fase di richiamo lotti dai siti di sperimentazione e l’eventuale distruzione e smaltimento dei farmaci sperimentali.
Scaricare