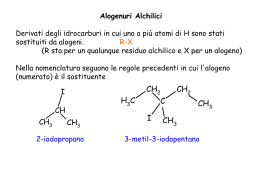
Esercitazione n. 14 - Reazioni e meccanismi dei composti aromatici. 3. Scrivere il meccanismo della clorurazione del benzene, mettendo in evidenza il ruolo del catalizzatore. Cl Cl2 + FeCl3 + FeCl4 + H + Cl + Cl + H Cl Cl + + FeCl4 - + HCl + FeCl3 4. Il p-dimetilbenzene si nitra molto più facilmente del benzene. Spiegare. H H3 C CH3 NO2 + H3 C CH3 + tutte le posizioni sono identiche; l'addotto σ è stabilizzato dalla presenza del metile in orto NO2 H 5. Scrivere il meccanismo della bromurazione aromatica di: Dimostrare l'orientamento, servendosi degli addotti σ. a) anilina (= benzenammina) + Br + FeBr4 Br2 + FeBr3 NH2 NH2 H + + Br + H Br + Br NH2 H Br +NH2 NH2 Br H Br NH2 H Br + + NH2 NH2 + Br + H FeBr4 Br FeBr3 HBr + + + H NH2 NH2 H Br NH2 H Br H Br NH2 + NH2 + + NH2 NH2 H Br NH2 NH2 FeBr4 H Br + H Br H Br FeBr3 HBr Br 1 b) etossibenzene OCH2CH3 H OCH2CH3 + Br Br + + FeBr4 + OCH2CH3 OCH2CH3 H + Br OCH2CH3 OCH2CH3 H H Br Br + + H Br FeBr3 HBr OCH2CH3 Br + + + H Br H Br OCH2CH3 OCH2CH3 OCH2CH3 OCH2CH3 H Br +OCH2CH3 H Br + OCH2CH3 OCH2CH3 OCH2CH3 + + + H Br + H Br H Br OCH2CH3 OCH2CH3 H Br FeBr4 H Br FeBr3 HBr Br 6. Completare le seguenti reazioni del benzene. Scrivere in ogni caso il meccanismo. a) bromuro di terz-butile + AlCl3 CH3 + Cl C CH 3 CH3 AlCl3 C CH3 CH3 CH3 + HCl meccanismo: CH3 CH3 C Cl + AlCl 3 CH3 CH3 CH3 C + + AlCl4CH3 CH3 CH3 CH3 C + CH3 H CH3 C CH3 + CH3 AlCl4- C CH3 CH3 AlCl3 + HCl 2 b) 1-clorobutano + AlCl3 + Cl CH2 CH2 CH2 CH3 CH3 CH CH2CH3 CH2 CH2 CH2 CH3 + AlCl3 meccanismo: + ......... AlCl4CH3 CH2 CH2 CH2 AlCl3 + Cl CH2 CH2 CH2 CH3 trasposizione + CH3 CH2 CH ......... AlCl4 CH3 + + CH3 CH2 CH2 CH2 + H CH2 CH2 CH2 CH3 AlCl4 CH2 CH2 CH2 CH3 AlCl3 + HCl + + CH3 CH2 CH CH3 CH3 CH CH2CH3 AlCl4- H CH CH2 CH2 + CH 3 AlCl3 + HCl c) bromo + un chiodo (...non di acciaio!) Br2 + Fe + Br 2 meccanismo: FeBr3 Br + HBr + Br + FeBr4 Br2 + FeBr3 H Br + Br+ FeBr3 FeBr4- + Br FeBr3 + HBr d) acido solforico fumante H H2SO4 + SO3 e) iodio + HNO3 + O- S O O OH S O O Reazione non in programma quest’anno 3 f) cloruro di benzoile + AlCl3 O O C + AlCl3 Cl C + HCl meccanismo: O C O Cl C+ + AlCl3 + AlCl4- O O O H C+ + + AlCl4- C C AlCl3 + HCl g) acido nitrico + acido solforico + HNO 3 meccanismo: NO2 H2SO4 + H2O + H O NO2 HNO3 + H2SO4 - + HSO4 H + H O NO2 H2O + +NO 2 H catione NITRONIO H3O+ + HSO4= H2O + H2SO4 NO2+ + H3O+ + 2 HSO4= HNO3 + 2 H2SO4 H O + + N O + NO2 NO2 H+ 4 h) 1-cloro-2,2-dimetilpropano + AlCl3 CH3 CH3 C CH2 CH3 AlCl3 + Cl CH2 C CH3 CH3 CH3 CH3 CH2 C CH3 + CH3 + HCl meccanismo: CH3 -AlCl Cl CH2 C CH3+ AlCl3 4 CH3 + + CH2 C CH3 + CH3 CH2 C CH3 CH3 CH3 CH3 H CH 3 C CH2 CH3 + CH3 + + CH3 CH2 C CH3 CH3 H CH 3 C CH2 CH3 + CH3 -AlCl CH3 C CH2 CH3 4 CH3 + HCl AlCl3 7. Completare le seguenti reazioni dell'isopropilbenzene: a) Br2 alla luce; b) Br2 + FeBr3; c) SO3 in acido solforico; d) cloruro di acetile + AlCl3; e) cloruro di propile + AlCl3. H3C CH3 H3C CH3 CH CH Br SO3, H2SO4 Br2, hν H3C C CH3 + orto Br2, FeBr3 H3C CH CH3 H3C CH + Br H3C CH3COCl, H3C AlCl3 CH3 SO3H CH CH3 AlCl3 Cl CH2 CH2 CH3 Br + orto COCH3 CH CH3 H3C + CH CH3 H3C CH2 CH2 CH3 + CH CH3 H3C CH3 CH + CH3 CH CH3 CH2 CH2 CH3 CH CH3 CH3 5 10. Scrivere le reazioni di bromurazione, solfonazione e nitrazione dei seguenti composti, scrivendo in ciascun caso il prodotto (o i prodotti) di reazione ed indicando se la reazione avviene più velocemente o più lentamente della corrispondente reazione del benzene: -FeBr Bromurazione: Br2 + FeBr3 SO3 E+ Nitrazione: HO NO2 + H SO 2 4 Solfonazione: H+ O NO2 H a) metossibenzene O CH3 O + + Br+ Br+ 4 + CH3 H + O CH3 H Br Br O E+ CH3 H O E+ CH3 H CH3 O Br + Br Br + +NO 2 OH2 + stabile CH3 O + O + H Br CH3 O O CH3 O H + Br CH3 + CH3 O + O CH3 + SO 3 + O CH3 H O SO3 SO3 + H Br H Br stabile CH3 H O O CH3 + H Br Br H Br CH3 O + H CH3 Br CH3 H O O CH3 SO3H + SO3 SO3 + CH3 H stabile CH3 O + H SO3 CH3 O O + O CH3 O H SO-3 + CH3 +O CH3 + H 3 H SO-3 O CH3 O CH3 + + SO - CH3 H SO3 H SO3 stabile H SO3 SO3H Orientamento: orto + para 6 O CH3 + CH3 H O + NO2+ + O CH3 H O NO2 NO2 CH3 H O CH3 SO3H stabile CH3 O + H O CH3 O CH3 O H + + O CH3 +O CH3 + NO2 H O CH3 O CH3 + + H CH3 NO2 NO2 NO2 H NO2 H NO2 H NO2 NO2 stabile Reattività: O + NO2 NO2 + CH3 H rilascio elettronico +R,-I, con |+R|>|-I| più reattivo di benzene b) difluorometilbenzene CHF2 Orientamento: meta attrazione (-I) meno reattivo c) etilbenzene CH2 CH3 Orientamento: orto + para rilascio (+I) più reattivo d) clorobenzene Cl e) nitrobenzene O Orientamento: meta attrazione (-I) meno reattivo h) difenil etere Orientamento: meta attrazione (-I) meno reattivo g) benzoato di etile f) acido benzensolfonico SO3H NO2 Orientamento: orto + para attrazione (-I > +R) meno reattivo O C OCH2CH3 Orientamento: meta attrazione (-I) meno reattivo Orientamento: orto + para rilascio (+R > -I) più reattivo 7 i) bifenile Orientamento: orto + para rilascio (+R > -I) più reattivo j) terz-butilbenzene k) fluorobenzene F CH3 H3C C CH3 Orientamento: orto + para attrazione (-I > +R) meno reattivo Orientamento: orto + para rilascio (+I) più reattivo m) acetato di fenile l) metilbenzene O CH3 Orientamento: orto + para rilascio (+I) più reattivo O C CH3 Orientamento: orto + para rilascio (+I) più reattivo n) acetilbenzene (= acetofenone, oppure fenil metil chetone oppure 1-feniletanone) O C CH3 Orientamento: meta attrazione (-I) meno reattivo o) benzammide p) benzonitrile O C NH2 Orientamento: meta attrazione (-I) meno reattivo C N Orientamento: meta attrazione (-I) meno reattivo q) iodobenzene I Orientamento: orto + para attrazione (-I > +R) meno reattivo 8 11. Il nitrobenzene viene trattato con la miscela solfonitrica (HNO3 + H2SO4). a) Scrivere l'equazione chimica della reazione, dando il nome del prodotto. b) Scrivere il meccanismo, giustificando l'orientamento. c) Prevedere l'ordine di reattività dei seguenti composti nella nitrazione aromatica: nitrobenzene, fenolo, benzene, metilbenzene (spiegare). NO2 NO2 HNO3 equazione chimica H2SO4 NO2 meccanismo: + H2O NO2 HNO3 + H2SO4 -O + O N H2O + +NO2 Si scrivono gli addotti possibili (sulla carta), relativi all’attacco in orto, meta e para e le rispettive STRUTTURE di RISONANZA + +NO2 Si esaminano le strutture in cui la carica positiva (portata dall’elettrofilo) finisce sul C con il sostituente (addotti orto e para) -O -O + O N H orto NO2 + O + O N H + O N H + NO2 + NO2 instabile -O -O + O N + meta H + para + O N + O N H NO2 -O -O + O N + NO2 -O + O N -O NO2 H NO2 NO2 + O N + + + H NO2 H NO2 H NO2 instabile 9 Per la REATTIVITA’ si considera la densità elettronica delle posizioni dove viene orientato l’elettrofilo 4° CH3 OH NO2 1° meta 3° orto+para -I 2° orto+para tutte le posizioni -I < +R +I l'elettrofilo reagisce più facilmente con un C ricco di elettroni 12. a) Scrivere l'equazione chimica della reazione che avviene trattando il bromobenzene con acido nitrico + acido solforico, giustificando l'orientamento. b) Spiegare l'ordine di reattività che si osserva se, nelle condizioni di (a), si fanno reagire: benzene, bromobenzene, metilbenzene. HNO3 Equazione chimica Br Br Br NO2 H2SO4 + NO2 Meccanismo e Orientamento: + H 2O HNO3 + H2SO4 Br Br + +NO2 Br Br H + NO2 + H NO2 Br H2O + +NO2 NO2 + H NO2 Br H Br + NO2 + + Br + H NO2 H NO2 + H NO2 H NO2 orto + para + Br stabili Br stabili + Br H NO2 H NO2 Br + -I > +R H NO2 10 Reattività: CH3 Br 2° 3° tutte le posizioni 1° orto + para orto + para -I > +R +I 13. Disporre i seguenti composti in ordine di reattività crescente nei confronti dell'acido solforico fumante (acido solforico + anidride solforica): fenolo, nitrobenzene, metilbenzene, clorobenzene. Scrivere le reazioni corrispondenti e spiegare. H2SO4 + SO3 E+ = SO3 OH OH OH SO3 SO3H + SO3H NO2 NO2 SO3 SO3H SO3 CH3 CH3 SO3 SO3H + SO3H Cl Cl Cl CH3 SO3H + SO3H REATTIVITA' 1° -I < +R 4° 2° -I Cl CH3 NO2 OH 3° +I -I > +R 11 15. Completare le seguenti reazioni di sostituzione elettrofila aromatica: a) N,N-dimetilanilina + cloruro di acetile e cloruro di alluminio H3C CH3 N H3C CH3 H3C CH3 N N CH3COCl COCH3 + AlCl3 COCH3 b) clorobenzene + bromo e bromuro ferrico Cl Cl Cl FeBr3 Br + + Br2 + HBr Br c) propanoato di fenile e acido nitrico + acido solforico O O O O O CH2CH3 NO2 + O CH2CH3 HNO3 H2SO4 CH2CH3 NO2 d) isopropilbenzene + acido solforico ed anidride solforica SO3 SO3H + H2SO4 SO3H e) nitrobenzene + acido nitrico ed acido solforico NO2 NO2 HNO3 H2SO4 NO2 f) bifenile + anidride acetica e cloruro di alluminio COCH3 AlCl3 + (CH3CO)2O CH3CO2H COCH3 + 12 17. Spiegare perché il metilbenzene è orto+para orientante, mentre il triclorometilbenzene è meta orientante. CH3 CH3 CH3 H + CH3 + E H + H stabili E E CCl3 CCl3 + CCl3 H CCl3 + E H + E H E instabili 18. Il vinilbenzene dà sostituzione elettrofila aromatica molto più facilmente del benzene ed i prodotti sono i derivati orto + para. Spiegare, servendosi degli addotti σ . CH CH2 CH CH2 H + E+ + CH CH2 CH CH2 + + E H E CH H in orto CH2 E + CH H + E E + E + CH CH2 H CH CH2 H CH2 H E struttura di risonanza in più CH CH2 + in meta + H H E + H E E CH CH2 in para CH CH2 CH CH2 + CH CH2 CH CH2 CH CH2 + + H + E H E H E H E struttura di risonanza in più 13 23. Il fenolo viene trattato con una soluzione acquosa di bromo; a) scrivere l’equazione chimica della reazione, giustificando l’orientamento, b) Commentare le condizioni in cui la reazione avviene, confrontandole con quelle necessarie perché la reazione avvenga con il benzene. OH OH Br H2O Br + Br2 Br Il gruppo OH è a forte rilascio elettronico (+R > -I) Basta il solvente polare, mentre per bromurare il benzene serve l’acido di Lewis: fenolo più reattivo di benzene 31. Quale dei tre trimetilbenzeni isomeri vi aspettate sia più reattivo in una sostituzione elettrofila aromatica? Spiegare. -CH3 orienta in orto+para, perché quando la carica positiva dell'addotto σ va sul C che porta il metile, l'addotto è stabilizzato dal sostituente CH3 CH3 H3 C 6 CH3 4 5 5 3 CH3 C4, C6: orto a 1 metile e para a 1 metile C5 : para a 1 metile CH3 CH3 6 2 6 H3C 4 CH3 C2 = C5 = C6: orto a 2 metili e para ad 1 metile C5, C6: orto a 1 metile e para a 1 metile C3 : orto a 2 metili 14 32. L'isopropilbenzene reagisce con il cloro in due modi diversi, a seconda delle condizioni. a) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene alla luce ultravioletta. b) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene in presenza di cloruro ferrico. CH3 CH3 Cl2, hν H3C SOSTITUZIONE RADICALICA C Cl H3C Cl2 + HCl CH H3C Cl2 CH CH3 H3C hν . 2 Cl ecc. CH3 CH FeCl3 Cl + SOSTITUZIONE ELETTROFILA AROMATICA + HCl Cl Cl+ + -FeCl4 Cl2 + FeCl3 35. a) Scrivere l'equazione chimica ed il meccanismo della nitrazione aromatica del naftalene, giustificandone l'orientamento. NO2 equazione: HNO3 H2SO4 meccanismo: HNO3 + H2SO4 H NO2 + NO2+ NO2+ + H3O+ + 2 HSO4H NO2 NO2 H NO2 + + + H + H NO2 + H NO2 + NO2 addotto in β meno stabile: orientamento in α 15 b) Scrivere l'equazione chimica ed il meccanismo della solfonazione a bassa temperatura del naftalene. Spiegare perché a temperature più elevate si ottiene un isomero diverso. equazione: SO3H SO3 H2SO4 a bassa temperatura H SO3 H SO3 H SO3 meccanismo: + + + SO3 SO3H + a bassa temperatura a temperatura elevata controllo cinetico controllo termodinamico H SO3H -SO3H (voluminoso) in β è più stabile H SO3H H 36. A differenza di benzene e naftalene, il fenantrene addiziona una molecola di bromo. Scrivere la reazione e spiegare perché avviene, servendosi delle strutture di risonanza del fenantrene. Br2 H 9,10-dibromo-9,10-diidrofenantrene Br H Br 37. Completare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a) isopropilbenzene + permanganato di potassio (KMnO4), a caldo CH3 H3C CH KMnO4, Δ 2 CO2 CO2 H+ CO2H acido benzencarbossilico 16 b) vinilbenzene + acido cloridrico CH c) metilbenzene + cloro, alla luce ultravioletta Cl CH CH3 CH2 CH3 CH2 Cl Cl2, hν 1-cloro-1-feniletano cloruro di benzile d) etilbenzene + cloro e cloruro ferrico CH2 CH3 CH2 CH3 Cl Cl2 FeCl3 CH2 CH3 + p-cloroetilbenzene Cl o-cloroetilbenzene Br CH2 CH3 e) etilbenzene +bromo, a caldo Br2 CH CH3 Δ 1-bromo-1-feniletano f) vinilbenzene + permanganato di potassio, a caldo CH CH2 KMnO4, Δ CO2 H+ CO2 CO2H acido benzencarbossilico g) metilbenzene + 1-cloropropano e cloruro di alluminio CH3 CH3 CH2 CH2 CH3 Cl CH3 CH2 CH2 CH3 + + CH3 CH3 CH CH3 CH3 + AlCl3 o-metilpropilbenzene CH2 CH2 CH3 CH CH3 o-isopropilmetilbenzene CH3 p-metilpropilbenzene p-isopropilmetilbenzene 17 h) vinilbenzene + H2 (un equivalente) e Pt CH2 CH3 CH CH2 H2 Pt etilbenzene i) vinilbenzene e bromo CH CH2 Br2 Br CH CH2 Br 1,2-dibromo-1-fenilbenzene j) 1,4-diidrossi-2-metossibenzene + ossido di argento OH OCH3 O OCH3 Ag2O OH O 2-metossi-1,4-benzochinone k) benzene + sodio in ammoniaca ed etanolo H H Na in NH3 CH3CH2OH H H 1,4-cicloesadiene l) vinilbenzene + H2 (in eccesso) e Pt CH CH2 H2 (eccesso) CH2 CH3 Pt etilcicloesano 38. Scrivere l'equazione chimica delle seguenti reazioni: a) benzene + ossigeno e pentossido di vanadio (V2O5), ad elevata temperatura O2 V 2O 5 Δ O O O 18 b) antracene + anidride cromica (CrO3) ed acido solforico O CrO3 H2SO4 O O OH c) p-benzendiolo + ossido di argento (Ag2O) Ag2O O OH d) propilbenzene + permanganato di potassio, a caldo. CH2 CH2 CH3 - CO2 CO2H H+ KMnO4 + 2 CO2 39. Scrivere i prodotti delle seguenti reazioni del cloruro di p-metilbenzen diazonio con: a) KI + N N I b) CuCN + N N CuCN Cl- Cl- CH3 c) KOH C N KI + N CH3 OH N Cl- KOH CH3 CH3 d) H2O, a caldo + N CH3 e) CuBr + N f) NaNO2, Cu N + N Br CH3 N CH3 NO2 NaNO2, Cu Cl- CuBr ClCH3 OH H2O ClΔ CH3 CH3 N CH3 CH3 19 g) NaBF4 e poi aumentando la temperatura. + N + N N NaBF4 Cl- F N BF4- CH3 Δ CH3 CH3 42. Scrivere i passaggi che permettono di effettuare le seguenti trasformazioni: a) da metilbenzene a 2-bromo-4-metilanilina ? CH3 -CH3 orienta in orto + para -NH2 orienta in orto + para (rilascio elettronico maggiore di alchile) CH3 CH3 NO2 + CH3 si separa NO2 in C2 e C6: +I (CH3), -I (NH2) in C3 e C5: +I (CH3), -I (NH2), 6 +R(NH2) 5 NH2 E+ Br2 [H] FeBr3 NO2 3 2 CH3 CH3 CH3 Br NH2 CH3 HNO3 H2SO4 CH3 NH2 Br NH2 CH3 Br ? CH3 E se invece avessimo dovuto trasformare il metilbenzene in 3-bromo-4-metilanilina ? NH2 20 CH3 Br 3 4 C4, C6: orto + para a Br C3, C5: orto + para a CH3 6 CH3 CH3 CH3 HNO3 5 H2SO4 Br Br2 si separa NO2 CH3 CH3 CH3 NO2 + Br [H] FeBr3 NH2 NO2 NO2 b) da metilbenzene a 3,5-dibromometilbenzene -CH3 orienta in orto + para ? CH3 è necessario introdurre temporaneamente -NH2 -NH2 orienta in orto + para (rilascio elettronico maggiore di alchile) CH3 CH3 CH3 NO2 [H] + H2SO4 Br Br NH2 FeBr3 CH3 NaNO2 NH2 HCl Br Br Br2(eccesso) NH2 NH2 CH3 + CH3 + NO2 CH3 Br Br CH3 HNO3 CH3 CH3 + N N + Br N Br +N Br Br H3PO2 CH3 Br Br ? c) da anilina a 2,4,6-tricloronitrobenzene Cl NH2 -Cl orienta in orto+para NH2 + NH2 Cl2(eccesso) Cl Cl NaNO 2 FeCl3 Cl Cl conviene tenere -NH2 Cl N N Cl H PO Cl 3 2 Cl HCl Cl Cl Cl 21 N d) da metilbenzene a 2-metil-4-nitrobenzonitrile C -CH3 orienta in orto+para CH3 -CN si introduce attraverso -NH2, che orienta in orto + para ed è a rilascio maggiore di -CH3 CH3 NO2 CH3 H2SO4 + para H2SO4 O 2N CH3 CH3 + N N NaNO2 HCl NH2 NH2 HNO3 [H] CH3 NO2 CH3 CH3 HNO3 ? C CuCN N O 2N O 2N e) da metilbenzene a 3-bromo-4-iodometilbenzene ? CH3 CH3 -CH3 orienta in orto+para -I si introduce attraverso -NH2, che orienta in orto + para ed è a rilascio maggiore di -CH3 CH3 CH3 HNO3 [H] CH3 H2SO4 CH3 Br2 Br HCl NH2 NH2 CH3 CH3 NaNO2 FeBr3 NO2 Br I KI Br +N N Br I + orto 22 47. Il m-clorometilbenzene reagisce con sodioammide in ammoniaca liquida, dando tre prodotti isomeri. Scrivere l'equazione chimica della reazione e spiegare la formazione dei tre isomeri, sulla base del meccanismo. H NH2 Cl NH2 NaNH2 + + + H NH2 CH3 CH3 CH3 CH3 CH3 CH 3 48. Il defoliante Agent Orange, usato nella guerra del Vietnam (e che è ritenuto responsabile della malattia e della morte di molti reduci, anche a distanza di anni), contiene l'acido (2,4,5-triclorofenossi)etanoico, indicato come 2,4,5-T. Questo acido si prepara per reazione parziale dell'1,2,4,5-tetraclorobenzene con NaOH, seguita da reazione con cloroacetato di sodio. a) Scrivere la reazione di sintesi del 2,4,5-T. b) Una delle impurezze contenute nell' Agent Orange (probabilmente il principale componente tossico) era la 2,3,7,8-tetraclorodibenzodiossina, 2,3,7,8-TCDD, spesso chiamata, impropriamente, diossina. Indicare come 2,3,7,8-TCDD si forma nel corso della sintesi di 2,4,5-T. c) Come si può eliminare la contaminazione da TCDD sia dopo il primo passaggio che alla fine della sintesi? Cl Cl O CH2CO2H Cl Cl Cl Cl Cl 2,4,5-T O Cl Cl NaOH Cl OH Cl - Cl CH2 C O Cl Cl Cl Cl Cl Cl Cl O CH2CO2 Cl Cl H+ Cl O CH2CO2H Cl Cl - O 2,4,5-T b) la 2,3,7,8-tetraclorodibenzodiossina viene dalla sostituzione nucleofila tra due molecole di fenossido Cl O Cl Cl Cl O Cl Cl Cl -O Cl Cl O Cl 2,3,7,8-TCDD c) 2,3,7,8-TCDD non è solubile in acqua L’estrazione con una soluzione acquosa moderatamente basica (bicarbonato) purifica il 2,4,5-T 23
Scarica