IL MONITORAGGIO DELLA MALATTIA RESIDUA MINIMA NELLA
LEUCEMIA
LINFOBLASTICA ACUTA (LLA): QUANDO E PERCHÉ USARLA.
A.Biondi
Clinica Pediatrica Università di Milano-Bicocca; Centro di Ricerca
"M.Tettamanti" Ospedale S.Gerardo, Monza.
Introduzione
Nonostante
i
significativi
progressi
ottenuti
nella
terapia
della
leucemia linfoblastica acuta (LLA), in particolar modo nel bambino, il
problema della recidiva durante la terapia o precocemente dopo la
sospensione della stessa rappresenta ancora uno dei " challenge" più
rilevanti. Circa il 30% dei bambini e più della metà degli adulti con
LAL presenta recidiva della malattia. La recidiva
è probabilmente
espressione della persistenza di un clone leucemico "resistente" alla
terapia convenzionale e di conseguenza il monitoraggio della malattia
potrebbe
contribuire
alla
comprensione
della"storia"
biologica
della
malattia stessa. Non è infatti ancora noto per quanto tempo le cellule
leucemiche persistono durante la fase di remissione della malattia, né
se la determinazione precoce della recidiva possa rappresentare un
vantaggio clinicamente rilevante. I diversi metodi che sono stati fino
ad ora proposti per monitorare la malattia residua minima (MRM) nelle
leucemie acute differiscono per la loro sensibilità e specificità nel
discriminare
la
natura
leucemica
delle
residue
cellule
blastiche
riscontrate in un midollo durante la fase di terapia. Con le tecniche
convenzionali
di
citomorfologia
è
possibile
identificare
l'1-5%
di
cellule
leucemiche
in
una
popolazione
di
cellule
normali
.
La
sensibilità aumenta in modo significativo (fino a 10-2/10-3) quando
vengono applicate tecniche immunologiche di doppia marcatura utilizzando
anticorpi
diretti
contro
antigeni
di
differenziazione
delle
serie
mieloide e linfoide ed enzimi selettivamente espressi negli stadi più
precoci
dell'ontogenesi
(ad
es.
l'enzima
terminal
deoxinucleotidil
transferasi
-Tdtnelle
LLA)
(si
veda
la
Ref.1per
una
revisione
sull'argomento).
I geni delle Immunoglobuline (Igs) e dei Recettori T per l'antigene
(TcR): targets universali per lo studio della MRM nelle LAL
I geni delle Igs e TcR condividono un medesimo motivo strutturale
caratterizzato dalla presenza di numerosi segmenti multipli e separati
di DNA che codificano per le porzioni V,J,D e C delle catene pesanti e
leggere delle Igs e delle catene dei recettori T per l'antigene (TcR).
Durante l'ontogenesi dei B e T linfociti, i geni delle Igs e dei TcR
vengono assemblati mediante un processo di riarrangiamento somatico. I
segmenti genici separati codificanti le regioni V,D, J vengono riuniti
per
formare
un
unico
esone
codificante
la
regione
variabile.
Lo studio del riarrangiamento dei geni delle catene pesanti e leggere
delle immunoglobuline (Igs) e delle catene alfa, beta, gamma e delta dei
TcR è divenuto il metodo più sensibile per valutare la clonalità di
un'espansione linfoide e ha trovato diffuso impiego nella diagnostica
immunoematologica.
Lo
studio
genotipico
delle
malattie
linfoproliferative
ha
sostanzialmente
modificato
negli
ultimi
anni
la
nostra comprensione e classificazione di tali patologie. Molte delle
conoscenze acquisite sul riarrangiamento dei geni delle Igs e dei TcR
(ricombinazione, "gerarchia" del riarrangiamento) e su altri meccanismi
che amplificano il repertorio di specificità che possono essere generate
da un linfocita B o T, sono state ottenute dallo studio delle malattie
linfoproliferative.
I
contributi
di
tali
ricerche
di
base
hanno
di
ritorno
fornito
gli
strumenti
per
una
caratterizzazione
molecolare
(clonalità,
stadio
di
differenziazione,
stipite
di
appartenenza)
di
leucemie
e
linfomi.
Lo studio genotipico è stato utilizzato per valutare la MRM durante la
fase di remissione di pazienti affetti da leucemie e linfomi e per
identificare
precocemente
la
recidiva.
Evidenze
di
riarrangiamento
monoclonale sono state occasionalmente rilevate in pazienti durante la
fase apparente di remissione ematologica e tale reperto ha preceduto
l'evidente
recidiva.
Un
limite
all'applicazione
di
tale
approccio
risulta
dalla
sensibilità
dell'analisi
genotipica
(1-5%)
mediante
Southern
blot.
Più
di
recente
la
disponibilità
dell'amplificazione
genica mediante PCR ha suggerito la possibilità di sviluppare strategie
che, utilizzando tale marcatore di clonalità, possano essere utilizzate
nella
maggior
parte
dei
casi
di
LLA.
Come
precedentemente
indicato,
l'ampia
variabilità
del
repertorio
antigenico è prodotta dalla ricombinazione casuale e stocastica dei
diversi
segmenti
e
dalla
variabilità
giunzionale
determinata
dall'aggiunta di extranucleotidi a livello delle giunzione VDJ. Come
mostrato
nella
Fig.1,
utilizzando
una
strategia
che
preveda
l'amplificazione
del
riarrangiamento
del
clone
leucemico
all'esordio
mediante primers per V e J è possibile identificare la sequenza
nucleotidica della giunzione N (sia per i geni delle Igs che per i TcR).
Un oligonucleotide complementare alla regione di giunzione rappresenta
una sonda specifica del clone leucemico utilizzabile successivamente o
come primer di una reazione di amplificazione ("allele specific-PCR-ASO)
oppure come sonda da utilizzare per l'ibridazione di prodotti di PCR
dopo
dot-blot
(2).
L'analisi
mediante
Southern
del
tipo
di
riarrangiamento
presente
all'esordio
della
malattia
può
essere
sostituita
dalla
diretta
amplificazione delle più comuni ricombinazioni dei geni TcR g e d e
della delezione di Igk, osservabili nelle "B-cell precursor" LLA, come
indicato
nella
Tab.1.
Il prodotto di amplificazione viene successivamente separato mediante
gel di poliacrilamide per confermare la natura monoclonale del campione
in esame e per ottenere mediante escissione della banda, un materiale
direttamente analizzabile per ottenere la sequenza di giunzione (3).
Numerose sono le variabili che si sono dimostrate rilevanti al fine
della
sensibilità
del
metodo:
tra
queste,
il
numero
di
cellule
analizzabili e la qualità del campione da cui viene estratto il DNA. La
sensibilità non può essere superiore al reciproco del numero di cellule
del campione. In una reazione di PCR la massima quantità utilizzabile è
pari a 1-2 ug di DNA che corrispondono a circa 1.6-3.2 x 105 cellule. Il
numero di copie di genoma analizzabili può essere pertanto incrementato
solo eseguendo diverse singole reazioni di PCR. Nel caso delle LLA,
non è possibile utilizzare il sangue periferico per valutare la MRM
durante le fasi di remissione, poiché il normale background dei
linfociti T o B che utilizzano gli stessi segmenti di ricombinazione a
quelli dimostrati nel clone
leucemico,
riducono
significativamente
la
sensibilità
della
sonda
clone-specifica.
La valutazione dei risultati di MRM è nella maggior parte dei casi
eseguita mediante analisi semiquantitativa. L'intensità del campione in
esame viene confrontata con il segnale di intensità ottenuto in campioni
di progressive diluizioni del DNA estratto alla diagnosi della malattia
con DNA estratto da cellule mononucletate isolate da un pool di donatori
sani. Più di recente, metodi più accurati sono stati proposti per
ridurre
al
minimo
la
variabilità
dei
risultati
e
favorirne
la
comparabilità. L'utilizzo di uno standard interno di amplificazione di
un segmento di DNA , clonato in un plasmide, corrispondente ad una
determinata ricmbinazione VJ o VDJ, di peso molecolare differente a
quelli normalmente osservabili, incluso in ogni reazione di PCR, può
permettere un confronto più accurato dell'intensità della banda ottenuta
dall'amplificazione del campione leucemico e di conseguenza una stima
quantitativa
della
MRM.
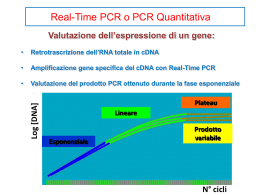
Più di recente si è resa disponibile una nuova tecnologia per la
valutazione
quantitativa
dei
prodotti
di
PCR,
denominata
“real-time-quantitativePCR”
(RQ-PCR)
(4).
Con
questo
approccio
è
possibile utilizzare l’attività esonucleasica
della
Taq
polimerasi
nella
sua direzione 5’-3’ per la determinazione e quantificazione di un
prodotto specifico di PCR durante la reazione stessa di amplificazione.
Mentre procede la reazione di PCR, una sonda che riconosce una sequenza
interna al prodotto di amplificazione viene degradata con la conseguente
emissione
ed
accumulo
di
un
segnale
fluorescente.
Grazie
alla
determinazione in tempo reale dei singoli prodotti di amplificazione, il
metodo è particolarmente rapido ed accurato nella determinazione di
diluizioni seriali durante il monitoraggio della malattia. La RQ-PCR
sembra
essere
particolarmente
utile
per
la
valutazione
quantitativa
della MRM, come già riportato nel monitoraggio di alcune traslocazioni
cromosomiche come la t(9;22), t(14;18) e t(8;21). Più di recente dati
preliminari sono stati riportati anche per i geni delle Ig e TcR quando
utilizzati come target per la valutazione della MRM. Nella Fig.2 sono
riportati
schematicamente
i
risultati
comparativi
dei
due
approcci
relativi
ad
un
caso
esemplificativo.
Quale impatto dello studio della MRM nell' approccio al paziente con
LLA?
La maggior parte dei dati fino ad ora pubblicati sono relativi alle LLA
del bambino. In tale contesto i dati inizialmente prodotti da diversi
gruppi sulla correlazione tra MRM ed evoluzione clinica sono risultati
contradditori (si veda ref.1). Sebbene in alcune serie di pazienti sia
stata osservata una buona correlazione tra persistenza di malattia ,
valutata come MRM, e la successiva recidiva (5,6), in altre casistiche
l'osservazione di MRM anche a 1-2 anni dalla diagnosi, in pazienti
rimasti in remissione completa , ha sollevato qualche dubbio sul suo
reale
significato
(7).
I
risultati
ottenuti
più
recentemente
su
casistiche più ampie e più omogenee per trattamento hanno permesso di
cominciare a delineare un pattern di comportamento della MRM nelle LLA
del bambino più omogeneo anche utilizzando strategie diverse. I dati
indipendenti di numerosi gruppi hanno indicato che la persistenza di
malattia al termine della prima fase di induzione (come misura della
citoriduzione
e
di
conseguenza
indirettamente
di
sensibilità
al
trattamento)
ben
correla
con
la
probabilità
di
successive
ricadute
(8,10). Altri studi hanno invece indicato nella persistenza di malattia
specie al termine della fase di consolidamento, l'elemento di maggiore
significatività più che la positività rilevata ad un determinato momento
della
terapia
(10).
In
tale
contesto
si
collocano
i
dati
ottenuti
nell'ambito
del
gruppo
cooperativo
"I-Berlin-Frankfurt-Munster"
(I-BFM)
che comprende centri dei seguenti paesi europei: Germania, Italia,
Olanda ed Austria. Lo studio condotto su 240 bambini affetti dal LAL, si
è proposto di valutare il valore predittivo della MRM mediante
amplificazione della regione di giunzione dei geni TcRd , TcRg, Igk e
TAL-1. La negatività della MRM ai diversi tempi del trattamento è
risultata
significativamente
associata
ad
una
bassa
incidenza
di
recidive (3-15% a tre anni), e al contrario un incremento di 5-10 volte
degli eventi (39-86% a tre anni) si è osservato nei casi di MRM
positiva.
Il
dato
della
MRM
è
risultato
essere
un
fattore
prognosticamente
indipendente
da
altri
parametri
clinici
e
biologici
della malattia all’esordio, in particolar modo quando valutata alla fine
dell’induzione
e
prima
del
consolidamento.
A
questi
tempi
di
trattamento, la presenza di un livello di MRM *10-2 è risultato
associato ad un’incidenza di almeno tre volte superiore di recidive a
confronto con i casi con MRM *10-3. L’analisi della MRM a tempi più
tardivi
dalla
diagnosi
è
risultata
ancora
più
significativa
nell’identificare i pazienti con successiva recidiva. In base ai dati
di MRM relativi ai tempi precoci è stato possibile stratificare i
pazienti in funzione del rischio relativo di ricaduta , fornendo le basi
per
un
futuro
suo
utilizzo
in
protocolli
clinici.
Conclusioni
L'approccio molecolare allo studio della malattia residua in pazienti
affetti da leucemia acuta conferma lo straordinario impatto che le
tecniche di biologia molecolare hanno avuto in campo emato-oncologico.
Ciò che diventa ovviamente rilevante, considerando il sempre più rapido
affinamento e semplificazione delle tecniche di analisi molecolare, è la
possibilità di dimostrare dal punto di vista sperimentale il significato
di una remissione " molecolare" in rapporto alla risposta terapeutica,
alla prognosi e in ultima analisi alla sopravvivenza dei pazienti
affetti
da
leucemia
acuta.
Bibliografia
1. Campana D and Pui CH. Detection of minimal residual disease in acute
leukemia:
methodologic
advances
and
clinical
significance.
Blood
85:1416,1995
2. MJPongers-Willemse, T Seriu, F Stolz, E d’Aniello,et al. Primers and
protocols for standardized detection of minimal residual disease in
acute lymphoblastic leukemia using immunoglobulin and T cell receptor
gene rearrangements and TAL1 deletions as PCR targets: Report of the
BIOMED-1 CONCERTED ACTION:Investigation of minimal residual disease in
acute
leukemia.
Leukemia
13:110,1999
3. Bottaro M, Berti E, Biondi A, Migone N, Crosti L. Heteroduplex
analysis of T-cell receptor g gene rearrangements for diagnosis and
monitoring
of
cutaneous
T-cell
lymphomas.
Blood
83:3271,1994
4. Heid CA, Stevens J, Livak KJ, Williams PM: Real-time quantitative
PCR.
Genome
Res
6:986,1996
5. Biondi A,Yokota S, Hansen-Hagge TE, Rossi V,Giudici G, Maglia O,
Basso G, Tell C, Masera G, Bartram C. Minimal residual disease in
childhood
acute
lymphoblastic
leukemia:
analysis
of
patients
in
continuos complete remission or with consecutive relapse. Leukemia
6:282,1992
6. Brisco MJ,Condon J, Hughe E, Neoth SH, et al. Outcome prediction in
childhood acute lymphoblastic leukemia by molecular quantification of
residual
disaese
at
the
end
of
induction.
Lancet
343:196,1994
7. Roberts WM, Estrov Z, Ouspenkaia MV, Johnston DA, McClain KL, Zipf
TF. Measurement of residual leukemia during remission in childhood acute
lymphoblastic
leukemia.
N
Engl
J
Med
336:317,1997
8. Costan-Smith E, Behm FG, Behm FG, Sanchez J et al. Immunological
detection
of
minimal
residual
disease
in
children
with
acute
lymphoblastic
leukaemia.
Lancet
351:550,1998
9. Cavè H, J van der Werff Ten Bosch, S Suciu, C Guidal et al. Clinical
significance
of
minimal
residual
disease
in
childhood
acute
lymphoblastic
leukemia.
N
Engl
J
Med
339:591,1998
10. JJvan Dongen, T Seriu, ERPanzer-Grumayer, A Biondi et al. Prognostic
value of minimal residual disease in acute lymphoblastic leukaemia in
childhood.
Lancet
352:1731,1998
Scaricare