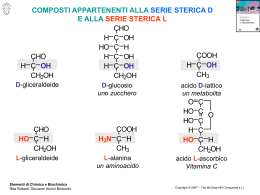
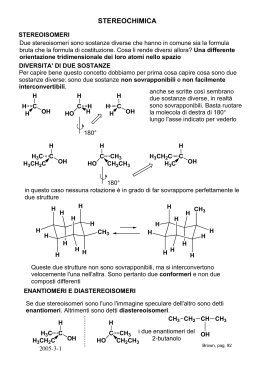
STEREOCHIMICA La stereoisomeria è una forma di isomeria in virtù della quale composti dotati di formule di struttura identiche differiscono, però, per la disposizione tridimensionale dei propri gruppi funzionali. Una classificazione di tali isomeri può essere fatta seguendo lo schema sotto rappresentato. La prima suddivisione che deve essere fatta è tra gli isomeri conformazionali (es. cicloesano) e gli isomeri configurazionali (es. isomeri cis e trans degli alcheni) a seconda che si possano o no interconvertire l'uno nell'altro. A questo punto è necessario fare una ulteriore divisione degli stereoisomeri configurazionali in isomeri ottici (enantiomeri) ed isomeri geometrici (diastereoisomeri). Gli isomeri ottici o enantiomeri sono quegli isomeri che sono uno l'immagine speculare dell'altro mentre tra gli isomeri geometrici o stereoisomeri non vi è alcuna relazione speculare. Tra questi ultimi troviamo gli isomeri cis e trans degli alcheni o dei composti ciclici. ISOMERIA OTTICA L'isomeria ottica trae origine dal fatto che una certa struttura tridimensionale può risultare non sovrapponibile alla propria immagine speculare. Strutture del genere si dicono «chirali» (e «chiralità» si dice tale proprietà) e sono caratterizzate dall'assenza di un piano di simmetria (quest'affermazione va riferita ovviamente all'effettiva struttura tridimensionale e non alla sua rappresentazione grafica sul piano). Il caso più semplice di struttura chirale è costituito da un «atomo di carbonio asimmetrico», (0405) Chimica Organica-Pag.1 cioè da un atomo di carbonio che reca quattro diversi sostituenti legati ad esso in modo covalente. Una simile struttura può esistere in due isomeri non sovrapponibili, detti antipodi ottici o enantiomeri, fra i quali intercorre la medesima relazione che passa fra un oggetto qualsiasi e la sua immagine speculare, come ad esempio le strutture (a) e (b). 3 davanti 4 dietro a) 4 a) 4 1 C 3 2 s p e c c h i o 1 C 3 s p e c c h i o 2 b) 2 b) 2 1 C 3 1 C 3 rotazione 3 4 rotazione b) 3 4 b) 1 C 4 1 C 4 4 davanti 3 dietro 2 a) 2 1 C 4 3 2 Un esempio di strutture chirali riconducibili alla realtà giornaliera sono ad esempio i guanti, o le mani o i piedi. Questi oggetti non sono sovrapponibili (mano destra e mano sinistra) ma è possibile sovrapporre l'uno (la mano destra) con l'immagine speculare dell'altro (l'immagine speculare della mano sinistra). Se invece anche due soli fra i quattro sostituenti fossero identici, la struttura suddetta acquisterebbe un piano di simmetria, cosa che permetterebbe di sovrapporla alla propria immagine speculare. Nelle strutture (a) e (b), se sono uguali i sostituenti 3 e 4, le strutture possiedono un piano di simmetria che passa per 1, C e 2. 1 a) c C 3 3 2 s p e c c h i o b) 2 1 C 3 rotazione 3 b) 3 1 C 3 a) 2 3 1 C 3 2 I chimici conoscono numerosi altri tipi di strutture chirali, però nei composti esaminati, la stragrande maggioranza dei casi di isomeria ottica riguarda strutture la cui chiralità discende direttamente dalla asimmetria dei sostituenti legati ad un atomo di carbonio tetracovalente. LE FORMULE DI PROIEZIONE DI FISCHER Mentre è possibile disegnare diagrammi bidimensionali atti a rappresentare in modo soddisfacente strutture tridimensionali aventi uno o due atomi asimmetrici, il compito diviene ben più arduo quando le molecole sono più complesse. In questo caso si fa ricorso ad una rappresentazione schematica escogitata da Fischer, secondo la quale i due (0405) Chimica Organica-Pag.2 enantiomeri della specie C, 1, 2, 3, 4 sono rappresentati da: 1 4 2 C 3 1 C 3 1 2 4 4 C 1 3 formule di proiezione 4 2 1 3 C 2 C 3 2 1 4 formule di proiezione 3 C 4 2 Per convenzione si assume che nella formula di proiezione i legami che appaiono disposti orizzontalmente rappresentino in realtà legami diretti verso il lettore e quelli che appaiono disposti verticalmente si dirigano invece dietro, al di sotto del piano della pagina (nessun legame quindi giace sopra questo piano). Nel far uso delle formule di proiezione di Fischer bisognerà stare bene attenti alle conseguenze che può avere la rotazione delle formule disegnate; infatti, mentre la rotazione di 180° (equivalente a due scambi tra i sostituenti) riproduce la proiezione di una configurazione identica a quella di partenza, la rotazione di soli 90° (equivalente ad un solo scambio tra i sostituenti) riproduce invece la proiezione dell'enantiomero di segno opposto. Ciò dipende dal fatto che la sostituzione di legami verticali con legami orizzontali nella proiezione corrisponde nello spazio alla sostituzione di una certa struttura tridimensionale con la corrispondente immagine speculare. D'altra parte è conveniente usare gli scambi per dirigere i sostituenti nelle direzioni volute conservando lo stesso enantiomero (sempre un numero pari di scambi !!!). INDICAZIONE DELLA CHIRALITA MEDIANTE I SIMBOLI R ED S (REGOLE DI CAHNINGOLD-PRELOG) Una volta stabilito come rappresentare graficamente le strutture chirali è necessario trovare un metodo per poterle identificare e riconoscere. È stato recentemente proposto un metodo sistematico per designare la configurazione assoluta. Si ammetta che un atomo di carbonio asimmetrico sia legato a quattro gruppi differenti (1, 2, 3 e 4), ai quali viene assegnato un ordine arbitrario di priorità: 1 = 1°, 2 = 2°, 3 = 3° e 4 = 4°. Se si suppone fare un numero pari in modo da portare il gruppo "ultimo" in ordine di priorità (cioè il 4) in basso (e quindi dietro) e di osservare la configurazione dell'atomo di carbonio asimmetrico guardando il tetraedro da davanti, allora gli altri tre gruppi risulteranno disposti, nell'ordine di priorità assegnato, in senso orario (a) o in senso antiorario (b). Nel primo caso avremo una configurazione R (= rectus), nel secondo una configurazione S (= sinister). (0405) Chimica Organica-Pag.3 1 4 2 C 3 1 C 3 1 2 4 4 C 3 scambi 2 2 1 3 C 2 4 scambi 1 3 a) C 1 4 3 b) C 2 R S 4 La convenzione sulla priorità stabilisce che ha la precedenza il gruppo sostituente (intorno al carbonio asimmetrico) il cui atomo centrale è contraddistinto dal numero atomico più elevato. Sarà dunque, ovviamente, l'idrogeno ad occupare l'ultimo posto. Se due gruppi sono legati al centro chirale attraverso atomi uguali, allora si tiene conto del numero e della priorità degli atomi di un posto più distanti. Inoltre, gli atomi doppiamente legati contano il doppio (ad esempio, la priorità decresce nella serie I, Br, CI, SH, F, OH, NH2, CH3, mentre COOH precede CHO, poiché tre legami dal carbonio all'ossigeno valgono più di due legami dal carbonio all'ossigeno insieme con un legame dal carbonio all'idrogeno). Se occorre, si prende in considerazione il gruppo ancora più distante. LUCE POLARIZZATA La luce è una radiazione elettromagnetica, costituita da un campo magnetico ed uno elettrico oscillanti su piani ortogonali l'uno rispetto all'altro ed entrambi rispetto alla direzione di propagazione del raggio. La luce ordinaria consiste di molteplici raggi, i cui vettori sono reciprocamente orientati in tutte le possibili direzioni, mentre nella luce polarizzata linearmente (detta semplicemente «luce polarizzata») i campi elettrici di tutti i raggi sono disposti parallelamente e i rispettivi campi magnetici oscillano sul piano ortogonale. La direzione della luce così polarizzata non viene modificata dalle soluzioni di quei composti la cui simmetria strutturale esclude ogni possibilità di enantiomeria. Se, al contrario, si fa passare un raggio di luce polarizzata attraverso la soluzione di uno degli enantiomeri di un composto a struttura chirale, si constata che il piano della luce polarizzata emergente ha subito una rotazione in senso orario o antiorario. Se la medesima luce polarizzata attraversa una soluzione dell'altro enantiomero di pari concentrazione molare, essa subirà invece una rotazione uguale quantitativamente, ma nel verso opposto. Queste determinazioni si effettuano con uno strumento detto polarimetro. (0405) Chimica Organica-Pag.4 Si definisce «destrogiro» l'isomero la cui soluzione ruota il piano della luce polarizzata in senso orario quando l'osservatore si ponga di fronte alla sorgente di luce, «Ievogiro» quello la cui soluzione ruota il piano di polarizzazione in senso antiorario. Se le soluzioni di due enantiomeri che isolatamente sono l'uno destro-, l'altro levo-giro, vengono mescolate in uguale concentrazione, la soluzione risultante si manifesta otticamente inattiva. Una miscela siffatta si dice «miscela racemica». Si definisce potere rotatorio specifico (α) di una sostanza l'angolo, misurato in gradi, del quale risulta ruotato il piano della luce polarizzata linearmente, dopo avere attraversato una soluzione dello spessore di 1 dm e contenente 1 g/ml di soluto. Come la temperatura di fusione, questa grandezza costituisce una proprietà caratteristica dei composti chirali, i quali vengono rappresentati con rotazione specifica positiva se destrogiri, e negativa se levogiri. Se, ad esempio, uno dei due isomeri della coppia enantiomera possiede rotazione specifica +150°, l'altro sarà levogiro, con rotazione specifica - 150°. Nella nomenclatura si fa uso dei simboli (+) e (-) per distinguere i due enantiomeri; così, ad esempio, i due isomeri del 2-bromobutano, CH3CH,CHBrCH3, si possono rappresentare come (+)2-bromobutano (cioè destrogiro) e (-)2-bromobutano (levogiro). La miscela racemica o, più brevemente, il «racemo» sarà (±)2-bromobutano. Nonostante il comportamento così nettamente diverso nei confronti della luce polarizzata, gli enantiomeri, presi separatamente, manifestano identiche tutte le altre proprietà fisiche, ed anche quelle proprietà chimiche che non coinvolgano altre molecole chirali. Due acidi carbossilici enantiomeri, ad esempio, come il (+) e il (-)C6H5CH(C2H5)COOH, avranno il medesimo punto di fusione e di ebollizione, il medesimo indice di rifrazione, uguale densità, solubilità, viscosità. Saranno identici anche il loro pK e gli esteri che formeranno, i quali avranno le stesse proprietà, eccezion fatta, ovviamente, per la rotazione ottica. Reagiranno, invece, a velocità differenti con un composto otticamente attivo, come, ad esempio, il (+)butan-2-olo, fornendo esteri che questa volta non saranno identici (vedi DIASTEREOISOMERIA). Nonostante che la differenza più importante che si possa osservare fra due enantiomeri consiste nella diversa azione sulla luce polarizzata non sussiste alcuna relazione semplice che leghi il senso di rotazione della luce polarizzata alla configurazione molecolare. INDICAZIONE DELLA CHIRALITA MEDIANTE I SIMBOLI D E L In passato era in uso un tipo di nomenclatura che permetteva di identificare gli enantiomeri di un composto chirale e che viene ancor oggi usato in biochimica. Tale nomenclatura è basata sulla struttura della (+)gliceraldeide. A questo composto venne data del tutto arbitrariamente la struttura spaziale sotto riportata e poiché tale composto ruotava il piano (0405) Chimica Organica-Pag.5 della luce polarizzata in senso orario venne identificata con la lettera D (D-gliceraldeide). L'altro enantiomero fu denominato L-gliceraldeide. CHO CHO H C CH2OH OH D-(+)gliceraldeide HOH2C C H OH L-(-)gliceraldeide Basandosi su questo composto venne data la denominazione D a tutte quelle strutture che potevano in qualche modo essere correlate alla D-gliceraldeide e la denominazione L a quelle correlabili alla L-gliceraldeide. Ad esempio al (-)acido lattico e al (+)lattato di metile si diedero le denominazioni seguenti: H CO2H CO2CH3 C C CH2OH OH H acido D-(-)lattico CH2OH OH D-(+)lattato di metile Si noti che in queste denominazioni i simboli D ed L si riferiscono esclusivamente alla configurazione e non hanno alcuna relazione con il potere rotatorio. Infatti mentre la D-gliceraldeide ruota in senso orario il piano della luce polarizzata l'acido D-lattico fa esattamente il contrario, mentre il D-lattato di metile fa lo stesso. Quando, con un metodo basato sulla diffrazione dei raggi X da parte dei cristalli e realizzato in modo da consentire l'individuazione della disposizione spaziale assoluta degli atomi, è stato finalmente possibile determinare la configurazione assoluta degli enantiomeri della gliceraldeide, si è constatato che, per puro caso, le configurazioni attribuitele arbitrariamente erano quelle giuste. Le formule di proiezione su indicate rappresentano dunque le configurazioni assolute vere degli enantiomeri. La proiezione dell'aldeide D-glicerica secondo Fischer vede l'ossidrile disposto a sinistra della catena carboniosa, quando questa sia orientata in modo che il gruppo funzionale aldeidico risulti in cima e l’idrogeno in basso. Viceversa per l'aldeide L-glicerica. H C D CH2OH OH HO C HOH2C (0405) C OH H CHO 1 CH2OH formule di proiezione HO H CHO L 2 CHO CHO CH2OH H R 2 CHO HOH2C C H 3 C CHO 3 OH formule di proiezione HOH2C C 1 OH H S Chimica Organica-Pag.6 COMPOSTI CONTENENTI PIÙ DI UN CENTRO CHIRALE Dato che per ogni atomo di carbonio asimmetrico esistono due configurazioni alternative, una struttura contenente n centri di asimmetria dovrà presentare 2n stereoisomeri. È questo, ovviamente, un limite massimo, perché in taluni casi il numero effettivo degli stereoisomeri possibili è inferiore. Se si considera un composto dotato di due centri chirali recanti ciascuno gruppi sostituenti completamente diversi, allora si ottengono tutti e quattro gli stereoisomeri prevedibili, corrispondenti alle strutture da (a) a (d). Fra queste quattro strutture, le combinazioni (a)(b) e (c)-(d) costituiscono coppie enantiomere. In generale, dunque, per n centri di asimmetria, esistono 2n-1 coppie enantiomere. Se confrontiamo invece l'isomero (a) con l'isomero (c) o l'isomero (b) con l'isomero (d) essi sono fra di loro stereoisomeri ma non enantiomeri; non sono cioè l'uno l'immagine speculare dell'altro. a) 1 3 6 C C 2 5 b) 1 2 5 C 4 C 3 6 c) 1 3 5 C 4 C 2 6 d) 1 2 6 C 4 C 3 5 4 In un caso di questo tipo siamo in presenza di due diastereoisomeri cioè di due stereoisomeri non enantiomeri fra di loro (l'immagine speculare del primo non è sovrapponibile con il secondo). Se, al contrario, si considera un composto ancora contenente due atomi asimmetrici ma recanti, questa volta, sostituenti identici, allora il numero degli stereoisomeri possibili si riduce a tre. Ci si rende conto di ciò supponendo che nelle strutture dalla (a) alla (d) il gruppo 1 sia identico al 4, il 2 al 5 e il 3 al 6, nel qual caso i quattro stereoisomeri saranno rappresentati dalle figure (e), (f), (g) ed (h). Di queste ultime la (e) e la (f) descrivono strutture identiche e sovrapponibili, poiché entrambe possiedono un piano di simmetria ortogonale al legame C-C. e) 1 3 3 C C 1 2 2 f) 1 2 2 C piano di simmetria C 1 3 3 g) 1 3 2 C C 1 2 3 h) 1 2 3 C C 3 2 1 In questo caso, dunque, gli stereoisomeri possibili sono soltanto tre, due dei quali, (g) ed (h) sono enantiomeri, e quindi otticamente attivi, mentre il terzo, rappresentabile da (e) o da (f) risulta inattivo, per essere sovrapponibile alla propria immagine speculare. Un tale stereoisomero, otticamente inattivo, come si dice, per compensazione interna, viene indicato con il prefisso «meso». L'isomero meso è diastereoisomerico rispetto ai due enantiomeri (g) ed (h). L'acido tartarico, HO2CCH(OH)CH(OH)CO2H, costituisce un esempio assai noto di questo fenomeno. Si conoscono i tre stereoisomeri, dei quali sono qui sotto raffigurati struttura e (0405) Chimica Organica-Pag.7 formule di proiezione. Vale la pena di notare che gli acidi (+) e (-)tartarico, essendo enantiomeri, possiedono le medesime proprietà fisiche, mentre non è così per l'acido mesotartarico, il quale presenta proprietà fisiche differenti. CO2H HO C HO C CO2H CO2H CO2H H H C OH H C OH H H C OH HO C H pi ano di si m m etria CO2H HO C H H C OH CO2H CO2H Acido meso-tartarico CO2H Acido (+)-tartarico Acido (-)-tartarico Anche a questi composti è possibile assegnare la nomenclatura R e S. CO2H H HO C C OH 3 HO2CCHOH H Acido (+)-tartarico OH HO C H 3 HO2CCHOH C C Acido (-)-tartarico 2 CO2H HO C H H C OH H R 2 Acido S,S-tartarico 1 OH 2 HO2C OH H C OH H C OH H C OH CO2H CO2H 3 C CHOHCO2H H S CO2H C CHOHCO2H H S CO2H H 3 C CO2H CO2H CO2H 2 HO2C CO2H H R 1 OH C 1 OH 3 H 1 OH H C OH CO2H HO2CCHOH CO2H Acido R,R-tartarico CO2H C C HO 2 H R CO2H H CO2H 1 OH 1 OH 2 HO2C C 3 CHOHCO2H H S Acido meso-tartarico Acido R,S-tartarico (0405) Chimica Organica-Pag.8
Scaricare