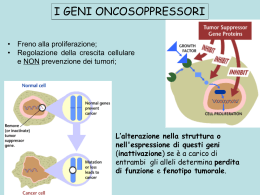
Basi molecolari del comportamento delle cellule cancerose Lo studio di embrioni in via di sviluppo e di topi geneticamente modificati ha aiutato a scoprire la funzione dei geni critici per il cancro. Come funziona nelle cellule normali GENE MUTATO Come sue mutazioni contribuiscono ai comportamenti aberranti tipici delle cellule cancerose Per la tumorigenesi sono necessarie mutazioni multiple. Molti geni critici per il cancro regolano la proliferazione cellulare. I componenti delle vie di segnalazione che normalmente funzionano per inibire la proliferazione cellulare spesso appaiono come soppressori dei tumori. Non sorprende infatti che mutazioni che colpiscono direttamente il sistema centrale del controllo del ciclo cellulare compaiano in molti cancri. La crescita continua di un cancro richiede cambiamenti ereditabili che non solo sregolano la progressione del ciclo cellulare, ma provocano anche crescita cellulare. DIVISIONE CELLULARE Sistema di controllo che fa sì che vi sia rispettivamente un solo cromosoma in ogni cellula figlia Ingrandimento della cellula prima della divisione Cruciale per il controllo della crescita cellulare: Via di segnalazione intracellulare Fosfoinositide 3-chinasi/Akt attivata da proteine segnale extracellulari. La sua attivazione: - Stimola la sintesi proteica - Aumenta notevolmente l’assorbimento di glucosio - Aumenta l’assorbimento di acetil CoA nel citosol per la sintesi dei lipidi Fosfatasi PTEN limita l’attivazione di Akt defosforilando le molecole che la PI3-chinasi fosforila. EFFETTO WARBURG: Eccessiva glicolisi. E’ particolarmente importante perché causa escrezione del piruvato in eccesso come lattato, facilmente rilevabile dalle tomografie total body. L’apoptosi: - Elimina le cellule in eccesso (es. linfonodi che proliferano molto velocemente) - Elimina cellule danneggiate o sottoposte a stress. Però mutazioni nei geni che regolano l’apoptosi permettono alle cellule cancerose di sopravvivere quando non dovrebbero. Es. Bcl2: Proteina che inibisce l’apoptosi. La sua espressione è attivata da una traslocazione cromosomica in un linfoma a cellule B. Ciò permette la sopravvivenza dei linfociti B che diversamente morirebbero. Il gene p53 potrebbe essere il gene più importante per la prevenzione del cancro umano. P53 induce l’apoptosi: - Stimolando l’espressione di molti geni proapoptotici - Legandosi alle proteine Bcl2 sulla superficie dei mitocondri ed inattivandole Se manca p53 La cellula muore (Inoltre la cellula tumorale senza p53 risulta molto meno sensibile all’irradiazione e a molti farmaci anticancro, che altrimenti provocherebbero la loro morte o l’arresto della loro proliferazione). La cellula prolifera con il genoma danneggiato Perdita dei geni soppressori dei tumori Attivazione di oncogeni Ricapitolando, la perdita dell’attività di p53 : • Permette alle cellule con DNA danneggiato di continuare il ciclo cellulare • Permette loro di evitare l’apoptosi • Permettendo di continuare il ciclo cellulare con cromosomi danneggiati, porta all’instabilità genetica tipica delle cellule cancerose, consentendo di accumulare ulteriori mutazioni che promuovono il cancro a mano a mano che si dividono • In alcuni tipi di tumore rende le cellule relativamente resistenti ai farmaci anticancro e all’irradiazione MOLTE MUTAZIONI POSSONO CONTRIBUIRE A CIASCUNO DI QUESTI TIPI DI COMPORTAMENTO SBAGLIATO, MA LE MUTAZIONI DI p53 CONTRIBUISCONO A TUTTI Modo in cui la replicazione di DNA danneggiato può portare ad anomalie cromosomiche Fibre del fuso mitotico Rottura filamenti I virus tumorali a DNA Virus: - Invasivi - Latenti Possono verificarsi eventi accidentali che attivano prematuramente alcune delle proteine virali che il virus utilizzerebbe normalmente nella sua fase replicativa per permettere al DNA virale di replicarsi indipendentemente dal ciclo cellulare. Questo tipo di evento può causare una proliferazione persistente della cellula ospite. Es. PAPILLOMAVIRUS: Causa di verruche umane, ed importante specialmente come fattore chiave causale nei carcinomi della cervice uterina. E2F La metastasi Le modificazioni delle cellule tumorali che portano a metastasi sono ancora in gran parte un mistero. Non è nemmeno chiaro quali sono le proprietà che deve assumere una cellula cancerosa perché diventi metastatica. 2 ipotesi: - ESTREMA: Non servono ulteriori cambiamenti genetici oltre a quelli necessari per indebolire i controlli normali di crescita, divisione e morte cellulare. - OPPOSTA: La metastatizzazione è un processo difficile e complesso che richiede ulteriori mutazioni, così variate che sono difficili da individuare singolarmente. 1 cambiamento nelle cellule metastatiche: sovraespressione di RhoC (GTPasi che aiuta a mediare la mobilità cellulare basata sull’actina). La metastatizzazione presenta problemi diversi per tipi diversi di cellule. 2 FASI PER LA METASTASI: - Uscita dall’epitelio parentale e invasione del tessuto sottostante (processo simile a EMT, Transizione Epiteliale Mesenchimale). Cambiamenti nell’espressione del gene Ecaderina. - Trasferimento in siti lontani attraverso il sangue o i vasi linfatici e formare metastasi Barriere della metastatizzazione VEGF Poliposi adenomatosa familiare del colon TRATTAMENTO DEL CANCRO - Prevenzione - Diagnosi - Cura - LATO POSITIVO: Le terapie tradizionali sfruttano l’instabilità genetica e la perdita delle risposte ai punti di controllo del ciclo cellulare nelle cellule cancerose. - LATO NEGATIVO: L’instabilità genetica però aiuta i cancri a diventare progressivamente più resistenti alle malattie. VARIE MUTAZIONI GENETICHE ETEROGENEITA’ PIU’ TRATTAMENTI RESISTENZA AI FARMACI RESISTENZA MULTIPLA AI FARMACI NUOVE TERAPIE - TRATTAMENTI ANTIESTROGENI Farmaci che bloccano la sintesi degli estrogeni prevengono o ritardano le recidive dei cancri alla mammella che sono stati esaminati e trovati positivi per l’espressione dei recettori per gli estrogeni. Questi trattamenti non uccidono le cellule tumorali, ma impediscono agli estrogeni di promuovere la loro proliferazione. - METODI PIONIERISTICI Di nessuna utilità clinica, perché provati solo in sistemi modello. Non funzionano nell’uomo, hanno pesanti effetti collaterali oppure sono troppo difficili da implementare. - SFRUTTAMENTO DELLA DIPENDENZA DALL’ ONCOGENE Di grande successo. E’ una strategia che si basa sulla dipendenza dall’oncogene, ovvero sulla dipendenza che alcune cellule cancerose hanno nei confronti di una particolare proteina iperattiva che producono. Consiste nel bloccare l’attività della proteina, se ciò non danneggia eccessivamente i tessuti normali. SFRUTTAMENTO DI ANTICORPI Consiste nell’utilizzare anticorpi per introdurre all’interno delle cellule tumorali particolari molecole tossiche. Queste molecole possono anche diffondersi alle cellule tumorali circostanti, aumentando le probabilità che anch’esse siano uccise anche se l’anticorpo non si è legato direttamente ad esse. CONTRO: Gli anticorpi sono molto difficili da produrre in gran quantità, sono molto costosi e devono essere somministrati per iniezione - I vasi sanguigni del tumore sono un bersaglio logico della terapia del cancro. Molti cancri possono essere trattabili amplificando la risposta immunitaria contro un tumore specifico. Un trattamento con più farmaci contemporaneamente è molto più efficace del trattamento sequenziale
Scaricare