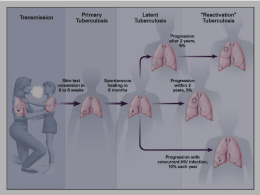
Morbidity and Mortality Weekly Report www.cdc.gov/mmwr Recommendations and Reports 25 Giugno 2010 / Vol. 59 / No. RR-5 Aggiornamento delle Linee Guida sull’utilizzo degli Interferon Gamma Release Assays per la diagnosi di infezione da Mycobacterium tuberculosis – Stati Uniti d’America, 2010 department of health and human services Centers for Disease Control and Prevention MMWR Contenuti Introduzione . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1 The MMWR series of publications is published by the Office of Surveillance, Epidemiology, and Laboratory Services, Centers for Disease Control and Prevention (CDC), U.S. Department of Health and Human Services, Atlanta, GA 30333. Suggested Citation: Centers for Disease Control and Prevention. [Title]. MMWR 2010;59(No. RR-#):[inclusive page numbers]. Centers for Disease Control and Prevention Thomas R. Frieden, MD, MPH Director Harold W. Jaffe, MD, MA Associate Director for Science James W. Stephens, PhD Office of the Associate Director for Science Stephen B. Thacker, MD, MSc Deputy Director for Surveillance, Epidemiology, and Laboratory Services Editorial and Production Staff Frederic E. Shaw, MD, JD Editor, MMWR Series Christine G. Casey, MD Deputy Editor, MMWR Series Teresa F. Rutledge Managing Editor, MMWR Series David C. Johnson Lead Technical Writer-Editor Jeffrey D. Sokolow, MA Project Editor Martha F. Boyd Lead Visual Information Specialist Malbea A. LaPete Stephen R. Spriggs Terraye M. Starr Visual Information Specialists Quang M. Doan, MBA Phyllis H. King Information Technology Specialists Editorial Board William L. Roper, MD, MPH, Chapel Hill, NC, Chairman Virginia A. Caine, MD, Indianapolis, IN Jonathan E. Fielding, MD, MPH, MBA, Los Angeles, CA David W. Fleming, MD, Seattle, WA William E. Halperin, MD, DrPH, MPH, Newark, NJ King K. Holmes, MD, PhD, Seattle, WA Deborah Holtzman, PhD, Atlanta, GA John K. Iglehart, Bethesda, MD Dennis G. Maki, MD, Madison, WI Patricia Quinlisk, MD, MPH, Des Moines, IA Patrick L. Remington, MD, MPH, Madison, WI Barbara K. Rimer, DrPH, Chapel Hill, NC John V. Rullan, MD, MPH, San Juan, PR William Schaffner, MD, Nashville, TN Anne Schuchat, MD, Atlanta, GA Dixie E. Snider, MD, MPH, Atlanta, GA John W. Ward, MD, Atlanta, GA Metodi per l’Aggiornamento delle Linee Guida sugli IGRA. . . . . . . 2 Background . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2 L’epidemiologia della tubercolosi e dell’infezione da M. tuberculosis . . . . 2 Sviluppo dei test che misurano il rilascio di interferone gamma (Interferon Gamma Release Assays, IGRA) e criteri di interpretazione . . . . . . . . . . . 2 Indicazioni approvate dalla FDA per l’utilizzo degli IGRA . . . . . . . 5 Valutazione della accuratezza, della specificità e della sensibilità dei test QFT-GIT e T-Spot . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5 Utilizzo dei test QFT-GIT e T-Spot nell’indagine dei contatti. . . . . . . 7 Valore dei test QFT-GIT e T-Spot nel predire una futura tubercolosi attiva . . 7 Utilizzo dei test QFT-GIT e T-Spot nei bambini . . . . . . . . . . . . . . . 8 Utilizzo dei test QFT-GIT e T-Spot nei soggetti immunodepressi . . . . 9 Considerazioni per interventi programmatici . . . . . . . . . . . . . . . . 9 Raccomandazioni . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10 Raccomandazioni generali per l’utilizzo degli IGRA . . . . . . . . . . 10 Scelta del test . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10 Gestione clinica dopo l’esecuzione di un test . . . . . . . . . . . . . . . 12 Aree di ulteriore ricerca . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 13 Bibliografia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 13 Vol. 59 / RR-5 Recommendations and Reports 1 Aggiornamento delle Linee Guida sull’utilizzo degli Interferon Gamma Release Assays per la diagnosi di infezione da Mycobacterium tuberculosis – Stati Uniti d’America, 2010 Documento redatto da Gerald H. Mazurek, MD, John Jereb, MD, Andrew Vernon, MD, Phillip LoBue, MD, Stefan Goldberg, MD, Kenneth Castro, MD Division of Tuberculosis Elimination, National Center for HIV, STD, and TB Prevention, CDC Riassunto Nel 2005 i CDC hanno pubblicato le linee guida sull’utilizzo del test QuantiFERON-TB Gold (QFT-G) (Cellestis Limited, Carnegie, Victoria, Australia) (CDC. Guidelines for using the QuantiFERON-TB Gold test for detecting Mycobacterium tuberculosis infection, United States. MMWR;54[No. RR-15]:49–55). Successivamente, due nuovi interferon gamma (IFN-γ) release assays (IGRA) (test che misurano il rilascio di IFN-γ) hanno ottenuto l’approvazione della Food and Drug Administration (FDA) quali ausili nella diagnosi sia di infezione tubercolare latente sia di tubercolosi attiva. Questi test sono il test QuantiFERON-TB Gold In-Tube (QFT-GIT) (Cellestis Limited, Carnegie, Victoria, Australia) ed il test T-SPOT.TB (T-Spot) (Oxford Immunotec Limited, Abingdon, United Kingdom). Gli antigeni, i metodi e i criteri di interpretazione di questi test differiscono da quelli precedentemente approvati dalla FDA per gli IGRA. Per contribuire allo sviluppo di raccomandazioni sull’utilizzo degli IGRA, i CDC hanno riunito un gruppo di esperti che ha revisionato l’evidenza scientifica e ha fornito un parere circa l’utilizzo degli IGRA. Nella preparazione di queste linee guida sono stati presi in considerazione i dati sottomessi alla FDA, i documenti pubblicati e le opinioni di esperti riguardanti gli IGRA. I risultati degli studi che hanno valutato sensibilità, specificità e concordanza degli IGRA con il test cutaneo tubercolinico (TCT) non sempre sono concordi nel ritenere quale test sia migliore. Sebbene i dati riguardo l’accuratezza degli IGRA e la loro abilità di predire il rischio di futura tubercolosi attiva siano limitati, ad oggi dati di studi che hanno coinvolto popolazioni diverse non hanno riportato gravi carenze di questi test. Questo documento fornisce una guida rivolta agli ufficiali di salute pubblica, agli operatori sanitari e ai laboratoristi negli Stati Uniti, circa l’utilizzo degli IGRA approvati dalla FDA per la diagnosi di infezione da M. tuberculosis nella popolazione adulta ed in quella pediatrica. In sintesi, il TCT e gli IGRA (QFT-G, QFT-GIT, e T-Spot) possono essere utilizzati quali ausili nella diagnosi di infezione da M. tuberculosis. Essi possono essere utilizzati nei programmi di sorveglianza ed allo scopo di identificare le persone che possono beneficiare di un trattamento. Il documento fornisce inoltre alcune raccomandazioni aggiuntive, che riguardano il controllo di qualità, la scelta del test e la gestione clinica dopo l’esecuzione di un test. Sebbene siano stati compiuti sostanziali progressi nel documentare l’utilità degli IGRA, è necessario espandere la ricerca per quanto riguarda il valore ed i limiti degli IGRA in situazioni di particolare importanza dal punto di vista dell’assistenza sanitaria e del controllo della tubercolosi. Vengono infine elencate le specifiche aree che necessitano di ulteriore ricerca. Introduzione Fino al 2001 il test cutaneo tubercolinico (TCT) era l’unico test immunologico pratico disponibile in commercio e approvato negli Stati Uniti d’America per la diagnosi di infezione da Mycobacterium tuberculosis (1). Il riconoscimento che l’interferone gamma (IFN-γ) svolge un ruolo chiave nella regolazione delle risposte immunologiche cellulo-mediate nei confronti dell’infezione da M. tuberculosis ha portato allo sviluppo di test che misurano il rilascio di interferone gamma (interferon gamma release assays, IGRA) per la diagnosi di infezione da M. tuberculosis (2–4). Gli IGRA rivelano una sensibilizzazione nei confronti di M. tuberculosis attraverso la misurazione del rilascio di IFN-γ in The material in this report originated in the National Center for HIV, STD, and TB Prevention, Kevin Fenton, MD, PhD, Director; and the Division of Tuberculosis Elimination, Kenneth G. Castro, MD, Director. Corresponding preparer: Gerald H. Mazurek, MD, Division of Tuberculosis Elimination, National Center for HIV, STD, and TB Prevention, CDC, 1600 Clifton Rd., N.E., MS E-10, Atlanta, GA 30333. Telephone: 404-639-8174; Fax: 404-639-8961; E-mail: [email protected]. risposta ad antigeni specifici del micobatterio. Nel 2001, il test QuantiFERON-TB (QFT) (Cellestis Limited, Carnegie, Victoria, Australia) divenne il primo IGRA approvato dalla Food and Drug Administration (FDA) quale ausilio nella diagnosi di infezione da M. tuberculosis (5,6). Nel 2005, il test QuantiFERON-TB Gold (QFT-G) (Cellestis Limited, Carnegie, Victoria, Australia) divenne il secondo IGRA approvato dalla FDA quale ausilio nella diagnosi di infezione da M. tuberculosis (7,8). I CDC hanno pubblicato le linee guida sull’utilizzo del QFT nel 2003 e quelle sull’utilizzo del QFT-G nel 2005 (6,8). Dal 2005 ad oggi due nuovi test sono stati approvati dalla FDA e diverse centinaia di studi clinici sugli IGRA sono apparsi in letteratura su riviste scientifiche internazionali, rendendo così necessario provvedere ad un aggiornamento delle linee guida sull’utilizzo degli IGRA. Questo documento fornisce un aggiornato strumento di linea guida rivolto agli ufficiali di salute pubblica, agli operatori sanitari ed ai laboratoristi negli Stati Uniti per quanto riguarda l’utilizzo degli IGRA approvati dalla FDA per la diagnosi di infezione da M. tuberculosis nella popolazione adulta ed in quella pediatrica. 2 MMWR Metodi per l’Aggiornamento delle Linee Guida sugli IGRA I CDC hanno selezionato le pubblicazioni rilevanti apparse fino ad Agosto 2008 attraverso una ricerca in PubMed degli articoli pubblicati in lingua inglese che elencassero il termine “tubercolosi” quale argomento principale e che comprendessero i termini “QuantiFERON” o “T-Spot” nel titolo o nell’abstract. Ulteriori lavori pubblicati sono stati identificati contattando i produttori dei test ed esaminando le voci bibliografiche elencate negli articoli selezionati attraverso la ricerca bibliografica. Questi criteri di ricerca hanno permesso di identificare 152 articoli potenzialmente rilevanti. I CDC hanno analizzato i metodi applicati in ciascuno studio e sono giunti a selezionare 96 lavori originali che fornivano dati relativi a 1) sensibilità o specificità di QFT-GIT o T-Spot; 2) concordanza dei risultati del QFT-GIT e del T-Spot tra di loro o con i risultati del TCT; 3) associazione dei risultati del QFTGIT o del T-Spot con il rischio di infezione da M. tuberculosis o di successiva tubercolosi attiva; o 4) valutazione dell’uso di QFT-GIT o T-Spot nello screening dei contatti, nei soggetti immunodepressi e nella popolazione pediatrica. Nei giorni 4-5 agosto 2008, i CDC hanno convocato un meeting ad Atlanta, Georgia, per prendere in considerazione l’utilizzo di QFT-GIT e T-Spot nelle attività di controllo della tubercolosi. In occasione di questo meeting, tabulati dei risultati degli studi, sintesi descrittive, spiegazioni da parte degli autori degli studi e commenti da parte dei produttori dei test sono stati presentati ad un Comitato di Esperti* che comprendeva ufficiali sanitari deputati al controllo della tubercolosi, clinici, laboratoristi e ricercatori affermati con esperienza nel campo degli IGRA, oltre a rappresentanti dell’American Academy of Pediatrics, dell’American Thoracic Society, dell’Advisory Council for the Elimination of Tuberculosis, dell’Association of Public Health Laboratories, dei CDC, della FDA, dell’Infectious Disease Society of America, della National Tuberculosis Controllers Association, di Stop TB USA, della U.S. Army, della U.S. Air Force, e della Veterans Health Administration. I dati derivanti dalla maggior parte dei 96 lavori originali utilizzati dai CDC come evidenza scientifica sulla base della quale sono state prodotte queste linee guida, erano disponibili per una revisione da parte del comitato di esperti in forma di articoli pubblicati o di articoli accettati per pubblicazione. I CDC hanno chiesto ai membri del Comitato di Esperti di esprimere in forma scritta le proprie opinioni su come gli IGRA approvati dalla FDA debbano essere utilizzati. Nella preparazione di queste linee guida i CDC si sono avvalsi dei documenti pubblicati, dei dati sottomessi alla FDA, della documentazione contenuta nei kit dei test e delle opinioni di esperti a riguardo di QFT- GIT e T-Spot. I CDC hanno coordinato lo sviluppo di queste linee guida insieme alla American Academy of Pediatrics, alla American Thoracic Society e alla Infectious Disease Society of America. __________________ *I nominativi degli IGRA Expert Committee Members e degli IGRA Expert Committee Presenters sono riportati a pagina 25 di questo documento 25 Giugno 2010 Background L’epidemiologia della tubercolosi e dell’infezione da M. tuberculosis Complessivamente ogni anno, 9 milioni di persone sviluppano una malattia attiva attribuibile all’infezione da M. tuberculosis, e si pensa che un terzo della popolazione mondiale, all’incirca 2 miliardi di persone, abbia un’infezione latente da M. tuberculosis (9). Sebbene le persone con infezione tubercolare latente (latent M. tuberculosis infection, LTBI) non manifestino segni e sintomi di tubercolosi attiva e non siano contagiose, esse hanno un rischio aumentato di sviluppare malattia attiva e di diventare contagiose. All’incirca 2 milioni di persone muoiono ogni anno per tubercolosi attiva nonostante l’esistenza di trattamenti efficaci sia per l’infezione latente che per la malattia attiva. La prevalenza di tubercolosi attiva negli Stati Uniti è diminuita da 6,2 casi per 100.000 abitanti nel 1998 a 4,2 casi per 100.000 abitanti nel 2008 (10). Negli anni 1998-2007, delle 153.555 persone a cui è stata diagnostica una tubercolosi attiva negli Stati Uniti, 3708 (2,4%) sono morte prima che fosse stato iniziato un trattamento per la tubercolosi attiva, e 10.777 (7,0%) sono morte dopo l’inizio del trattamento, ma prima che questo fosse stato completato (CDC, dati non pubblicati, 2008). Nel 2000 un’indagine condotta utilizzando il TCT stimava che 11.213.000 cittadini statunitensi (4,2% della popolazione civile statunitense non istituzionalizzata di età > 1 anno) avessero una LTBI, rappresentando un declino del 60% dal 1972 (11). Tuttavia, il declino non era uniforme in tutti i segmenti della popolazione statunitense ed i tassi di infezione da M. tuberculosis e di tubercolosi attiva variano considerevolmente. Una categorizzazione del rischio di infezione (Box 1) e di progressione a malattia attiva (Box 2) facilita l’adozione di strategie di test mirate e la selezione di quelle persone che hanno probabilità di trarre giovamento dal trattamento dell’infezione latente (12). L’identificazione delle persone che hanno un rischio aumentato di sviluppare complicanze (ad esempio, meningite o malattia disseminata) o di andare incontro a morte in caso di tubercolosi attiva (Box 2), è un’importante componente delle strategie di test e trattamento mirato. I cittadini statunitensi che non hanno nessuna delle caratteristiche di rischio riconosciute sono considerati a basso rischio sia per l’infezione che per la malattia da M. tuberculosis. La prevalenza di infezione da M. tuberculosis tra tali soggetti è infatti stimata ≤ 1% (11). Sviluppo dei test che misurano il rilascio di interferone gamma (Interferon Gamma Release Assays, IGRA) e criteri di interpretazione Il TCT è stato usato in tutto il mondo per oltre un secolo quale ausilio diagnostico nella diagnosi sia di LTBI sia di tubercolosi attiva. Un risultato positivo del TCT si associa ad un aumentato rischio di tubercolosi attiva (13-16). Tuttavia, l’utilizzo del TCT è gravato da alcuni limiti. Affinché un TCT sia valido, è necessario che venga eseguito in maniera appropriata tramite il metodo di Mantoux, attraverso l’iniezione intradermica di 0,1 ml di un deri- Vol. 59 / RR-5 Recommendations and Reports BOX 1. Fattori di rischio di infezione da M. tuberculosi Persone ad aumentato rischio* di infezione da M. tuberculosis -contatti stretti di persone con tubercolosi attiva nota o sospetta; -cittadini stranieri provenienti da aree che hanno un’elevata incidenza di tubercolosi attiva (ad esempio, Africa, Asia, Europa dell’Est, America Latina e Russia); -persone che soggiornano in aree con elevata prevalenza di tubercolosi attiva, specie se i soggiorni sono frequenti o prolungati; -persone che risiedono o lavorano in strutture i cui ospiti hanno un aumentato rischio di tubercolosi attiva (ad esempio, istituti di correzione, strutture di lungo-degenza e case di riposo, centri di accoglienza per senza tetto); -operatori sanitari che prestano assistenza a persone che hanno un aumentato rischio di tubercolosi attiva; -popolazioni selezionate a livello locale, che hanno un’aumentata incidenza di infezione latente da M. tuberculosis o tubercolosi attiva, che possibilmente includano i soggetti che non hanno accesso alle strutture sanitarie, le categorie di individui con un basso reddito o le persone che abusano di alcol o di sostanze stupefacenti; e -neonati, bambini e adolescenti esposti ad adulti che hanno un aumentato rischio di infezione latente da M. tuberculosis o tubercolosi attiva. _____________________ Fonte: CDC. Targeted tuberculin testing and treatment of latent tuberculosis infection. MMWR 2000;49(No. RR-6). * Le persone che hanno queste caratteristiche hanno un aumentato rischio di infezione da M. tuberculosis rispetto alle persone che non rientrano in queste categorie. vato proteico purificato (PPD) tubercolinico sulla superficie volare dell’avambraccio. Inoltre, i pazienti devono ritornare per far leggere il test da un operatore sanitario ed esistono inaccuratezze e bias nella lettura del test. Infine, l’esposizione a micobatteri non-tubercolari o la vaccinazione con il bacillo di Calmette-Guerin (BCG) può ingenerare risultati falsi positivi al TCT, poiché il materiale (PPD) utilizzato nel TCT contiene antigeni che sono presenti anche nel BCG ed in alcuni micobatteri non-tubercolari (13,17,18). Nel 2001, il QFT divenne il primo IGRA approvato dalla FDA quale ausilio nella diagnosi di infezione da M. tuberculosis (5,6). Questo test utilizzava una tecnologia di enzyme-linked immunosorbent assay (ELISA) per misurare la quantità di IFN-γ rilasciata in risposta al PPD rispetto ai controlli. Nel 2003 i CDC hanno emesso le linee guida sull’utilizzo del QFT (6). Tuttavia, la specificità del QFT era inferiore rispetto a quella del TCT, nonostante che il test prevedesse l’utilizzo di due tipi di controllo: 3 BOX 2. Fattori di rischio di progressione dell’infezione a tubercolosi attiva Le persone* ad aumentato rischio di progressione dell’infezione a tubercolosi attiva comprendono: -persone con infezione da virus dell’immunodeficienza umana (HIV);† -neonati e bambini di età < 5 anni; † -persone in terapia con farmaci immunosoppressori quali antagonisti del tumor necrosis factor-alpha (TNF-α), corticosteroidi per via sistemica a dosaggio equivalente ≥15 mg di prednisone al giorno o terapia con farmaci immunosoppressori in seguito a trapianto d’organo; † -persone che hanno recentemente acquisito l’infezione da M. tuberculosis (negli ultimi 2 anni); -persone con una storia di tubercolosi attiva non trattata o trattata inadeguatamente, comprese persone con alterazioni fibrotiche alla radiografia del torace compatibili con pregressa tubercolosi attiva; -persone affette da silicosi, diabete mellito, insufficienza renale cronica, leucemia, linfoma o neoplasia del distretto testa-collo o del polmone; -persone che sono state sottoposte a gastrectomia o by-pass digiuno-ileale; -persone con un peso <90% del loro peso corporeo ideale; -fumatori e persone che abusano di droghe o bevande alcoliche; e -popolazioni selezionate a livello locale che hanno un’aumentata incidenza di tubercolosi attiva, che possibilmente comprendano i soggetti che non hanno accesso alle strutture sanitarie o le categorie di individui con un basso reddito ____________________ Fonte: CDC. Targeted tuberculin testing and treatment of latent tuberculosis infection. MMWR 2000;49(No. RR-6). * Le persone che hanno queste caratteristiche hanno un aumentato rischio di progressione dell’infezione a tubercolosi attiva, rispetto alle persone che non rientrano in queste categorie. † Indica le persone ad aumentato rischio di complicanze (ad esempio, meningite o malattia disseminata) o di morte in caso di tubercolosi attiva. da un lato un antigene di M. avium, che serviva da controllo nei confronti della sensibilizzazione da micobatteri non-tubercolari, dall’altro l’utilizzo di soluzione salina come controllo negativo (19). Il QFT non è stato più disponibile in commercio dal 2005. Al fine di migliorare la specificità sono stati sviluppati nuovi IGRA. Questi IGRA misurano la risposta ad alcuni peptidi sintetici overlappanti che rappresentano specifiche proteine di M. tuberculosis, quali early secretory antigenic target-6 (ESAT-6) e culture filtrate protein 10 (CFP-10). Queste proteine sono presenti in tutti i ceppi di M. tuberculosis e stimolano il rilascio di IFN-γ 4 MMWR misurabile in vitro nella maggior parte delle persone infettate; esse tuttavia sono assenti nei ceppi di BCG utilizzati per il vaccino e nella maggior dei micobatteri non-tubercolari (20). Pertanto, quali antigeni di un test, queste proteine conferiscono al test una migliore specificità rispetto al PPD. Tuttavia ESAT-6 e CFP-10 sono presenti in M. kansasii, M. szulgai e M. marimun e la sensibilizzazione nei confronti di questi organismi potrebbe contribuire al rilascio di IFN-γ in risposta a questi antigeni e causare risultati falsamente positivi agli IGRA. Dal momento che ESAT-6 e CFP-10 sono riconosciuti da un ristretto numero di linfociti T e stimolano una minor produzione di IFN-γ rispetto al PPD, si è reso necessario sviluppare un test ELISA più sensibile rispetto a quello utilizzato per il QFT, al fine di poter misurare le concentrazioni di IFN-γ e quindi le risposte nei confronti di ESAT-6 e CFP-10. Nel 2005 il test QuantiFERON-TB Gold (QFT-G) (Cellestis Limited, Carnegie, Victoria, Australia) divenne il secondo IGRA approvato dalla FDA quale ausilio nella diagnosi di infezione da M. tuberculosis (7,8). Il test valuta le risposte immunologiche nei confronti di ESAT-6 e CFP-10. Per il QFT-G, aliquote separate di sangue fresco intero vengono incubate in presenza dei controlli e di due combinazioni distinte di peptidi, una che rappresenta ESAT-6 e l’altra che rappresenta CFP-10. La quantità di IFN-γ rilasciata in risposta a ESAT-6 o CFP-10 (cioè, la risposta a ESAT-6 o la risposta a CFP-10) viene calcolata come la differenza tra la concentrazione di IFN-γ nel plasma del sangue stimolato con l’antigene e la concentrazione di IFN-γ nel plasma del sangue incubato con soluzione salina (controllo negativo, Nil). Nel QFT-G, la risposta specifica tubercolare è definita dalla maggiore tra le risposte a ESAT-6 o CFP-10. Una condizione per ottenere l’approvazione da parte della FDA è stata l’inclusione di criteri interpretativi che prendessero in considerazione i possibili risultati falsamente positivi che si accompagnano ad elevati valori di Nil (>0,7 UI/ml). Nel 2005 i CDC hanno emesso delle linee guida per l’utilizzo del QFT-G (8), ma i criteri addottati per l’interpretazione dei risultati in presenza di elevati valori di Nil sono stati successivamente rivisti (Tabella 1) (21). Le linee guida sull’utilizzo del QFT-G del 2005 indicavano che il QFT-G potesse essere utilizzato in tutte le circostanze nelle quali veniva raccomandata l’esecuzione di un TCT, compresi lo screening dei contatti, la valutazione di soggetti recentemente immigrati e nei programmi di sorveglianza per il controllo dell’infezione con test ripetuti (ad esempio, nel caso degli operatori sanitari) (8). Le linee guida suggerivano di adottare una certa cautela nell’applicazione del test a popolazioni selezionate, tra le quali le persone ad aumentato rischio di progressione a malattia attiva se infettate. Per misurare accuratamente il rilascio di IFN-γ negli IGRA è necessario utilizzare un campione di sangue fresco che contenga leucociti vitali. Questa esigenza tecnica ha limitato inizialmente l’utilizzo degli IGRA a quei contesti in cui fosse disponibile personale di laboratorio esperto che potesse eseguire il test su sangue entro poche ore dalla raccolta del campione. Il test QuantiFERON-TB Gold In-Tube (QFT-GIT) (Cellestis Limited, Carnegie, Victoria, Australia) è stato sviluppato allo scopo di cercare di eliminare questo limite tecnico. Nel mese di ottobre del 2007, il QFT-GIT è diventato il terzo IGRA approvato dalla FDA quale ausilio nella diagnosi di infezione da M. tuberculosis (22). Le soluzioni contenenti i controlli e gli antigeni per la stimolazione nel QFT-GIT sono contenuti in provette speciali, nelle quali viene direttamente raccolto il campione di sangue per il test, consentendo quindi una stimolazione più immediata del sangue fresco. 25 Giugno 2010 Una provetta contiene gli antigeni del test che consistono in una combinazione di 14 peptidi che coprono l’intera sequenza aminoacidica di ESAT-6 e CFP-10 ed una parte della sequenza di TB7.7. Le altre due provette servono come controlli negativo e positivo: la provetta del controllo negativo contiene solamente eparina, mentre la provetta del controllo positivo contiene eparina, destrosio e fitoemagglutinina. 1 ml di sangue venoso periferico viene raccolto all’interno di ciascuna delle tre provette, miscelato con i reagenti già presenti nelle provette ed incubato per 16-24 ore. Il plasma viene quindi separato e la concentrazione di IFN-γ nel plasma viene determinata utilizzando lo stesso ELISA più sensibile già utilizzato per il QFT-G. Per interpretare il QFT-GIT nella versione che è stata approvata dalla FDA (Tabella 2), la risposta specifica tubercolare viene calcolata come la differenza tra la concentrazione di IFN-γ nel plasma del sangue stimolato con gli antigeni (cioè il cocktail unico di peptidi che rappresenta ESAT-6, CFP-10 e TB7.7) e la concentrazione di IFN-γ nel plasma del sangue incubato in assenza di antigeni (cioè il Nil). Il QFT-GIT era stato valutato negli Stati Uniti ed utilizzato in altre nazioni prima dell’approvazione della FDA del 2007, e coloro che hanno usato il test hanno promulgato svariati criteri interpretativi. In alcuni lavori pubblicati sono stati utilizzati per il QFT-GIT dei criteri simili a quelli usati per QFT-G. Rispetto ai criteri interpretativi approvati dalla FDA per il QFT-G (Tabella 1), i criteri approvati dalla FDA nel 2007 per il QFT-GIT (Tabella 2) definiscono i test con un Nil compreso tra 0,7 e 8,0 ed una risposta tubercolare pari al 25%-50% del Nil cone un risultato positivo piuttosto che indeterminato. Inoltre, i test con un Nil compreso tra 0,7 e 8,0 ed una risposta tubercolare che è <25% del Nil vengono interpretati come indeterminati. A luglio del 2008, il T-Spot è diventato il quarto IGRA approvato dalla FDA (23). Per questo test, le cellule mononucleate del sangue periferico (peripheral blood mononuclear cells, PBMC), vengono incubate con le sostanze di controllo o con due combinazioni di peptidi, una che copre l’intera sequenza aminoacidica di ESAT-6 e l’altra che copre l’intera sequenza aminoacidica di CFP10. Il test utilizza un enzyme-linked immunospot assay (ELISpot) per misurare l’aumento del numero di cellule che secernono IFN-γ (rappresentate come degli spot in ciascun pozzetto del test) dopo stimolazione antigenica specifica rispetto alla media di risposta nel controllo negativo (Nil). I criteri di interpretazione del T-Spot approvati dalla FDA per l’utilizzo negli Stati Uniti (24) differiscono da quelli applicati in altre nazioni (25). Inoltre la maggior parte degli studi pubblicati che hanno valutato il T-Spot hanno utilizzato criteri di interpretazione che differiscono da quelli approvati dalla FDA. I criteri interpretativi del T-Spot approvati dalla FDA nel 2008 (Tabella 3) comprendono una categoria di risultati borderline quando la risposta specifica tubercolare è pari a cinque, sei o sette spot. L’utilizzo di una categoria borderline potrebbe affrontare il problema della variabilità del test e dell’incertezza legata ai risultati prossimi al valore di cut-off dicotomico. Questo permetterebbe di incrementare l’apparente sensibilità e specificità del test, minimizzando i risultati falsamente positivi e falsamente negativi prossimi al valore di cut-off dicotomico. Inoltre, attraverso l’utilizzo di una categoria borderline, la conversione del test da negativo a positivo rappresenta più probabilmente una nuova infezione recentemente acquisita. Vol. 59 / RR-5 Recommendations and Reports Indicazioni approvate dalla FDA per l’utilizzo degli IGRA La FDA ha approvato sia il QFT-GIT sia il T-Spot come strumenti diagnostici in vitro per l’identificazione dell’infezione da M. tuberculosis (22,23). Entrambi i test sono approvati come test indiretti per la diagnosi di infezione da M. tuberculosis (compresa l’infezione nel caso di malattia attiva) se applicati congiuntamente ad una valutazione del rischio, ad indagini radiologiche e ad altre valutazioni mediche e diagnostiche. Le indicazioni approvate dalla FDA per il QFT-GIT e per il TSpot sono simili alle indicazioni relative al QFT-G e al TCT eseguito con PPD Tubersol (Sanofi Pasteur Ltd., Toronto, Ontario, Canada) o con PPD Aplisol (JHP Pharmaceuticals, LLC, Rochester, Michigan). Dal momento che ciascuno dei test (QFT-G, QFT-GIT, T-Spot e TCT) misura aspetti diversi della risposta immune ed utilizza antigeni e criteri di interpretazione differenti, i risultati dei test potrebbero non essere intercambiabili. Test differenti possono dare origine a risultati differenti. Valutazione della accuratezza, della specificità e della sensibilità dei test QFT-GIT e T-Spot Limiti nella valutazione della accuratezza Le valutazioni della accuratezza dei test per la diagnosi di infezione da M. tuberculosis sono gravate dai limiti legati alla mancanza di test di conferma per la diagnosi di LTBI e di tubercolosi attiva con esami colturali negativi. L’accuratezza è una misura della percentuale di risultati di un test che sono effettivamente corretti e tiene conto della valutazione della specificità (la percentuale di veri negativi che risultano negativi al test) e della sensibilità (la proporzione di veri positivi che risultano positivi al test). Le valutazioni di accuratezza dei test per l’infezione da M. tuberculosis sono difficoltose perché non esiste un “gold standard” per confermare la diagnosi di LTBI o di tubercolosi attiva con esami colturali negativi. Tuttavia, si possono derivare delle approssimazioni di accuratezza, sensibilità e specificità grazie allo studio della performance del test in popolazioni con caratteristiche note. Ad esempio, per valutare la sensibilità degli IGRA, i ricercatori possono verificare la proporzione di risultati positivi agli IGRA tra le persone affette da tubercolosi attiva confermata dagli esami colturali, nelle quali il test IGRA dovrebbe essere positivo (questi rappresentano i veri positivi). Analogamente, per valutare la specificità degli IGRA, i ricercatori possono verificare la proporzione di test IGRA negativi tra le persone che hanno una probabilità molto bassa di avere l’infezione da M. tuberculosis (cioè le persone che si presume siano negative). I ricercatori inoltre possono caratterizzare i fattori che sono associati a risultati discordanti tra test differenti o condurre studi di follow-up per determinare il futuro tasso di tubercolosi attiva tra le persone con risultati positivi o negativi ai test IGRA. Tuttavia, sebbene la sensibilità e la specificità siano caratteristiche inerenti ai test, in assenza di un “gold standard” le stime della performance dei test po- 5 trebbero variare in conseguenza delle differenze tra le popolazioni in studio e del tasso di misclassificazione diagnostica (ad esempio, in conseguenza di differenze nella prevalenza di infezione da M. tuberculosis e da micobatteri non-tubercolari, di malnutrizione e di immunodepressione). Inoltre, poiché il TCT e gli IGRA sono test indiretti che misurano le risposte immunologiche, e non test diretti che identificano il microrganismo causale o componenti del microrganismo, le valutazioni di sensibilità dei test attraverso l’analisi della loro performance tra gli individui affetti da tubercolosi attiva confermata dagli esami colturali, potrebbero non essere affidabili nel fornire stime circa la sensibilità degli stessi test nella LTBI. Le differenze immunologiche che favoriscono la progressione dell’infezione a malattia potrebbero influenzare i risultati dei test immunologici. Infine, un trattamento può alterare le risposte immunologiche e potrebbe influenzare i risultati dei test. Le stime di specificità in popolazioni a basso rischio sottostimano la specificità poiché alcuni individui potrebbero avere l’infezione a seguito di un’esposizione non riconosciuta. La valutazione dell’accuratezza dei test è ulteriormente complicata dall’utilizzo di differenti metodi e criteri di interpretazione di TCT, QFT-GIT e T-Spot negli studi pubblicati. La maggior parte dei lavori pubblicati che hanno valutato l’accuratezza di QFT-GIT e T-Spot (26-53) (Tabelle 4-7) hanno utilizzato criteri di interpretazione differenti da quelli approvati dalla FDA. Inoltre, negli studi pubblicati in cui i risultati degli IGRA sono stati confrontati con i risultati del TCT (27,28,31-41,43-45,49,50), gli antigeni del TCT ed i cut-off di diametro di infiltrato cutaneo utilizzati per definire la positività o meno del test differivano nei diversi studi. Inoltre, nella valutazione del QFT-GIT, alcuni autori hanno utilizzato metodi che non includevano l’utilizzo di un controllo positivo per il QFT-GIT (28,30). L’inclusione di un controllo positivo incrementa la stima della sensibilità, grazie all’esclusione dei risultati indeterminati per bassa risposta al mitogeno che altrimenti potrebbero essere interpretati come negativi. Ad esempio, se i campioni di sangue non vengono processati in maniera appropriata al punto che essi perdono la capacità di produrre IFN-γ e nello stesso tempo non viene utilizzato un controllo positivo, i risultati degli IGRA per questi campioni verrebbero interpretati come negativi. In presenza di un controllo positivo, essi verrebbero interpretati come indeterminati e pertanto non sarebbero inclusi nel calcolo della sensibilità (cioè essi verrebbero rimossi dal denominatore). Questo procedimento è analogo all’esclusione delle persone che non ritornano per la lettura del risultato del TCT quando si calcola la sensibilità stimata del TCT. L’incorporazione di una categoria borderline per l’interpretazione dei risultati del T-Spot, così come approvato dalla FDA, (Tabella 3) aumenta l’accuratezza del test, grazie alla classificazione dei risultati vicini al valore di cut-off (dove piccole variazioni possono influenzare l’interpretazione) né come negativi né come positivi. Sebbene non sia stata inclusa tra i criteri approvati dalla FDA per l’interpretazione del QFT-GIT (Tabella 2), l’introduzione di un’appropriata categoria borderline per il QFT-GIT potrebbe aumentare l’accuratezza del test per le stesse ragioni di cui sopra. Un’altra tattica per migliorare la sensibilità diagnostica fa ricorso all’utilizzo di qualsiasi risul- 6 MMWR tato positivo derivante da test multipli, così come succede nel caso degli esami colturali e dei test di amplificazione degli acidi nucleici. Interpretare qualsiasi risultato positivo derivante da test multipli come evidenza di infezione tipicamente incrementa la sensibilità diagnostica e riduce la specificità. D’altro canto, pretendere di avere risultati positivi da due o più test tipicamente genera l’effetto contrario (cioè riduce la sensibilità e aumenta la specificità). Sensibilità stimata I valori di sensibilità stimata per il QFT-GIT e per il T-Spot negli studi pubblicati (Tabelle 4 e 5) hanno avuto un’ampia variabilità; questi studi hanno prevalentemente coinvolto soggetti adulti affetti da tubercolosi attiva confermata dagli esami colturali. In generale, la sensibilità di QFT-GIT e T-Spot è considerata simile a quella del TCT. Tuttavia, è necessaria una certa cautela quando si confrontano i dati di sensibilità dei test che derivano da questi studi poiché 1) alcune cohorti non si limitavano ad individui affetti da tubercolosi attiva con conferma microbiologica (e pertanto potrebbero non aver avuto una tubercolosi attiva); 2) nella maggior parte degli studi non sono stati effettuati dei confronti diretti tra i due test IGRA negli stessi individui; e 3) i metodi ed i criteri di interpretazione dei test utilizzati negli studi pubblicati erano spesso differenti da quelli approvati dalla FDA. Quando i dati degli studi pubblicati relativi alla sensibilità del QFT-GIT nei pazienti affetti da tubercolosi attiva confermata dagli esami colturali (26-30,32,33,35,37-39) sono stati raggruppati (Tabella 4) e la sensibilità del test è stata determinata come il numero di individui con QFT-GIT positivo diviso per il numero di risultati positivi o negativi, la sensibilità complessiva del QFT-GIT risultava essere pari a 81%, rispetto al 70% riportato da uno studio che ha stimato la sensibilità sulla base di una meta-analisi (54). Negli studi che hanno confrontato la sensibilità del QTF-GIT con quella del TCT in pazienti affetti da tubercolosi attiva confermata dagli esami colturali (27,28,32,33,35,37-39) la sensibilità complessiva del QFT-GIT era pari a 83% e la sensibilità complessiva del TCT era pari a 89%. Tra gli 11 studi che hanno confrontato QFTGIT e TCT in pazienti in cui era stata diagnostica una tubercolosi attiva (non necessariamente confermata dagli esami colturali), sei studi (28,32,34,37-39) non hanno dimostrato una differenza statisticamente significativa tra i due test, tre studi (27,31,33) hanno dimostrato una maggiore sensibilità del TCT, e due studi (35,36) hanno dimostrato una maggiore sensibilità del QFT-GIT. Quando i dati degli studi pubblicati relativi alla sensibilità del T-Spot nei pazienti affetti da tubercolosi attiva confermata dagli esami colturali (28,33,38,42,46,48,50-52) sono stati raggruppati (Tabella 5) e la sensibilità del test è stata determinata come il numero di individui con T-Spot positivo diviso per il numero di risultati positivi o negativi, la sensibilità complessiva del T-Spot risultava essere pari a 91%. Negli studi che hanno confrontato la sensibilità del T-Spot con quella del TCT in pazienti affetti da tubercolosi confermata dagli esami colturali (28,33,38,39,50), la sensibilità complessiva del T-Spot risultava pari a 90% e la sensibilità del TCT pari a 89%. Tra i 12 studi che hanno confrontato la sensibilità di T- 25 Giugno 2010 Spot e TCT in pazienti con diagnosi di tubercolosi attiva (non necessariamente confermata dagli esami colturali), nove non hanno dimostrato una differenza statisticamente significativa tra i due test (28,31,33,38,39,43,44,49,50) e tre hanno dimostrato una maggiore sensibilità del T-Spot (39,40,44). In tre studi pubblicati che hanno valutato TCT, QFT-GIT e T-Spot (28,33,39), la sensibilità complessiva di TCT, T-Spot e QFT-GIT era rispettivamente pari a 95%, 91% e 84%. Il più grande di questi studi è stato condotto a Singapore e ha coinvolto più di 270 persone affette da tubercolosi attiva con conferma colturale (33). In questo studio, le sensibilità stimate di T-Spot e di TCT (utilizzando un cut-off di 10 mm) erano simili (rispettivamente 94% e 05%; p=0,84), e significativamente maggiori rispetto alla sensibilità del QFT-GIT (83%; p<0,01). Specificità stimata Ci si attende che il QFT-GIT e il T-Spot siano più specifici del TCT, poiché gli antigeni utilizzati in questi test sono relativamente specifici per M. tuberculosis e dovrebbero indurre un minor numero di test falsamente positivi (cioè, essi non dovrebbero produrre reazioni crociate in caso di sensibilizzazione da BCG o dalla maggior parte dei micobatteri non-tubercolari, come il M. avium complex). La specificità stimata per il QFTGIT e per il T-Spot nelle popolazioni analizzate, considerate a basso rischio di infezione da M. tuberculosis, è generalmente elevata (Tabelle 6 e 7). E’ richiesta una certa cautela quando si stima e si mette a confronto la specificità dei test che emerge da questi studi poiché 1) il background di rischio di infezione differisce nei diversi studi, 2) i metodi ed i criteri di interpretazione dei test utilizzati negli studi spesso sono diversi da quelli approvati dalla FDA, e 3) alcuni individui classificati come falsi positivi potrebbero avere un rischio di infezione non riconosciuto e quindi essere infettati. La maggior parte degli studi che hanno confrontato la specificità del QFT-GIT o del T-Spot con il TCT non sono stati condotti negli Stati Uniti. Nelle popolazioni analizzate rappresentate da persone con bassa probabilità di infezione da M. tuberculosis, la specificità complessiva del QFT-GIT era pari a 99% (Tabella 6) (26,28,32,34), e la specifcità complessiva del TCT in queste cohorti, quando disponibile, era pari a 85% (28,34). La specificità complessiva del T-Spot era pari a 88% (Tabella 7) (28,40,53), e la specifcità complessiva del TCT in queste cohorti, quando disponibile, era pari a 86% (28,40). A causa della ridotta dimensione del campione negli studi che hanno valutato la specificità del T-Spot, sono necessari ulteriori studi indipendenti al fine di migliorare l’accuratezza della specificità stimata per il T-Spot. La ridotta specificità stimata per il TCT rispetto al QFT-GIT e al T-Spot potrebbe essere da attribuire ai risultati falsi-positivi del TCT a seguito della vaccinazione con BCG o dell’esposizione a micobatteri non-tubercolari. Una ridotta stima della specificità del TCT è stata documentata in cohorti di soggetti vaccinati con BCG ed in soggetti affetti da linfadeniti non-tubercolari (28,55,56). Tuttavia, in uno studio in cui venivano confrontate cohorti con analoghi rischi di infezione, la specificità del test IGRA che utilizzava ESAT-6 e CFP-10 non era significativamente diversa tra soggetti vaccinati con BCG e soggetti non vaccinati (57). L’effetto Vol. 59 / RR-5 Recommendations and Reports del BCG sulla specificità è difficile da valutare, poiché il BCG è utilizzato prevalentemente in popolazioni che hanno anche un aumentato rischio di infezione da M. tuberculosis. Concordanza tra i test La concordanza tra i test per la diagnosi di infezione da M. tuberculosis varia ampiamente nei diversi studi (33,58-60). La concordanza riportata in questi studi è stata influenzata da vari fattori, quali i criteri di interpretazione, la prevalenza di infezione e la proporzione di infezioni che sono confermate dal punto di vista microbiologico, le stime di esposizione recente o remota, l’età, l’etnia, la pregressa vaccinazione con BCG, un recente TCT, patologie concomitanti, comprese le infezioni da micobatteri non-tubercolari e le condizioni di immunosoppressione (ad esempio, l’infezione da virus dell’immunodeficienza umana, HIV). L’età costituisce un rischio di infezione da M. tubercolosis, poiché maggiore è il tempo di possibile esposizione e poiché le persone più anziane potrebbero aver vissuto in un periodo in cui la tubercolosi era maggiormente prevalente. L’associazione tra età avanzata e risultati positivi al TCT e agli IGRA generalmente è attribuita ad infezioni cumulative nel tempo da M. tuberculosis. L’osservazione che emerge da alcuni studi, secondo la quale l’età avanzata è più strettamente associata ai risultati del TCT rispetto ai risultati degli IGRA, suggerisce che il TCT potrebbe essere più sensibile degli IGRA nell’evidenziare infezioni remote occorse diversi anni prima (58,61). Gli studi che hanno esaminato l’effetto dell’inoculazione del PPD sui successivi risultati degli IGRA hanno prodotto dati contrastanti (59,62-66); le differenze in termini di outcome probabilmente sono da attribuire a fattori quali differenze tra le popolazioni studiate (soggetti infettati versus soggetti non infettati, infezione recente versus infezione remota, e attuale rischio di esposizione), tempistica dell’esecuzione del test IGRA dopo l’inoculazione del PPD, formato del test IGRA, e definizione utilizzata dell’effetto boosting. Ci si dovrebbe attendere che l’inoculazione del PPD comporti un effetto boosting su quelle risposte immunologiche anamnestiche misurate da un test IGRA secondarie ad un’infezione da M. tuberculosis, ma non su quelle che derivano da una vaccinazione con BCG e neppure in soggetti non sensibilizzati. Sono necessari ulteriori studi che esaminino l’effetto dell’inoculazione del PPD sul rilascio di IFN-γ al fine di definire la frequenza, l’entità, il tempo di induzione e la durata dell’effetto boosting sugli IGRA a seguito dell’esecuzione di un TCT. Permane un certo livello di incertezza per quanto riguarda la riproducibilità dei risultati dei test IGRA nei singoli pazienti ed il significato clinico delle variazioni nelle misurazioni del rilascio di IFN-γ. Studi longitudinali hanno rivelato considerevoli fluttuazioni nel rilascio di IFN-γ in singoli pazienti sottoposti a test ripetuti (59,62,63,65,67-71). Queste fluttuazioni potrebbero essere attribuite a limiti nella precisione degli IGRA o ad effettive fluttuazioni nel rilascio di IFN-γ nel singolo paziente. Alcuni incrementi nel rilascio di IFN-γ potrebbero essere attribuiti ad una nuova infezione o ad un effetto boosting secondario all’esecuzione di un TCT. Alcune diminuzioni nel rilascio di IFN-γ in singoli soggetti potrebbero essere da attribuire ad un trattamento antimicobatterico. Tuttavia, le fluttuazioni delle risposte a rilascio di IFN-γ descritte negli studi longitudinali in 7 singoli individui dopo test ripetuti, rimangono perlopiù inspiegate ed aspecifiche. L’entità di queste fluttuazioni può essere tale da causare una variazione nell’interpretazione del test da negativo a positivo (conversione) o da positivo a negativo (regressione), soprattutto quando l’entità delle risposte a rilascio di IFN-γ sono prossime ai valori di cut-off che discriminano tra risultati positivi e negativi. Sono pertanto necessari studi ben controllati per definire ulteriormente la causa di variazioni individuali nel rilascio di IFN-γ e per sviluppare criteri per differenziare variazioni aspecifiche da variazioni associate ad infezione acquisita di recente o in via di risoluzione. Utilizzo dei test QFT-GIT e T-Spot nell’indagine dei contatti Diversi studi di indagine dei contatti hanno incluso i risultati dei test QFT-GIT e T-Spot (Tabella 8) (30,31,58,61,7274). In due di questi studi (58,73), maggiore era la probabilità di recente esposizione (misurata in termini di durata di esposizione o contagiosità del caso indice sulla base di un più elevato numero di bacilli alcool-acido resistenti nell’espettorato) e più stretta era l’associazione con la positività del test IGRA rispetto alla positività del TCT, suggerendo che i test IGRA potrebbero identificare un’infezione recente meglio del TCT. In questi studi, le persone con livelli inferiori di recente esposizione avevano una maggiore probabilità di essere positive al TCT rispetto al test IGRA, suggerendo che il TCT potrebbe essere migliore rispetto ai test IGRA nell’individuare un’infezione remota, che quindi non deriva dalla recente esposizione ma era già presente prima di questa (58). In altri due studi (72,74), né i risultati del TCT né quelli degli IGRA erano associati agli indici di recente esposizione. In un altro studio (30), la prossimità della recente esposizione (cioè, stessa stanza, stanze diverse o abitazioni diverse) era più strettamente associata ai risultati del TCT rispetto ai risultati del QFT-GIT. Valore dei test QFT-GIT e T-Spot nel predire una futura tubercolosi attiva L’abilità di un test di predire il rischio di futura tubercolosi attiva è di fondamentale importanza. Per una persona con un TCT positivo, il rischio di sviluppare tubercolosi attiva nell’arco della vita è stimato di circa 5-10% (16,75). Tuttavia, esistono pochissimi dati longitudinali sulla capacità degli IGRA di predire il rischio di successiva tubercolosi attiva. In uno studio condotto in Germania che ha coinvolto 601 contatti di persone affette da tubercolosi attiva con esame diretto positivo e confermata dagli esami colturali, veniva riportato che il QFT-GIT era in grado di predire meglio una futura tubercolosi attiva rispetto ad un TCT con un cut-off di 5 mm (76). Mentre cinque (2,3%) dei 219 contatti con infiltrato cutaneo del TCT ≥ 5 mm hanno sviluppato una tubercolosi attiva, 6 (14,6%) dei 41 contatti con risultato positivo del QFT-GIT hanno sviluppato la malattia (p=0,003). Tuttavia, un’insolita grande percentuale di contatti (59%) aveva un infiltrato cutaneo al TCT che era compreso tra 5 mm e 9 mm. Utilizzando un cut-off del TCT di 10 mm, la percentuale di soggetti considerati positivi al TCT che hanno sviluppato tubercolosi attiva (5 di 90 [5,6%]) era simile a quella del QFT-GIT (6 di 41 [14,6%]; 8 MMWR p=0,1). Inoltre, solo due dei sei contatti con risultati positivi al QFT-GIT che hanno sviluppato tubercolosi attiva avevano una diagnosi confermata dagli esami colturali. Come sottolineato in un editoriale pubblicato insieme all’articolo, la sensibilità nel predire una successiva tubercolosi attiva non era significativamente diversa tra i due test (77). La sensibilità del test QFTGIT era del 100% (intervallo di confidenza [IC] al 95% = 54%100%) e la sensibilità del TCT (utilizzando un cut-off di 5 mm o di 10 mm) era 83% (IC = 36%-100%) (p=0.50). I risultati di un altro studio indicavano che durante un follow-up attivo con una mediana di 19 mesi si era sviluppata una tubercolosi attiva in tre delle 36 (8,3%) persone con infezione da HIV che avevano un test QFT-GIT basale positivo, mentre in nessuna delle 705 persone con infezione da HIV con test QFT-GIT basale negativo (p<0,001) (37). Il TCT è stato eseguito solo in un sottogruppo di soggetti che avevano risultati positivi al QFT-GIT. Il TCT era positivo in tutti i soggetti testati che hanno sviluppato una tubercolosi attiva. In uno studio che ha coinvolto 339 immigrati in Olanda, era riportato che il TCT ed il QFT-GIT erano in grado di predire in maniera simile una successiva tubercolosi attiva (78). I contatti il cui TCT era ≥ 5 mm a 0 o a 3 mesi dopo la diagnosi del caso indice venivano seguiti per due anni. Nove (3,1%) dei 288 contatti con TCT ≥ 10 mm hanno sviluppato una tubercolosi attiva, mentre sette (3,8%) dei 184 contatti con TCT ≥ 15 mm, cinque (2,8%) dei 178 contatti con test QFT-GIT positivo, e sei (3,3%) dei 181 contatti con T-Spot positivi hanno sviluppato tubercolosi attiva. La percentuale di contatti con risultati positivi ai diversi test che hanno sviluppato tubercolosi attiva non era statisticamente differente. La sensibilità di predire una successiva tubercolosi attiva durante il periodo di follow-up era 100% per il TCT utilizzando un cut-off di 10 mm, 88% utilizzando un cut-off di 15 mm, 63% per il test QFT-GIT e 75% per il test T-Spot. Sebbene il TCT con un cut-off di 10 mm identificasse il maggior numero di contatti che svilupparono tubercolosi attiva (nove di nove [100%]), e il QFT-GIT identificasse il minor numero di contatti che svilupparono tubercolosi attiva (cinque di nove [63%]), la differenza nella sensibilità dei due test non era statisticamente significativa (p=0.08). Un altro studio di grandi dimensioni condotto in Gambia su una popolazione di contatti tubercolari familiari, ha utilizzato un test ELISpot sviluppato dagli autori, per misurare le risposte nei confronti di ESAT-6 e CFP-10. Il test ELISpot era positivo in 11 (52%) dei 21 casi secondari di tubercolosi attiva, rispetto a 14 (56%) dei 25 casi secondari che erano positivi al TCT (79). Dei 21 casi secondari a cui erano stati eseguiti entrambi i test, 15 (71%) erano positivi ad almeno uno dei test. Sebbene questa percentuale non fosse significativamente maggiore rispetto alla percentuale di positivi al solo TCT (56%; p=0,2), lo studio indicava che la positività ad uno dei test potrebbe essere la migliore indicazione per un trattamento preventivo in questo contesto. Sono necessari ulteriori studi di grandi dimensioni per stimare più accuratamente la performance degli IGRA rispetto al TCT. Utilizzo dei test QFT-GIT e T-Spot nei bambini La valutazione dell’accuratezza degli IGRA nella popolazione pediatrica è stata più difficoltosa rispetto ai soggetti adulti, poiché l’arruolamento negli studi è più complicato, nei bambi- 25 Giugno 2010 ni più piccoli la flebotomia è una procedura più indaginosa, è meno frequente avere una conferma microbiologica di infezione ed infine poiché la vaccinazione con BCG potrebbe essere stata praticata in tempi più recenti. Questo è particolarmente vero per bambini di età inferiore a 5 anni. Esistono quindi pochi dati riguardanti la performance dei test QFT-GIT e T-Spot nei bambini (in particolare in quelli di età inferiore a 5 anni). Per questa ragione, e poiché i tassi di progressione da infezione latente a malattia attiva (comprese le forme severe di malattia, quali meningite o malattia disseminata, o la morte per infezione da M. tuberculosis) sono più elevati nei neonati e nei bambini più piccoli, si deve raccomandare una certa cautela nell’utilizzo degli IGRA in bambini di età inferiore a 5 anni (80). Il più elevato tasso di tubercolosi attiva e di forme severe di malattia nei neonati e nei bambini di età inferiore 5 anni rispetto ai bambini più grandi suggerisce che la risposta immune all’infezione da M. tuberculosis è diversa in questi due gruppi. Differenze immunologiche legate all’età potrebbero spiegare le variazioni riportate nella performance degli IGRA, tra le quali una scarsa sensibilità dei test ed una ridotta produzione di IFN-γ in risposta agli antigeni micobatterici ed al mitogeno (utilizzato come controllo positivo) tra i bambini di età inferiore a 4 anni rispetto ai bambini di età compresa tra 4 e 15 anni (81), un’aumentata risposta al mitogeno all’aumentare dell’età (82), ed una maggiore percentuale di risultati indeterminati del QFT-GIT tra i bambini di età inferiore a 5 anni (43). Tuttavia, un grande studio condotto in una zona endemica per tubercolosi ha dimostrato che i neonati e i bambini più piccoli hanno robuste risposte con produzione di IFN-γ nei confronti di antigeni di M. tuberculosis, e queste risposte sono paragonabili a quelle misurate in soggetti adulti ed in bambini più grandi (83). I bambini più grandi (cioè quelli di età ≥ 5 anni) hanno una minore probabilità rispetto ai bambini di età inferiore a 5 anni di sviluppare tubercolosi attiva o di avere forme severe di malattia; sotto questo aspetto i bambini più grandi sono simili agli adulti. Inoltre, nei bambini più grandi l’esecuzione di un test IGRA può essere più semplice dal punto di vista logistico (ad esempio, per la possibilità di prelevare sufficienti quantità di sangue). Pertanto potrebbe essere richiesta una minore cautela per implementare gli IGRA in bambini di età ≥ 5 anni rispetto che nei bambini di età inferiore a 5 anni. L’utilizzo degli IGRA nella popolazione pediatrica è soggetto ad alcune limitazioni. In primo luogo, gli studi che hanno valutato la performance degli IGRA nei bambini sono scarsi. Solo in pochi studi vengono forniti risultati separati per quanto riguarda la popolazione pediatrica, ed in un numero ancora più limitato di studi i risultati vengono suddivisi per fasce d’età. Ciò significa che la performance degli IGRA nei bambini è stata molto meno chiarita rispetto alla performance dei test nella popolazione adulta. In secondo luogo, i risultati indeterminati nei bambini rappresentano un possibile limite all’introduzione dei test IGRA nella pratica clinica. Le frequenze di risultati indeterminati degli IGRA nella popolazione pediatrica variano considerevolmente nei diversi studi (range: 0-17%) e tra differenti formati dei test (31,39,43,84-89). Sebbene la maggioranza dei risultati indeterminati sia attribuibile ad una ridotta risposta al mitogeno, le ragioni perché vi sia una ridotta Vol. 59 / RR-5 Recommendations and Reports risposta al mitogeno nei bambini più piccoli non sono chiare. Il mitogeno potrebbe funzionare in maniera non ottimale nei bambini più piccoli, in conseguenza di una mancata maturità immunologica. Differenze nella concentrazione del mitogeno utilizzato per la stimolazione e differenze nei criteri di interpretazione possono influenzare il numero di risultati indeterminati, soprattutto quando vengono confrontati formati diversi dei test IGRA. Inoltre, persistono delle perplessità riguardanti le difficoltà a raccogliere campioni di sangue adeguati per questi test e circa la necessità di ottenere volumi di sangue relativamente grandi in bambini così piccoli (soprattutto nei neonati). Infine, alcuni pediatri hanno espresso il timore che nei bambini gli IGRA potrebbero avere una sensibilità inferiore rispetto al TCT (81,90,91). In generale, si suppone che la sensibilità degli IGRA nella popolazione pediatrica sia paragonabile a quella del TCT. In uno studio che ha coinvolto 28 bambini di età compresa tra 4 mesi e 7 anni, affetti da tubercolosi attiva confermata dagli esami colturali, le stime di sensibilità di TCT, QFT-GIT e T-Spot erano paragonabili ed erano rispettivamente 100%, 93% e 93% (p=0,15) (28). La sensibilità di questi test era simile anche in un altro studio su nove bambini affetti da tubercolosi attiva; sei (67%) erano positivi al T-Spot, sei (67%) erano positivi a QFTGIT e nove (100%) erano positivi al TCT (31). In un altro studio che ha coinvolto 25 bambini affetti da tubercolosi attiva confermata dagli esami colturali, la sensibilità stimata era 88% per il TCT con cut-off di 10 mm e 83% con cut-off di 15 mm, 80% per il QFT-GIT e 58% per il T-Spot (39). In questo stesso studio, se venivano inclusi i bambini con probabile tubercolosi attiva (definita sulla base dei dati epidemiologici, clinici e radiologici in assenza di positività degli esami colturali), la sensibilità del TCT con un cut-off di 10 mm si riduceva a 71%, con un cut-off di 15 mm si riduceva a 60%, e la sensibilità di QFT-GIT e T-Spot scendeva rispettivamente a 64% e 50%. Tuttavia, i metodi utilizzati per fare diagnosi di tubercolosi attiva in questo studio non venivano esplicitamente dichiarati e potrebbero aver tenuto conto dei risultati del TCT. I risultati di un altro studio che ha valutato 154 bambini di età compresa tra 5 e 15 anni, affetti da tubercolosi attiva con conferma colturale, indicavano che il TCT era più sensibile del QFT-GIT (rispettivamente, 90% e 76%; p<0,01) (27). In generale, si suppone che la specificità degli IGRA nella popolazione pediatrica sia elevata. Ad esempio, il QFT-GIT ed il T-Spot hanno dimostrato di avere un’elevata specificità per l’infezione da M. tuberculosis anche tra i bambini in cui la specificità del TCT era ridotta al 22% a causa di infezioni da micobatteri non-tubercolari (28). Sono necessari ulteriori studi di più grandi dimensioni per valutare la performance degli IGRA nella popolazione pediatrica. Utilizzo dei test QFT-GIT e T-Spot nei soggetti immunodepressi Sono disponibili dati limitati per quello che riguarda l’utilizzo del QFT-GIT nei soggetti immunodepressi (Tabella 9) (27,36,37,92-100). In due studi su un totale di 34 soggetti con infezione da HIV e tubercolosi attiva confermata dagli esami 9 colturali, la sensibilità del QFT-GIT era pari a 81% e 88% (27,37). In uno dei due studi, la sensibilità del QFT-GIT e del TCT era simile (rispettivamente 81% e 85%, p>0,99) (27). La sensibilità del QFT-GIT non era significativamente diversa tra le persone con infezione da HIV rispetto alle persone senza infezione da HIV (rispettivamente 81% e 73%; p=0,59). In un altro studio condotto in Zambia, che ha coinvolto 112 persone (59 con infezione da HIV, 37 senza infezione da HIV e 16 in cui il test per l’HIV non era stato eseguito), alle quali era stata diagnosticata una tubercolosi attiva sulla base della positività dell’esame diretto dell’escreato (36), il QFT-GIT ed il TCT erano significativamente meno sensibili nei soggetti con infezione da HIV rispetto alle persone senza infezione da HIV (76% rispetto a 97% per il QFT-GIT, p=0,02 e 55% rispetto a 81% per il TCT, p=0,04). Tra le persone con infezione da HIV, la sensibilità del QFT-GIT tendeva ad essere maggiore rispetto alla sensibilità del TCT (rispettivamente 76% e 55%; p=0,06). Tuttavia in questo studio, la ridotta sensibilità del TCT potrebbe essere derivata dalla ritardata lettura del TCT, che è stato letto a 48-164 ore dall’inoculazione del PPD. Bassi livelli di CD4 erano associati con un aumento di risultati falsamente negativi al TCT e di risultati indeterminati e falsamente negativi al test QFT-GIT. Tra i soggetti con infezione da HIV sottoposti a screening per infezione da M. tuberculosis, i dati pubblicati sul confronto tra i test non hanno dimostrato differenze significative nella percentuale di risultati positivi al QFT-GIT rispetto alla percentuale di risultati positivi al TCT (93-96). I risultati del QFTGIT di due studi suggeriscono che la percentuale di risultati indeterminati del QFT-GIT tra i soggetti con infezione da HIV (rispettivamente 17% e 19%) è simile alla percentuale che si osserva in soggetti non infettati (rispettivamente 14% e 0; p=0,88 e p=0,18) (27,36). Tuttavia, in un altro studio su soggetti con infezione da HIV, i livelli di CD4 risultavano inferiori nei soggetti avevano risultati indeterminati al QFT-GIT, rispetto a quelli che avevano risultati positivi o negativi (p<0,01) (37). Per quello che riguarda persone affette da altre condizioni di immunodepressione, i dati pubblicati sul confronto tra i test non mostrano una consistente concordanza tra i risultati del QFT-GIT e quelli del TCT (97-100). In assenza di un “gold standard” per la diagnosi di LTBI, l’accuratezza sia del QFT-GIT che del TCT rimane incerta. Informazioni riguardanti l’utilizzo del T-Spot in soggetti immunodepressi sono state fornite solo da relativamente pochi studi pubblicati (Tabella 10) (60,96,97,101-108), con pochissime informazioni relative alla sensibilità del test in questi soggetti (Tabella 5). Per quanto riguarda soggetti affetti da varie condizioni di immunodepressione sottoposti a screening per infezione da M. tuberculosis, i dati pubblicati sul confronto tra T-Spot e TCT in linea generale dimostrano o una percentuale simile di risultati positivi nei due test (60,96,97,101,104,108) o che il T-Spot è più frequentemente positivo (103,105-107). In assenza di un “gold standard” per la diagnosi di LTBI, l’accuratezza sia del TCT che del T-Spot è sospetta. Considerazioni grammatici per interventi pro- A causa delle difficoltà logistiche ed amministrative associate all’esecuzione del TCT, gli IGRA rappresentano attraenti ausili diagnostici per fare diagnosi di infezione da M. tuberculosis. 10 MMWR Diversamente dal TCT, i risultati degli IGRA possono essere disponibili entro 24 ore senza necessitare di una seconda visita. Poiché si tratta di test di laboratorio, gli IGRA non risentono dei bias e degli errori associati all’esecuzione e alla lettura del TCT. Tuttavia, errori nella raccolta, nell’assegnazione o nel trasporto dei campioni di sangue, o errori che occorrono durante l’esecuzione e l’interpretazione di questi test, possono ridurre l’accuratezza degli IGRA. Inoltre, la disponibilità degli IGRA è condizionata dalla necessità di avere campioni di sangue fresco e dalla possibilità di ritardi legati a lunghe distanze tra le strutture sanitarie cui i pazienti afferiscono e la sede in cui si trovano i laboratori che sono in grado di offrire questi test. Il costo di un test IGRA è sostanzialmente superiore rispetto a quello del TCT (109). Tuttavia, questo costo supplementare potrebbe essere compensato dalla diminuzione del numero di persone che risultano positive al test e di conseguenza dalla riduzione dei costi associati alla valutazione ed al trattamento delle persone con risultati positivi al test (110). L’utilizzo di un IGRA potrebbe aumentare l’accettabilità di un trattamento per LTBI (111). Tuttavia, gli studi di costo efficacia sono condizionati dalla mancata disponibilità di dati critici riguardanti la relativa capacità di questi test di predire una futura tubercolosi attiva. Raccomandazioni Raccomandazioni generali per l’utilizzo degli IGRA · Il TCT e gli IGRA (QFT-G, QFT-GIT e T-Spot) dovrebbero essere utilizzati come ausili per la diagnosi di infezione da M. tuberculosis. Questi test possono essere utilizzati per scopi di sorveglianza sanitaria o per identificare persone che hanno probabilità di trarre beneficio da un trattamento, comprese le persone che sono o saranno ad aumentato rischio di infezione da M. tuberculosis (Box 1) o di progressione a tubercolosi attiva se infettate (Box 2). · Gli IGRA dovrebbero essere eseguiti ed interpretati secondo protocolli prestabiliti, utilizzando le versioni dei test approvate dalla FDA. Essi dovrebbero essere eseguiti in conformità agli standard del Clinical Laboratory Improvement Amendment (CLIA). · Dovrebbero essere riportati sia l’interpretazione qualitativa standard del risultato del test sia i dati quantitativi dei valori misurati, insieme ai criteri utilizzati per l’interpretazione del test. Questo permetterà una valutazione più raffinata dei risultati e promuoverà la comprensione dei test. · L’esecuzione del test IGRA dovrebbe essere predisposta prima della raccolta del campione di sangue, al fine di assicurare che i campioni di sangue siano raccolti nelle provette appropriate e che il test possa essere eseguito nei tempi consoni. · Prima di implementare l’utilizzo degli IGRA, ciascun istituto ed ogni programma per il controllo della tubercolosi dovrebbe valutare la disponibilità, i costi complessivi ed i benefici degli IGRA nell’ambito del proprio contesto operativo. Inoltre, gli interventi pro- 25 Giugno 2010 grammatici dovrebbero considerare le caratteristiche della popolazione che deve essere testata. · Analogamente a quanto si applica al TCT, gli IGRA in generale non dovrebbero essere utilizzati per testare persone che hanno un basso rischio sia di infezione sia di progressione a tubercolosi attiva se infettate (ad eccezione di quelle persone che hanno una probabilità di aumentato rischio in futuro). Lo screening di questi soggetti sottrae risorse da attività a maggiore priorità ed aumenta il numero di risultati falsamente positivi. Anche con un test la cui specificità è prossima al 99%, quando la prevalenza di infezione da M. tuberculosis è ≤ 1%, la maggior parte dei risultati positivi saranno falsi positivi. Se si devono sottoporre al test le persone a basso rischio sia di infezione che di progressione, la scelta di un test con la più alta specificità minimizzerà i risultati falsamente positivi, ridurrà il numero di indagini e trattamenti non necessari, e minimizzerà la possibilità di eventi avversi derivanti da trattamenti non necessari. Scelta del test · La scelta del test più adeguato o della combinazione di test per la diagnosi di infezione da M. tubercolosis dovrebbe essere basata sulle ragioni e sul contesto in cui il test viene eseguito, sulla disponibilità dei test e su una valutazione complessiva di costo-efficacia del test. Le conclusioni degli studi che hanno esaminato la sensibilità, la specificità e la concordanza degli IGRA e del TCT non sono univoche nell’affermare quale test sia migliore. Sebbene i dati sull’accuratezza degli IGRA e sulla loro capacità di predire una futura tubercolosi attiva siano limitati, ad oggi, studi che sono stati condotti in varie popolazioni, non hanno riportato gravi carenze dei test. Con l’aumentare dell’utilizzo di questi test, si otterrà una maggiore comprensione del loro valore e dei loro limiti. · Un test IGRA può essere utilizzato al posto di (e non in aggiunta a) un TCT in tutte le condizioni per le quali i CDC raccomandano di eseguire un test cutaneo tubercolinico quale ausilio nella diagnosi di infezione da M. tuberculosis, tenendo conto delle preferenze e delle considerazioni speciali riportate di seguito. In queste circostanze, nonostante l’indicazione di preferenza, l’utilizzo del test alternativo (IGRA approvato dalla FDA o TCT) è da considerarsi un’accettabile pratica medica o di sanità pubblica. Situazioni in cui un IGRA è preferibile ma un TCT è accettabile · È preferibile utilizzare un IGRA per testare persone che appartengono a gruppi che storicamente hanno basse percentuali di ritorno per la lettura del risultato del TCT. Ad esempio, l’utilizzo di un test IGRA potrebbe incrementare i tassi di completamento del test nelle persone senza fissa dimora e nei soggetti che fanno uso di sostanze stupefacenti. L’utilizzo degli IGRA in questi soggetti può migliorare i tassi di completamento del test, in modo tale che gli sforzi dei programmi di controllo possano essere Vol. 59 / RR-5 Recommendations and Reports focalizzati su quei soggetti che hanno maggiore probabilità di beneficiare di ulteriori indagini e di un trattamento. · È preferibile un IGRA per testare persone cui è stato somministrato il BCG (come vaccino o come terapia antineoplastica). Si presume che l’utilizzo degli IGRA in questa popolazione aumenti la specificità diagnostica e migliori l’accettabilità di un trattamento per LTBI. Situazioni in cui un TCT è preferibile ma un IGRA è accettabile · È preferibile l’utilizzo di un TCT nei bambini di età inferiore a 5 anni. Alcuni esperti hanno avanzato il suggerimento di utilizzare un IGRA in associazione al TCT per aumentare la sensibilità diagnostica in questa fascia d’età. Raccomandazioni riguardanti l’utilizzo degli IGRA nella popolazione pediatrica sono state pubblicate anche dalla American Academy of Pediatrics (112). Situazioni in cui possono essere utilizzati indifferentemente un TCT o un IGRA · È possibile utilizzare indifferentemente un IGRA o un TCT nel caso di contatti recenti di persone con tubercolosi attiva accertata o sospetta, con considerazioni particolari per quello che riguarda i test di follow-up. Gli IGRA offrono la possibilità di individuare l’infezione da M. tuberculosis con maggiore specificità rispetto al TCT. Inoltre, contrariamente al TCT, gli IGRA non comportano un effetto boosting nei risultati di test successivi e possono essere eseguiti in occasione di una singola visita. Tuttavia, i dati riguardanti la capacità degli IGRA di predire una futura tubercolosi attiva sono limitati. Se gli IGRA devono essere utilizzati nello screening dei contatti, risultati negativi ottenuti prima di 8 settimane dal termine dell’esposizione tipicamente dovrebbero essere confermati tramite la ripetizione del test a 8-10 settimane dal termine dell’esposizione. Questa raccomandazione è simile a quella utilizzata per il TCT, poiché al momento non sono disponibili dati riguardanti il tempo necessario affinché si verifichi la conversione di un test IGRA a seguito di una nuova infezione. L’utilizzo dello stesso formato per la ripetizione del test minimizzerà il numero di conversioni che avvengono come effetto di differenze tra i test. · È possibile utilizzare indifferentemente un IGRA o un TCT per lo screening periodico delle persone che potrebbero avere un’esposizione occupazionale a M. tuberculosis (ad esempio, nei programmi di sorveglianza per gli operatori sanitari), con considerazioni speciali per quanto riguarda conversioni e regressioni dei test. Per quanto riguarda lo screening periodico e seriale, gli IGRA offrono vantaggi tecnici, logistici e potenzialmente anche economici rispetto al TCT, ma hanno anche possibili svantaggi. I vantaggi comprendono la possibilità di avere risultati dopo una singola visita. Per gli IGRA non è richiesto un approccio a due step, poiché gli IGRA non comportano 11 un effetto boosting nei risultati di test successivi. In questo contesto, gli svantaggi degli IGRA sono rappresentati da un maggior rischio di conversione del test a causa di risultati falsi positivi degli IGRA al test di follow-up, in operatori sanitari a basso rischio che avevano un test precedente negativo. I CDC hanno pubblicato i criteri per definire le conversioni del TCT e degli IGRA (113). La conversione di un TCT è definita come una variazione da negativo a positivo con un aumento del diametro dell’infiltrato ≥ 10 mm entro 2 anni. La conversione di un TCT è associata ad un aumentato rischio di tubercolosi attiva. La conversione di un test IGRA è definita come una variazione da negativo a positivo entro 2 anni, senza alcuna considerazione per quanto riguarda l’entità della variazione della risposta specifica agli antigeni tubercolari. L’utilizzo di questo criterio piuttosto indulgente per definire la conversione di un test IGRA potrebbe comportare un maggior numero di conversioni rispetto a quelle che si osservano con i criteri più stringenti applicati al TCT. Inoltre, non è stata dimostrata un’associazione tra conversione di un test IGRA e successivo rischio di malattia attiva. I criteri per interpretare le variazioni di un test IGRA che identifichino nuove infezioni rimangono incerti. I CDC incoraggiano ciascuna istituzione ed i programmi di controllo in cui si utilizzano gli IGRA a pubblicare i risultati delle loro esperienze, in particolare per quanto riguarda i tassi di conversione, regressione e progressione a tubercolosi attiva nel tempo. Situazioni in cui si debba considerare di utilizzare sia un IGRA che un TCT · Sebbene non venga generalmente raccomandato di utilizzare in maniera routinaria sia un TCT che un IGRA, risultati di entrambi i test potrebbero essere utili quando il test iniziale (TCT o IGRA) è negativo nelle seguenti situazioni: 1) quando il rischio di infezione, il rischio di progressione ed il rischio di esito infausto sono aumentati (ad esempio, quando le persone con infezione da HIV o i bambini di età inferiore a 5 anni hanno un aumentato rischio di infezione da M. tuberculosis) o 2) quando esiste il sospetto clinico di tubercolosi attiva (ad esempio in persone con sintomi, segni e/o alterazioni radiologiche suggestivi di tubercolosi attiva) ed è auspicabile poter confermare la presenza di infezione da M. tuberculosis. In tali pazienti in cui un test iniziale è negativo, poter disporre di un risultato positivo di un secondo test, quale dimostrazione di infezione, consente di aumentare la sensibilità diagnostica. Tuttavia, multipli risultati negativi derivanti da qualsiasi combinazione di test non possono consentire di escludere un’infezione da M. tuberculosis. · L’utilizzo sia di un TCT che di un test IGRA potrebbe essere utile anche quando il test iniziale sia positivo nelle seguenti situazioni: 1) quando sia necessario avere ulteriori dimostrazioni di infezione per promuovere la compliance (ad esempio, negli operatori sanitari nati all’estero che pensano che la loro positività del TCT sia da attribuire alla vaccinazione con BCG) o 2) in persone 12 MMWR sane che hanno un basso rischio di infezione e progressione. Nel primo caso, un test IGRA positivo potrebbe incentivare maggiormente l’accettazione di un trattamento per LTBI rispetto al solo risultato di un TCT positivo. Nel secondo caso, ricercare un risultato positivo in un secondo test come evidenza di infezione aumenta la probabilità che il risultato del test rifletta una reale condizione di infezione. In quest’ultimo caso, l’alternativa sarebbe di assumere, in assenza di un ulteriore test, che il risultato iniziale è un falso positivo o che il rischio di malattia non giustifica l’esecuzione di ulteriori indagini o un trattamento, indipendentemente dai risultati dei test. Per minimizzare l’esecuzione di test non necessari e fuorvianti in persone a basso rischio, dovrebbe essere adottato un approccio a step successivi. · La ripetizione di un test IGRA o l’esecuzione di un TCT potrebbe essere utile quando il risultato iniziale di un IGRA è indeterminato, borderline o non valido e permane una giustificazione all’esecuzione di un test. Un secondo test inoltre potrebbe essere utile quando i valori misurati in un primo test sono anomali, ad esempio quando il valore del Nil è più elevato rispetto a quanto normalmente osservato nella popolazione oggetto del test (ad esempio, una concentrazione di IFN-γ nel Nil del QFT-G o del QFT-GIT >0,7 UI/ml per la maggior parte della popolazione degli Stati Uniti), il valore del Nil è sensibilmente superiore rispetto ai valori ottenuti nella stimolazione con gli antigeni specifici per M. tuberculosis (ad esempio, quando la concentrazione di IFN-γ nel Nil del QFT-G è di 0,35 UI/ml superiore rispetto alla concentrazione ottenuta con la stimolazione con ESAT6 o CFP-10, oppure quando il numero di spot nel Nil del T-Spot è superiore di quattro spot al numero di spot ottenuti con la stimolazione con ESAT-6 o con CFP-10), oppure il valore del mitogeno è inferiore a quanto atteso per la popolazione testata (ad esempio, la risposta al mitogeno del QFT-G o del QFT-GIT è < 0,5 UI/ml, o il numero di spot nel pozzetto stimolato con il mitogeno del T-Spot è < 20). Se si deve ripetere un test IGRA, dovrebbe essere utilizzato un nuovo campione di sangue. In tali situazioni, la ripetizione del test su un nuovo campione di sangue solitamente fornisce risultati interpretabili. Gestione clinica dopo l’esecuzione di un test · Le diagnosi di infezione da M. tuberculosis e le decisioni riguardo alla gestione medica o in ambito di sanità pubblica non dovrebbero essere basate unicamente sui risultati di un test IGRA o di un TCT, ma dovrebbero tenere conto dell’epidemiologia e dell’anamnesi, così come anche di eventuali altre informazioni cliniche. · Nelle persone che hanno un TCT o un test IGRA positivo, dovrebbero essere valutati la probabilità di infezione da M. tuberculosis, i rischi di progressione a tubercolosi attiva in caso di infezione, e gli eventuali sintomi e segni suggestivi di tubercolosi attiva. Se sono presenti rischi, sintomi e segni di malattia attiva, è indicato procedere ad 25 Giugno 2010 ulteriori indagini per determinare se il paziente ha una LTBI o una tubercolosi attiva. · Una diagnosi di LTBI richiede che venga esclusa la presenza di tubercolosi attiva attraverso una valutazione clinica, che dovrebbe includere la raccolta dell’anamnesi e l’esecuzione dell’esame obiettivo per evidenziare segni e sintomi suggestivi, una radiografia del torace e, quando indicato, esami microbiologici su espettorato o altri campioni biologici per escludere la presenza di M. tuberculosis. Né un IGRA né un TCT può consentire di distinguere tra LTBI e tubercolosi attiva. · Nelle persone che hanno sintomi, segni o alterazioni radiologiche suggestivi di tubercolosi attiva o che sono ad aumentato rischio di progressione a tubercolosi attiva in caso di infezione, un risultato positivo di un IGRA o di un TCT dovrebbe essere considerato come evidenza di infezione da M. tuberculosis. Tuttavia, risultati negativi dell’IGRA o del TCT non sono sufficienti ad escludere l’infezione in questi soggetti, soprattutto in coloro che hanno un aumentato rischio di prognosi infausta in caso di sviluppo di malattia attiva; pertanto sarà il giudizio clinico a determinare quando e se saranno necessarie ulteriori indagini diagnostiche e terapie. · Nelle persone sane che hanno una bassa probabilità di infezione da M. tuberculosis e di progressione a tubercolosi attiva in caso di infezione, un singolo risultato positivo di un IGRA o di un TCT non dovrebbe essere considerato come prova attendibile di infezione da M. tuberculosis. Infatti è più probabile che si tratti di un risultato falsamente positivo, a causa della bassa probabilità di infezione. In queste circostanze, si dovrebbe rivalutare la probabilità di infezione da M. tuberculosis e di progressione a malattia attiva, ed il risultato del test iniziale dovrebbe essere confermato. In ogni singolo caso andrà presa in considerazione la necessità di ripetere un test, utilizzando o il test iniziale o un test diverso. Per questi soggetti, l’alternativa è quella di assumere, senza effettuare ulteriori indagini, che il risultato iniziale sia un falso positivo. · Nelle persone con risultati dei test discordanti (cioè uno positivo ed un altro negativo), le decisioni relative alla gestione clinica o in ambito di sanità pubblica si devono basare su una valutazione individualizzata nel singolo caso della qualità e dell’entità del risultato del test (ad esempio, il diametro dell’infiltrato o la presenza di un’ulcera cutanea per il TCT; oppure i valori assoluti della risposta specifica tubercolare, del Nil e della risposta al mitogeno per un test IGRA), della probabilità di infezione, del rischio di malattia in caso di infezione, e del rischio di outcome sfavorevole in caso di sviluppo di tubercolosi attiva. - È ragionevole considerare un risultato positivo di uno dei test come evidenza di infezione quando 1) esiste il sospetto clinico di tubercolosi attiva (ad esempio, nelle persone che hanno sintomi, segni e/o alterazioni radiologiche suggestivi di tubercolosi attiva) o 2) i rischi di infezione, progressione e outcome sfavorevole sono aumentati (ad esempio, in persone con infezione da HIV o in bambini di età Vol. 59 / RR-5 - - - Recommendations and Reports inferiore a 5 anni che hanno un aumentato rischio di infezione da M. tuberculosis). In persone sane che hanno un basso rischio sia di infezione che di progressione, è ragionevole considerare come falso positivo un risultato positivo isolato. Questo aumenterà la specificità diagnostica e ridurrà il numero di trattamenti non necessari. Per le persone cui è stato somministrato il BCG e che non hanno un aumentato rischio di prognosi sfavorevole in caso di infezione (Box 2), risultati del TCT di diametro inferiore a 15 mm possono essere ragionevolmente considerati falsi positivi, quando un IGRA è chiaramente negativo. Nelle altre situazioni, non esistono evidenze adeguate su cui basare delle raccomandazioni per la gestione di risultati discordanti. Tuttavia, in assenza di un’evidenza convincente di infezione, le decisioni diagnostiche possono essere ragionevolmente differite a meno che sussistano condizioni di aumentato rischio di progressione in caso di infezione e/o di aumentato rischio di prognosi sfavorevole in caso di comparsa di malattia attiva. Aree di ulteriore ricerca Sebbene siano stati compiuti sostanziali progressi per dimostrare l’utilità degli IGRA, sono necessari ulteriori studi e progetti di ricerca. Gli studi futuri dovrebbero focalizzarsi sulla dimostrazione del valore e dei limiti degli IGRA in situazioni di particolare rilevanza nell’ambito della cura della tubercolosi e dei programmi di controllo. Le domande che tuttora necessitano di risposta sono le seguenti (elencate senza alcun ordine di priorità): · Gli IGRA predicono meglio del TCT una futura tubercolosi attiva? · Le persone con risultati discordanti di TCT e IGRA hanno un aumentato rischio di sviluppare tubercolosi attiva rispetto alle persone con risultati concordanti negativi? · Risposte caratterizzate da maggiori concentrazioni di IFN-γ sono associate ad un maggior rischio di sviluppare tubercolosi attiva? · Gli IGRA hanno performance diversa nei bambini in confronto agli adulti, in soggetti con tubercolosi extrapolmonare rispetto a quelli con tubercolosi polmonare, in persone con infezione da HIV rispetto a quelle senza infezione da HIV, in soggetti con infezione recente rispetto a soggetti con infezione acquisita anni prima, e in soggetti con infezione latente rispetto a pazienti con tubercolosi attiva? · Perché TCT, QFT-GIT, QFT-G e T-Spot eseguiti simultaneamente producono risultati differenti? · La sensibilità e la specificità degli IGRA possono essere migliorate da modifiche nella metodologia dei test, dall’adozione di criteri di interpretazione diversi o dall’aggiunta di ulteriori antigeni? · Qual è il migliore approccio per determinare i livelli di cut off per l’interpretazione degli IGRA, incluse situazioni in cui i valori del Nil sono elevati o i valori del mitoge- 13 no sono bassi? · In che misura l’introduzione di un’interpretazione “borderline” migliora l’accuratezza degli IGRA? · Che cosa causa variazioni dei risultati degli IGRA ed in che misura? · Qual è l’entità della variazione di produzione di IFN-γ che può essere suggestiva di una nuova infezione? · Qual è il significato clinico delle regressioni degli IGRA? · Quali metodi dovrebbero essere utilizzati per monitorare la qualità degli IGRA? · Esiste un’associazione tra conta linfocitaria e produzione di IFN-γ (in presenza o in assenza di infezione da HIV)? · Quali effetti produce un trattamento dell’infezione da M. tuberculosis sui risultati degli IGRA? · In che modo fattori genetici del microrganismo o dell’ospite interferiscono con i risultati degli IGRA? Bibliografia 1. American Thoracic Society, CDC. Diagnostic standards and classification of tuberculosis in adults and children. Am J Respir Crit Care Med 2000;161:1376–95. 2. Rothel JS, Jones SL, Corner LA, Cox JC, Wood PR. A sandwich enzyme immunoassay for bovine interferon-gamma and its use for the detection of tuberculosis in cattle. Aust Vet J 1990:67;134–7. 3. Converse PJ, Jones SL, Astemborski J, Vlahov D, Graham NM. Comparison of a tuberculin interferon-gamma assay with the tuberculin skin test in high-risk adults: effect of human immunodeficiency virus infection. J Infect Dis 1997;176:144–150. 4. Streeton JA, Desem N, Jones SL. Sensitivity and specificity of a gamma interferon blood test for tuberculosis infection. Int J Tuberc Lung Dis 1998;2:443– 50. 5. Food and Drug Administration. QuantiFERON-TB - P010033. Available at http://www.fda.gov/MedicalDevices/ProductsandMedicalProcedures/ DeviceApprovalsandClearances/Recently-ApprovedDevices/ ucm084025.htm. Accessed June 16, 2010. 6. Mazurek GH, Villarino ME. Guidelines for using the QuantiFERON-TB test for diagnosing latent Mycobacterium tuberculosis infection. MMWR 2003;52(No. RR-2):15–8. 7. Food and Drug Administration. QuantiFERON-TB Gold - P010033/S006. Available at http://www.fda.gov/MedicalDevices/ ProductsandMedicalProcedures/DeviceApprovalsandClearances/ PMAApprovals/ucm110838.htm. Accessed June 16, 2010. 8. CDC. Guidelines for using the QuantiFERON-TB Gold test for detecting Mycobacterium tuberculosis infection, United States. MMWR 2005;54:(No. RR-15):49–55. 9. World Health Organization. Global tuberculosis control: epidemiology, strategy, financing: WHO report 2009. Geneva, Switzerland: World Health Organization; 2009. Available at http://www.who.int/tb/publi-cations/global_report/2009/pdf/report_without_annexes.pdf. Accessed June 16, 2010. 10. CDC. Reported tuberculosis in the United States, 2008. Atlanta, GA: U.S. Department of Health and Human Services, CDC; 2009. 11. Bennett DE, Courval JM, Onorato I, et al. Prevalence of tuberculosis infection in the United States population: the national health and nutrition examination survey, 1999–2000. Am J Respir Crit Care Med 2008;177:348–55. 12. CDC. Targeted tuberculin testing and treatment of latent tuberculosis infection. MMWR 2000;49:(No. RR-6). 13. Edwards PQ, Edwards LB. Story of the tuberculin skin test from an epidemiologic viewpoint. Am Rev Respir Dis 1960;81:1–47. 14. Antonucci G, Girardi E, Raviglione MC, Ippolito G. Risk factors for tuberculosis in HIV-infected persons. JAMA 1995;274:143–8. 15. Selwyn PA, Hartel D, Lewis VA, et al. A prospective study of the risk of tuberculosis among intravenous drug users with human immunode-ficiency virus infection. N Engl J Med 1989;320:545–50. 16. Horsburgh CR, Jr. Priorities for the treatment of latent tuberculosis infection in the United States. N Engl J Med 2004;350:2060–7. 17. Judson FN, Feldman RA. Mycobacterial skin tests in humans 12 years after infection with Mycobacterium marinum. Am Rev Respir Dis 1974;109:544–7. 14 MMWR 18. Snider DE Jr. Bacille Calmette-Guerin vaccinations and tuberculin skin tests. JAMA 1985;253:3438–39. 19. Mazurek GH, Weis SE, Moonan PK, et al. Prospective comparison of tuberculin skin test and two whole blood interferon-gamma release assays in tuberculosis suspects. Clin Infect Dis 2007;45:837–45. 20. Andersen P, Munk ME, Pollock JM, Doherty TM. Specific immune-based diagnosis of tuberculosis. Lancet 2000;356:1099–104. 21. Cellestis Limited. QuantiFERON-TB Gold [Package insert]. Available at http://www.cellestis.com/IRM/Company/ShowPage.aspx?CPID=1247. Accessed June 16, 2010. 22. Food and Drug Administration. QuantiFERON-TB Gold In-Tube - P010033/ S011. Available at http://www.fda.gov/MedicalDevices/ ProductsandMedicalProcedures/DeviceApprovalsandClearances/ PMAApprovals/ucm106548.htm. Accessed June 16, 2010. 23. Food and Drug Administration. T-SPOT-TB - P070006. Available at http:// www.fda.gov/MedicalDevices/ProductsandMedicalProcedures/ DeviceApprovalsandClearances/PMAApprovals/ucm102794.htm. Accessed June 16, 2010. 24. Oxford Immunotec Limited. T-Spot.TB [U.S. package insert]. Available at http://www.oxfordimmunotec.com/USpageInsert. Accessed June 16, 2010. 25. Oxford Immunotec Limited. T-Spot.TB [U.K. package insert]. Available at http://www.oxfordimmunotec.com/96-UK. Accessed June 16, 2010. 26. Harada N, Higuchi K, Yoshiyama T, et al. Comparison of the sensitivity and specificity of two whole blood interferon-gamma assays for M. tuberculosis infection. J Infect 2008;56:348–53. 27. Tsiouris SJ, Coetzee D, Toro PL, et al. Sensitivity analysis and potential uses of a novel gamma interferon release assay for diagnosis of tubercu-losis. J Clin Microbiol 2006;44:2844–50. 28. Detjen AK, Keil T, Roll S, et al. Interferon-gamma release assays improve the diagnosis of tuberculosis and nontuberculous mycobacterial disease in children in a country with a low incidence of tuberculosis. Clin Infect Dis 2007;45:322–8. 29. Pai M, Joshi R, Bandyopadhyay M, et al. Sensitivity of a whole-blood interferon-gamma assay among patients with pulmonary tuberculosis and variations in T-cell responses during anti-tuberculosis treatment. Infection 2007;35:98–103. 30. Adetifa IM, Lugos MD, Hammond A, et al. Comparison of two interfer-on gamma release assays in the diagnosis of Mycobacterium tuberculosis infection and disease in The Gambia. BMC Infect Dis 2007;7:122. 31. Dominguez J, Ruiz-Manzano J, De Souza-Galvao M, et al. Comparison of two commercially available gamma interferon blood tests for immu-nodiagnosis of tuberculosis. Clin Vaccine Immunol 2008;15:168–71. 32. Palazzo R, Spensieri F, Massari M, et al. Use of whole-blood samples in inhouse bulk and single-cell antigen-specific gamma interferon assays for surveillance of Mycobacterium tuberculosis infections. Clin Vaccine Immunol 2008;15:327–37. 33. Chee CB, Gan SH, KhinMar KW, et al. Comparison of sensitivies of two commercial gamma interferon release assays for pulmonary tuberculosis. J Clin Microbiol 2008;46:1935–40. 34. Ruhwald M, Bodmer T, Maier C, et al. Evaluating the potential of IP-10 and MCP-2 as biomarkers for the diagnosis of tuberculosis. Eur Respir J 2008;32:1607–15. 35. Bartu V, Havelkova M, Kopecka E. QuantiFERON-TB Gold in the diagnosis of active tuberculosis. J Int Med Res 2008;36:434–37. 36. Raby E, Moyo M, Devendra A, et al. The effects of HIV on the sensitiv-ity of a whole blood IFN-gamma release assay in Zambian adults with active tuberculosis. PLoS ONE 2008;3:e2489. 37. Aichelburg MC, Rieger A, Breitenecker F, et al. Detection and prediction of active tuberculosis disease by a whole-blood interferon-gamma release assay in HIV-1-infected individuals. Clin Infect Dis 2009;48:954–62. 38. Goletti D, Stefania C, Butera O, et al. Accuracy of immunodiagnostic tests for active tuberculosis using single and combined results: a multi-center TBNETStudy. PLoS ONE 2008;3:e3417. 39. Kampmann B, Whittaker E, Williams A, et al. Interferon-gamma release assays do not identify more children with active tuberculosis than the tuberculin skin test. Eur Respir J 2009;33:1374–82. 40. Lee JY, Choi HJ, Park IN, et al. Comparison of two commercial inter-ferongamma assays for diagnosing Mycobacterium tuberculosis infection. Eur Respir J 2006;28:24–30. 41. Meier T, Eulenbruch HP, Wrighton-Smith P, Enders G, Regnath T. Sensitivity of a new commercial enzyme-linked immunospot assay (T 25 Giugno 2010 SPOT-TB) for diagnosis of tuberculosis in clinical practice. Eur J Clin Microbiol Infect Dis 2005;24:529–36. 42. Goletti D, Carrara S, Vincenti D, et al. Accuracy of an immune diag-nostic assay based on RD1 selected epitopes for active tuberculosis in a clinical setting: a pilot study. Clin Microbiol Infect 2006;12:544–50. 43. Ferrara G, Losi M, D’Amico R, et al. Use in routine clinical practice of two commercial blood tests for diagnosis of infection with Mycobacterium tuberculosis: a prospective study. Lancet 2006;367:1328–34. 44. Jafari C, Ernst M, Kalsdorf B, et al. Rapid diagnosis of smear-negative tuberculosis by bronchoalveolar lavage enzyme-linked immunospot. Am J Respir Crit Care Med 2006;174:1048–54. 45. Kang YA, Lee HW, Hwang SS, et al. Usefulness of whole-blood interferongamma assay and interferon-gamma enzyme-linked immu-nospot assay in the diagnosis of active pulmonary tuberculosis. Chest 2007;132:959–65. 46. Bosshard V, Roux-Lombard P, Perneger T, et al. Do results of the T-SPOT.TB interferon-gamma release assay change after treatment of tuberculosis? Respir Med 2009;103:30–4. 47. Wang JY, Chou CH, Lee LN, et al. Diagnosis of tuberculosis by an enzyme-linked immunospot assay for interferon-gamma. Emerg Infect Dis 2007;13:553–8. 48. Janssens JP, Roux-Lombard P, Perneger T, et al. Quantitative scoring of an interferon-gamma assay for differentiating active from latent tuber-culosis. Eur Respir J 2007;30:722–8. 49. Ozekinci T, Ozbek E, Celik Y. Comparison of tuberculin skin test and a specific T-cell-based test, T-Spot.TB, for the diagnosis of latent tuber-culosis infection. J Int Med Res 2007;35:696–703. 50. Soysal A, Torun T, Efe S, et al. Evaluation of cut-off values of interferon-gamma-based assays in the diagnosis of M. tuberculosis infection. Int J Tuberc Lung Dis 2008;12:50–6. 51. Liao CH, Chou CH, Lai CC, et al. Diagnostic performance of an enzyme-linked immunospot assay for interferon-gamma in extrapul-monary tuberculosis varies between different sites of disease. J Infect 2009;59:402–8. 52. Higuchi K, Kawabe Y, Mitarai S, Yoshiyama T, Harada N, Mori T. Comparison of performance in two diagnostic methods for tuberculosis infection. Med Microbiol Immunol 2009:198;33–7. 53. Adams LV, Waddell RD, von Reyn CF. T-SPOT.TB Test(R) results in adults with Mycobacterium avium complex pulmonary disease. Scand J Infect Dis 2008;40:196–203. 54. Pai M, Zwerling A, Menzies D. Systematic review: T-cell-based assays for the diagnosis of latent tuberculosis infection: an update. Ann Intern Med 2008;149:177–84. 55. Farhat M, Greenaway C, Pai M, Menzies D. False-positive tuberculin skin tests: what is the absolute effect of BCG and non-tuberculous mycobacteria? Int J Tuberc Lung Dis 2006;10:1192–204. 56. Wang L, Turner MO, Elwood RK, Schulzer M, FitzGerald JM. A meta-analysis of the effect of Bacille Calmette-Guerin vaccination on tuberculin skin test measurements. Thorax 2002;57:804–9. 57. Brock I, Weldingh K, Lillebaek T, Follmann F, Andersen P. Comparison of tuberculin skin test and new specific blood test in tuberculosis contacts. Am J Respir Crit Care Med 2004;170:65–9. 58. Arend SM, Thijsen SF, Leyten EM, et al. Comparison of two interferon-gamma assays and tuberculin skin test for tracing tuberculosis contacts. Am J Respir Crit Care Med 2007;175:618–27. 59. Choi JC, Shin JW, Kim JY, et al. The effect of previous tuberculin skin test on the follow-up examination of whole-blood interferon-gamma assay in the screening for latent tuberculosis infection. Chest 2008;133:1415–20. 60. Leung CC, Yam WC, Yew WW, et al. Comparison of T-Spot.TB and tuberculin skin test among silicotic patients. Eur Respir J 2008;31:266–72. 61. Diel R, Loddenkemper R, Meywald-Walter K, Gottschalk R, Nienhaus A. Comparative performance of tuberculin skin test, QuantiFERON-TB-Gold In Tube assay, and T-Spot.TB test in contact investigations for tuberculosis. Chest 2009;135:1010–8. 62. Hill PC, Jeffries DJ, Brookes RH, et al. Using ELISPOT to expose false positive skin test conversion in tuberculosis contacts. PLoS ONE 2007;2:e183. 63. Igari H, Watanabe A, Sato T. Booster phenomenon of QuantiFERONTB Gold after prior intradermal PPD injection. Int J Tuberc Lung Dis 2007;11:788–91. 64. Leyten EM, Prins C, Bossink AW, et al. Effect of tuberculin skin testing on a Mycobacterium tuberculosis-specific interferon-gamma assay. Eur Respir J 2007;29:1212–6. 65. Naseer A, Naqvi S, Kampmann B. Evidence for boosting Mycobacterium tu- Vol. 59 / RR-5 Recommendations and Reports berculosis-specific IFN-gamma responses at 6 weeks following tuber-culin skin testing. Eur Respir J 2007;29:1282–83. 66. Richeldi L, Ewer K, Losi M, et al. Repeated tuberculin testing does not induce false positive ELISPOT results. Thorax 2006;61:180. 67. Hill PC, Brookes RH, Fox A, et al. Longitudinal assessment of an ELISPOT test for Mycobacterium tuberculosis infection. PLoS Med 2007;4:e192. 68. Ewer K, Millington KA, Deeks JJ, et al. Dynamic antigen-specific T-cell responses after point-source exposure to Mycobacterium tuberculosis. Am J Respir Crit Care Med 2006;174:831–9. 69. Pai M, Joshi R, Dogra S, et al. Serial testing of health care workers for tuberculosis using interferon-gamma assay. Am J Respir Crit Care Med 2006;174:349–55. 70. Perry S, Sanchez L, Yang S, et al. Reproducibility of QuantiFERON-TB gold in-tube assay. Clin Vaccine Immunol 2008;15:425–32. 71. Veerapathran A, Joshi R, Goswami K, et al. T-cell assays for tuberculosis infection: deriving cut-offs for conversions using reproducibility data. PLoS ONE 2008;3:e1850. 72. Tsiouris SJ, Austin J, Toro P, et al. Results of a tuberculosis-specific IFN-gamma assay in children at high risk for tuberculosis infection. Int J Tuberc Lung Dis 2006;10:939–41. 73. Nakaoka H, Lawson L, Squire SB, et al. Risk for tuberculosis among children. Emerg Infect Dis 2006;12:1383–88. 74. Janssens J, Roux-Lombard P, Perneger T, et al. Contribution of a IFN-gamma assay in contact tracing for tuberculosis in a low-incidence, high immigration area. Swiss Med Wkly 2008;138:585–93. 75. Vynnycky E, Fine PE. Lifetime risks, incubation period, and serial interval of tuberculosis. Am J Epidemiol 2000;152:247–63. 76. Diel R, Loddenkemper R, Meywald-Walter K, Niemann S, Nienhaus A. Predictive value of a whole blood IFN-gamma assay for the development of active tuberculosis disease after recent infection with Mycobacterium tuberculosis. Am J Respir Crit Care Med 2008;177:1164–70. 77. Stout JE, Menzies D. Predicting tuberculosis: does the IGRA tell the tale? Am J Respir Crit Care Med 2008;177:1055–7. 78. Kik SV, Franken WP, Mensen M, et al. Predictive value for pro-gression to tuberculosis by IGRA and TST in immigrant contacts. Eur Respir J 2009. Available at http://erj.ersjournals.com/cgi/ rapidpdf/09031936.00098509v1. Accessed June 16, 2010. 79. Hill PC, Jackson-Sillah DJ, Fox A, et al. Incidence of tuberculosis and the predictive value of ELISPOT and Mantoux tests in Gambian case contacts. PLoS ONE 2008;3:e1379. 80. Newton SM, Brent AJ, Anderson S, Whittaker E, Kampmann B. Paediatric tuberculosis. Lancet Infect Dis 2008;8:498–510. 81. Kampmann B, Tena-Coki G, Anderson S. Blood tests for diagnosis of tuberculosis. Lancet 2006;368:282–3. 82. Connell TG, Curtis N, Ranganathan SC, Buttery JP. Performance of a whole blood interferon gamma assay for detecting latent infection with Mycobacterium tuberculosis in children. Thorax 2006;61:616–20. 83. Lewinsohn DA, Zalwango S, Stein CM, et al. Whole blood interferon-gamma responses to Mycobacterium tuberculosis antigens in young household contacts of persons with tuberculosis in Uganda. PLoS ONE 2008;3:e3407. 84. Bergamini BM, Losi M, Vaienti F, et al. Performance of commercial blood tests for the diagnosis of latent tuberculosis infection in children and adolescents. Pediatrics 2009;123:e419–24. 85. Connell TG, Ritz N, Paxton GA, et al. A three-way comparison of tuberculin skin testing, QuantiFERON-TB gold and T-SPOT.TB in children. PLoS ONE 2008;3:e2624. 86. Dogra S, Narang P, Mendiratta DK, et al. Comparison of a whole blood interferon-gamma assay with tuberculin skin testing for the detection of tuberculosis infection in hospitalized children in rural India. J Infect 2007;54:267–76. 87. Lighter J, Rigaud M, Eduardo R, Peng CH, Pollack H. Latent tuberculo-sis diagnosis in children by using the QuantiFERON-TB Gold In-Tube test. Pediatrics 2009;123:30–7. 88. Nicol MP, Davies MA, Wood K, et al. Comparison of T-SPOT.TB assay and tuberculin skin test for the evaluation of young children at high risk for tuberculosis in a community setting. Pediatrics 2009;123:38–43. 89. Warier A, Gunawathi S, Sankarapandian V, John KR, Bose A. T-cell assay as a diagnostic tool for tuberculosis. Indian Pediatr 2010;47:90–2. 90. Taylor RE, Cant AJ, Clark JE. Potential effect of NICE tuberculo-sis guidelines on paediatric tuberculosis screening. Arch Dis Child 2008;93:200–3. 91. Shingadia D, Novelli V. The tuberculin skin test: a hundred, not out? 15 Arch Dis Child 2008;93:189–90. 92. Brock I, Ruhwald M, Lundgren B, et al. Latent tuberculosis in HIV positive, diagnosed by the M. tuberculosis specific interferon gamma test. Respir Res 2006;7:56. 93. Balcells ME, Perez CM, Chanqueo L, et al. A comparative study of two different methods for the detection of latent tuberculosis in HIV-positive individuals in Chile. Int J Infect Dis 2008;12:645–52. 94. Jones S, de Gijsel D, Wallach FR, et al. Utility of QuantiFERON-TB Gold in-tube testing for latent TB infection in HIV-infected individuals. Int J Tuberc Lung Dis 2007;11:1190–5. 95. Luetkemeyer AF, Charlebois ED, Flores LL, et al. Comparison of an interferon-gamma release assay with tuberculin skin testing in HIV-infected individuals. Am J Respir Crit Care Med 2007;175:737–42. 96. Talati NJ, Seybold U, Humphrey B, Aina A, Tapia J, et al. Poor con-cordance between interferon-gamma release assays and tuberculin skin tests in diagnosis of latent tuberculosis infection among HIV-infected individuals. BMC Infect Dis 2009;9:15. 97. Bocchino M, Matarese A, Bellofiore B, et al. Performance of two commer-cial blood IFN-gamma release assays for the detection of Mycobacterium tuberculosis infection in patient candidates for anti-TNF-alpha treatment. Eur J Clin Microbiol Infect Dis 2008;27:907–13. 98. Cobanoglu N, Ozcelik U, Kalyoncu U, et al. Interferon-gamma assays for the diagnosis of tuberculosis infection before using tumour necrosis factor-alpha blockers. Int J Tuberc Lung Dis 2007;11:1177–82. 99. Matulis G, Juni P, Villiger PM, Gadola SD. Detection of latent tuber-culosis in immunosuppressed patients with autoimmune diseases: performance of a Mycobacterium tuberculosis antigen-specific interferon gamma assay. Ann Rheum Dis 2008;67:84–90. 100. Ponce de LD, Acevedo-Vasquez E, Alvizuri S, et al. Comparison of an interferon-gamma assay with tuberculin skin testing for detection of tuberculosis (TB) infection in patients with rheumatoid arthritis in a TB-endemic population. J Rheumatol 2008;35:776–81. 101. Mandalakas AM, Hesseling AC, Chegou NN, et al. High level of discordant IGRA results in HIV-infected adults and children. Int J Tuberc Lung Dis 2008;12:417–23. 102. Rangaka MX, Wilkinson KA, Seldon R, et al. Effect of HIV-1 infection on T-cell-based and skin test detection of tuberculosis infection. Am J Respir Crit Care Med 2007;175:514–20. 103. Stephan C, Wolf T, Goetsch U, et al. Comparing QuantiFERON-tuberculosis gold, T-SPOT tuberculosis and tuberculin skin test in HIV-infected individuals from a low prevalence tuberculosis country. AIDS 2008;22:2471–9. 104. Lindemann M, Dioury Y, Beckebaum S, et al. Diagnosis of tuberculosis infection in patients awaiting liver transplantation. Hum Immunol 2009;70:24–8. 105. Passalent L, Khan K, Richardson R, et al. Detecting latent tuberculosis infection in hemodialysis patients: a head-to-head comparison of the T-SPOT.TB test, tuberculin skin test, and an expert physician panel. Clin J Am Soc Nephrol 2007;2:68–73. 106. Piana F, Codecasa LR, Cavallerio P, et al. Use of a T-cell-based test for detection of tuberculosis infection among immunocompromised patients. Eur Respir J 2006;28:31–4. 107. Porsa E, Cheng L, Graviss EA. Comparison of an ESAT-6/CFP-10 peptide-based enzyme-linked immunospot assay to a tuberculin skin test for screening of a population at moderate risk of contracting tuberculosis. Clin Vaccine Immunol 2007;14:714–9. 108. Vassilopoulos D, Stamoulis N, Hadziyannis E, Archimandritis AJ. Usefulness of enzyme-linked immunospot assay (elispot) compared to tuberculin skin testing for latent tuberculosis screening in rheu-matic patients scheduled for anti-tumor necrosis factor treatment. J Rheumatol 2008;35:1271–6. 109. MAG Mutual Healthcare Solutions, Inc. Physicians’ fee and coding guide 2009. Atlanta, Georgia: MAG Mutual Healthcare Solutions, Inc.; 2009. 110. Marra F, Marra CA, Sadatsafavi M, et al. Cost-effectiveness of a new interferon-based blood assay, QuantiFERON(R)-TB Gold, in screening tuberculosis contacts. Int J Tuberc Lung Dis 2008;12:1414–24. 111. Sahni R, Miranda C, Yen-Lieberman B, et al. Does the implementation of an interferon-gamma release assay in lieu of a tuberculin skin test increase acceptance of preventive therapy for latent tuberculosis among healthcare workers? Infect Control Hosp Epidemiol 2009;30:197–8. 16 MMWR 25 Giugno 2010 112. American Academy of Pediatrics. Tuberculosis. In: Pickering LK, Baker CJ, Kimberlin DW, Long SS, eds. Red book: 2009 report of the Committee on Infectious Disease. 28th ed. Elk Grove Villiage, IL: American Academy of Pediatrics, 2009:680–701. 113. CDC. Guidelines for preventing the transmission of Mycobacterium tuberculosis in health-care settings, 2005. MMWR 2005;54(No. RR-17). TABELLA 1. Criteri di interpretazione per il test QuantiFERON-TB Gold (QFT-G) TABELLA 3. Criteri di interpretazione per il test T-SPOT.TB (T-Spot) Positivo¶ Qual. Val. Risposta specifica Tubercolare† ≥0,35 UI/ml e ≥50% del Nil Negativo** ≤0,7 <0,35 UI/ml Indeterminato†† ≤0,7 Interpretazione Nil* >0,7 Risposta al mitogeno§ Qualsiasi valore Interpretazione Nil* Risposta specifica Tubercolare† Risposta al mitogeno§ Qualsiasi valore Qualsiasi valore Positivo¶ ≤ 10 spot ≥ 8 spot ≥0,5 Borderline** ≤ 10 spot 5, 6 o 7 spot <0,35 UI/ml <0,5 Negativo†† ≤ 10 spot ≤ 4 spot <50% del Nil Qualsiasi valore Indeterminato** > 10 spot Qualsiasi valore Qualsiasi valore ≤ 10 spot < 5 spot < 20 spot Fonte: Cellestis Limited. QuantiFERON-TB Gold [Package insert]. Disponibille al sito http://www.cellestis.com/IRM/Company/ShowPage. aspx?CPID=1247. * La concentrazione di interferone gamma (IFN-γ) nel plasma del sangue incubato con soluzione salina. † Il valore maggiore di concentrazione di IFN-γ nel plasma del sangue stimolato con un cocktail di peptidi che rappresentano ESAT-6 (early secretory antigenic target-6) o con un cocktail di peptidi che rappresentano CFP-10 (culture filtrate protein 10), meno il valore del Nil. § La concentrazione di IFN-γ nel plasma del sangue stimolato con il mitogeno, meno il valore del Nil. ¶ Interpretazione che indica che è probabile che si tratti di un’infezione da Mycobacterium tuberculosis. ** Interpretazione che indica che è improbabile che si tratti di un’infezione da M. tuberculosis. †† Interpretazione che indica un’incerta probabilità di infezione da M. tuberculosis. TABELLA 2. Criteri di interpretazione per il test QuantiFERON-TB Gold In-Tube (QFT-GIT) Interpretazione Nil* Positivo¶ ≤8,0 Negativo** ≤8,0 Indeterminato†† ≤8,0 Risposta specifica Tubercolare† ≥0,35 UI/ml e ≥25% del Nil <0,35 UI/ml o <25% del Nil <0,35 UI/ml o <25% del Nil >8,0 Qualsiasi valore Risposta al mitogeno§ Qual. Val ≥0,5 <0,5 Qual. Val. Fonte: Cellestis Limited. QuantiFERON-TB Gold In-Tube [Package insert]. Disponibille al sito http://www.cellestis.com/IRM/content/pdf/ QuantiFeron%20US%20VerG-Jan2010%20NO%20TRIMS.pdf. * La concentrazione di interferone gamma (IFN-) nel plasma del sangue incubato in assenza di antigene. † La concentrazione di IFN-γ nel plasma del sangue stimolato con un unico cocktail di peptidi che rappresentano ESAT-6 (early secretory antigenic target-6), CFP-10 (culture filtrate protein 10) ed parte di TB7.7, meno il valore del Nil. § La concentrazione di IFN-γ nel plasma del sangue stimolato con il mitogeno, meno il valore del Nil. ¶ Interpretazione che indica che è probabile che si tratti di un’infezione da Mycobacterium tuberculosis. ** Interpretazione che indica che è improbabile che si tratti di un’infezione da M. tuberculosis. †† Interpretazione che indica un’incerta probabilità di infezione da M. tuberculosis. Fonte: Oxford Immunotec Limited. T-Spot.TB [Package insert]. Disponibille al sito http://www.oxfordimmunotec.com/USpageInsert. * Il numero di spot che derivano dall’incubazione di PBMC in terreno di coltura in assenza di antigeni. † Il maggior numero di spot che derivano dalla stimolazione delle cellule mononucleate del sangue periferico (PBMC) con due cocktail separati di peptidi che rappresentano ESAT-6 (early secretory antigenic target-6) o CFP-10 (culture filtrate protein 10), meno il valore del Nil. § l numero di spot che derivano dalla stimolazione di PBMC con il mitogeno, senza correggere per il numero di spot che derivano dall’incubazione di PBMC in assenza di antigeni. ¶ Interpretazione che indica che è probabile che si tratti di un’infezione da Mycobacterium tuberculosis. ** Interpretazione che indica un’incerta probabilità di infezione da M. tuberculosis. †† Interpretazione che indica che è improbabile che si tratti di un’infezione da M. tuberculosis. Vol. 59 / RR-5 Recommendations and Reports 17 TABELLA 4. Sensibilità* del test QuantiFERON-TB Gold-In-Tube (QFT-GIT) per nazione in cui è stato condotto uno studio – 14 nazioni, 2006-2009 TB confermata† Nazione Soggetti N. casi confermati / N. casi con diagnosi di TB Risultati del QFT-GIT HIV§-positivi (%) N. + / N. soggetti testati Positivi (%) Criteri interpretativi** N. + / N. risultati validi Risultati del TCT¶ Indeterminati (%) N. + / N. soggetti testati Sud Africa§§ Germania¶¶ India§§§ Gambia¶¶¶ Spagna**** Italia†††† Singapore§§§§ Bambini Bambini Adulti Adulti Adulti e bambini Per lo più adulti Adulti 154/154 28/28 58/60 75/75 NR/42 17/17 286/286 (100) (100) (97) (100) (NR) (100) (100) 26/41 NR*** 3/60 7/77 NR NR 7/238 (63) NR (5) (9) NR NR (3) A B A B C C A 100/131 26/28 44/60 48/75 33/42 14/17 224/270 (76) (93) (73) (64) (79) (82) (83) Giappone¶¶¶¶ Danimarca***** Repubblica Adulti Adulti Adulti 1/100 10/56 0/22 0/31 (1) (18) (0) (0) D C C Ceca††††† Zambia§§§§§ 100/100 (100) 68/80 (85) 22/22 (100) 0/31 (0) 87/94 65/76 19/22 24/28 (93) (86) (86) (86) Adulti 59/96 (62) A 83/96 (86) Austria****** Multicentrico Adulti HIV+ Adulti 11/11 (100) 3/NR (NR) 0/NR (NR) D C 10/11 (91) 99/117 (85) 22/34 (65) 0/11 4/121 0/34 D 20/23 (87) 20/36 (56) 2/25 2/38 Europa†††††† Regno Unito§§§§§§ Bambini 0/112 (0) 10/11 (91) 121/121 (100) 0/34 (0) 25/25 (100) 0/38 (0) 0/35 (0) (%) 23/154 (15) ND††† ND 0/60 (0) ND ND 0/42 (0) 0/17 (0) 10/286 (4) Positivi Cutoff N. + / N. soggetti testati (%) % TCT+ vs. QFT-GIT+ p-value†† Stratificato 5 mm ND ND 5 mm NR 10 mm 15 mm 131/146 28/28 ND ND 40/42 9/12 206/217 158/217 (90) (100) ND ND (95) (75) (95) (73) <0.01 0.49 ND ND 0.05 0.97 <0.01 ND (6) (5) (0) (6) ND 10 mm 5 mm ND 9/12 12/22 22/31 ND (75) (55) (71) ND 0.58 0.05 ND 16/112 (14) 5 mm¶¶¶¶¶ 10 mm¶¶¶¶¶ 62/92¶¶¶¶¶ 48/92¶¶¶¶¶ (67)¶¶¶¶¶ (52)¶¶¶¶¶ <0.01 ND (0) (3) (0) 5 mm 10 o 15 mm 8/10 114/136 37/41 (80) (84) (90) 0.92 1.0 0.02 (8) (5) 10 mm 21/24 24/38 (86) (63) 1.0 0.67 6/100 4/80 0/22 3/31 * Fonte: Modificata da Pai M, Zwerling A, Menzies D. Systematic review: T-cell-based assays for the diagnosis of latent tuberculosis infection: an update. Ann Intern Med 2008;149:177–84 integrata con informazioni aggiuntive e confrontata con la sensibilità del TCT quando disponibile. † La diagnosi di tubercolosi attiva era confermata dagli esami colturali e/o dal test di amplificazione degli acidi nucleici. § Human immunodeficiency virus (virus dell’immunodeficienza umana). ¶ Test cutaneo tubercolinico. ** “A” = QFT-GIT era interpretato come positivo se la risposta specifica tubercolare (TB) era ≥0.35 UI/mL; indeterminato se la risposta TB era <0.35 UI/mL e la risposta al mitogeno era <0.5 UI/mL; e negativo se la risposta TB era <0.35 UI/mL e la risposta al mitogeno era ≥0.5 UI/mL. “B” = QFT-GIT era interpretato come positivo se la risposta TB era ≥0.35 UI/mL; la risposta al mitogeno non veniva misurata. “C” = i criteri di interpretazione del QFT-GIT non erano dichiarati esplicitamente. “D” = QFT-GIT era interpretato come positivo se la risposta TB era ≥0.35 UI/mL ed il Nil era ≤8.0 UI/mL; indeterminato se il Nil era ≥8.0 UI/mL o la risposta TB era <0.35 UI/mL e la risposta al mitogeno era <0.5 UI/mL; e negativo se la risposta TB era <0.35 UI/mL, la risposta al mitogeno era ≥0.5 UI/mL, ed il Nil era ≤8.0 UI/mL. †† Il test esatto di Fisher a due code è stato usato dai CDC per calcolare i valori di p. §§ Fonte: Tsiouris SJ, Coetzee D, Toro PL, Austin J, Stein Z, el-Sadr W. Sensitivity analysis and potential uses of a novel gamma interferon release assay for diagnosis of tuberculosis. J Clin Microbiol 2006;44:2844–50. ¶¶ Fonte: Detjen AK, Keil T, Roll S, et al. Interferon-gamma release assays improve the diagnosis of tuberculosis and nontuberculous mycobacterial disease in children in a country with a low incidence of tuberculosis. Clin Infect Dis 2007;45:322–8. *** Non riportato ††† Non eseguito §§§ Fonte: Pai M, Joshi R, Bandyopadhyay M, et al. Sensitivity of a whole-blood interferon-gamma assay among patients with pulmonary tuberculosis and variations in T-cell responses during anti-tuberculosis treatment. Infection 2007;35:98–103. ¶¶¶ Fonte: Adetifa IM, Lugos MD, Hammond A et al. Comparison of two interferon gamma release assays in the diagnosis of Mycobacterium tuberculosis infection and disease in The Gambia. BMC Infect Dis 2007;7:122. **** Fonte: Dominguez J, Ruiz-Manzano J, De Souza-Galvao M, et al. Comparison of two commercially available gamma interferon blood tests for immunodiagnosis of tuber- culosis. Clin Vaccine Immunol 2008;15:168–171. †††† Fonte: Palazzo R, Spensieri F, Massari M, et al. Use of whole-blood samples in in-house bulk and single-cell antigen-specific gamma interferon assays for surveillance of Mycobacterium tuberculosis infections. Clin Vaccine Immunol 2008;15:327–37. §§§§ Fonte: Chee CB, Gan SH, KhinMar KW, et al. Comparison of sensitivies of two commercial gamma interferon release assays for pulmonary tuberculosis. J Clin Microbiol 2008;46:1935–40. ¶¶¶¶ Fonte: Harada N, Higuchi K, Yoshiyama T, et al. Comparison of the sensitivity and specificity of two whole blood interferon-gamma assays for M. tuberculosis infection. J Infect 2008;56:348–53. ***** Fonte: Ruhwald M, Bodmer T, Maier C, et al. Evaluating the potential of IP-10 and MCP-2 as biomarkers for the diagnosis of tuberculosis. Eur Respir J 2008; 32(6):1607-1615. ††††† Fonte: Bartu V, Havelkova M, Kopecka E. QuantiFERON-TB Gold in the diagnosis of active tuberculosis. J Int Med Res 2008;36:434–7. §§§§§ Source: Raby E, Moyo M, Devendra A, et al. The effects of HIV on the sensitivity of a whole blood IFN-gamma release assay in Zambian adults with active tuberculosis. PLoS ONE 2008;3:e2489. [E-pub]. Disponibile al sito http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0002489. ¶¶¶¶¶ TCT letto a 48–164 ore dopo l’inoculazione della tubercolina. ****** Fonte: Aichelburg MC, Rieger A, Breitenecker F, et al. Detection and prediction of active tuberculosis disease by a whole-blood interferon-gamma release assay in HIV-1- infected individuals. Clin Infect Dis 2009;48:954–62. †††††† Fonte: Goletti D, Stefania C, Butera O, et al. Accuracy of immunodiagnostic tests for active tuberculosis using single and combined results: a multicenter TBNETStudy. PLoS ONE 2008; 3:e3417. [E-published]. Disponibile al sito http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0003417. §§§§§§ Fonte: Kampmann B, Whittaker E, Williams A, et al. Interferon-gamma release assays do not identify more children with active tuberculosis than the tuberculin skin test. Eur Respir J 2009;33:1374–82. 18 MMWR 25 Giugno 2010 TABELLA 5. Sensibilità* del test T-SPOT.TB (T-Spot) per nazione in cui è stato condotto uno studio – 12 nazioni, 2005-2009 TB confermata† Risultati del T-Spot HIV§-positivi Nazione Soggetti Singapore§§ Adulti N. casi confermati / N. casi con diagnosi di TB 286/286 (%) (100) N. + / N. soggetti testati (%) 7/238 (3) Positivi Criteri interpretativi** N. + / N. risultati validi A 254/270 Risultati del TCT¶ Indeterminati (%) N. + / N. soggetti testati (%) (94) 3/286 (1) Positivi N. + / N. soggetti testati (%) % TCT+ vs. TSpot+ pvalue†† 10 mm 206/217 (95) 0.84 15 mm 158/217 (73) ND¶¶ Cut off Spagna*** Adulti e bambini NR/42 (NR) NR††† NR B 36/39 (86) 3/42 (7) 5 mm 40/42 (95) 0.93 Germania§§§ Bambini di età tra 0-7 anni 28/28 (100) NR NR B 26/28 (93) 0/28 (0) 5 mm 28/28 (100) 0.49 Corea del Sud¶¶¶ Adulti 37/65 (57) 0/31 (0) C 83/87 (95) 0/87 (0) 5 mm 64/87 (74) <0.01 10 mm 55/87 (67) <0.01 0.05 Germania**** Adulti 58/65 (89) NR NR D 40/40 (100) 0/40 (0) NR 35/40 (88) Italia†††† Adulti 23/23 (100) 0/23 (0) E 21/23 (91) NR NR ND ND ND ND Italia§§§§ Adulti e ragazzi di età >15 anni 13/24 (54) NR NR F 20/24 (83) 0/24 (0) 5 mm 14/20 (54) 0.49 Germania¶¶¶¶ Adulti Corea del Sud***** Adulti e ragazzi di età >15 anni 8/12 (67) NR NR G 12/12 (100) 0/12 (0) 6 mm 8/10 (80) 0.39 58/67 (87) 0/67 (0) H 59/64 (92) 3/67 (4) 10 mm 45/66 (68) <0.01 Svizzera††††† Adulti 89/89 (100) 0/89 (0) I 61/61 (100) 1/62 (2) ND ND ND ND Taiwan§§§§§ Adulti e bambini età 2-84 anni 37/39 (95) 3/NR (ND) J 34/39 (87) NR NR ND ND ND ND Svizzera¶¶¶¶¶ Adulti e ragazzi di età >15 anni 58/58 (100) 0/58 (0) K 57/58 (98) 0/58 (2) ND ND ND ND Turchia****** Adulti NR/28 NR/28 NR NR B 26/28 (93) NR NR 10 mm 23/28 (82) 0.42 Turchia†††††† Adulti e ragazzi di età >15 anni 100/100 (100) 0/100 (0) L 80/96 (83) 4/100 (4) 10 mm 80/99 (81) 0.79 Multicentrico Europa§§§§§§ Adulti 69/69 (100) 3/NR (NR) B 62/69 (90) 0/69 (0) 10 o 15 mm 114/136 (84) 0.06 0/19 (0) 0/NR (NR) 13/19 (68) 0/19 (0) 37/41 (90) 0.09 Taiwan¶¶¶¶¶¶ Adulti con TB extrapolmonare 50/50 (100) 2/NR (NR) 40/50 (80) NR NR ND ND ND ND 0/39 (0) 31/39 (79) 25/25 (100) 14/24 (58) 1/25 (8) 10 mm 21/24 (86) 0.05 0/38 (0) 17/34 (50) 4/38 (11) 24/38 (63) 0.38 49/49 (100) 47/47 (100) 2/49 (4) ND ND ND Regno Unito******* Bambini Giappone††††††† Adulti 0/35 NR (0) NR M F N ND Vol. 59 / RR-5 Recommendations and Reports 19 * Fonte: Modificata da Pai M, Zwerling A, Menzies D. Systematic review: T-cell-based assays for the diagnosis of latent tuberculosis infection: an update. Ann Intern Med 2008;149:177–84 integrata con informazioni aggiuntive e confrontata con la sensibilità del TCT quando disponibile. † Tubercolosi. Confermata dall’esame colturale o dal test di amplificazione degli acidi nucleici. § Human immunodeficiency virus (virus dell’immunodeficienza umana). ¶ Test cutaneo tubercolinico. ** “A” = il T-Spot era interpretato come positivo se un pozzetto del test (stimolato o con early secretory antigenic target-6 [ESAT-6] o con culture filtrate protein culture filtrate protein [CFP-10]) conteneva 6 o più spot rispetto al pozzetto del controllo negativo ed aveva almeno un numero di spot pari al doppio degli spot del pozzetto del controllo negativo, ed il pozzetto del controllo negativo aveva ≤10 spot; indeterminato se non era “positivo” e il pozzetto stimolato con mitogeno aveva <20 spot o il pozzetto del controllo negativo aveva >10 spot. “B” = i criteri di interpretazione del T-Spot non erano dichiarati esplicitamente. “C” = il T-Spot era interpretato come positivo se un pozzetto del test (stimolato o con ESAT-6 o con CFP-10) conteneva 5 o più spot rispetto al pozzetto del controllo negativo ed aveva almeno un numero di spot pari al doppio degli spot del pozzetto del controllo negativo, ed il pozzetto del controllo negativo aveva ≤10 spot e come indeterminato se il pozzetto del controllo negativo aveva >10 spot. “D” = il T-Spot era interpretato come positivo se un pozzetto del test (stimolato o con ESAT-6 o con CFP-10) conteneva 5 o più spot rispetto al pozzetto del controllo negativo ed aveva almeno un numero di spot pari al doppio degli spot del pozzetto del controllo negativo ed il pozzetto stimolato con il mitogeno aveva >20 spot e indeterminato se il pozzetto stimolato con il mitogeno aveva ≤20 spot. “E” = il T-Spot era interpretato come positivo se il pozzetto stimolato con ESAT-6 conteneva un numero di spot pari ad almeno il doppio della media degli spot del controllo negativo o se il pozzetto stimolato con CFP-10 conteneva un numero di spot pari ad almeno 4 volte la media degli spot del controllo negativo. “F” = il T-Spot era interpretato come positivo se un pozzetto del test (stimolato o con ESAT-6 o con CFP-10) conteneva 6 o più spot rispetto al pozzetto del controllo negativo ed aveva almeno un numero di spot pari al doppio degli spot del pozzetto del controllo negativo ed il pozzetto del controllo negativo aveva <10 spot, come indeterminato se non era “positivo” ed il pozzetto stimolato con il mitogeno aveva <20 spot ed il pozzetto del controllo negativo aveva <10 spot, come negativo se non era “positive” e gli spot nel pozzetto del controllo negativo erano <10 e gli spot nel pozzetto stimolato con mitogeno erano ≥20, e come errore tecnico se il pozzetto del controllo negativo aveva ≥10 spot. “G” = il T-Spot era interpretato come positivo se un pozzetto del test (stimolato o con ESAT-6 o con CFP-10) conteneva 5 o più spot rispetto al pozzetto del controllo negativo ed aveva almeno un numero di spot pari al doppio degli spot del pozzetto del controllo negativo; ciascun pozzetto conteneva 200.000 PBMC invece di 250.000 PBMC come raccomandato dal produttore. “H” = il T-Spot era interpretato come positivo se un pozzetto del test (stimolato o con ESAT-6 o con CFP-10) conteneva 5 o più spot rispetto al pozzetto del controllo negativo ed aveva almeno un numero di spot pari al doppio degli spot del pozzetto del controllo negativo; venivano riportati risultati indeterminati, ma i criteri non erano dichiarati esplicitamente; ciascun pozzetto conteneva 200.000 PBMC invece di 250.000 PBMC come raccomandato dal produttore. “I” = il T-Spot era interpretato come positivo se un pozzetto del test (stimolato o con ESAT-6 o con CFP-10) conteneva più di 6 spot rispetto al pozzetto del controllo negativo ed aveva almeno un numero di spot pari al doppio degli spot del pozzetto del controllo negativo ed il pozzetto del controllo negativo aveva ≤10 spot e come indeterminato se non “positivo” e il pozzetto stimolato con il mitogeno aveva <20 spot o il pozzetto del controllo negativo aveva >10 spot. “J” = il T-Spot era interpretato come positivo se il numero medio di spot in pozzetti duplicati (stimolati o con ESAT-6 o con CFP-10) era pari a 10 o più spot rispetto al numero medio di spot in pozzetti duplicati del controllo negativo ed almeno pari al doppio del numero medio di spot nei pozzetti del controllo negativo; gli altri criteri interpretativi non erano dichiarati esplicitamente. “K” = il T-Spot era interpretato come indeterminato se il pozzetto stimolato con il mitogeno aveva <20 spot come positivo se non indeterminato ed un pozzetto del test (stimolato o con ESAT-6 o con CFP-10) conteneva più di 6 spot rispetto al pozzetto del controllo negativo. “L” = il T-Spot era interpretato come indeterminato se il pozzetto stimolato con il mitogeno aveva ≤20 spot o il pozzetto del controllo negativo aveva ≥10 spot e come positivo se non indeterminato ed un pozzetto del test (stimolato o con ESAT-6 o con CFP-10) conteneva 6 o più spot rispetto al pozzetto del controllo negativo ed aveva almeno un numero di spot pari al doppio degli spot del pozzetto del controllo negativo. “M” = il T-Spot era interpretato come positivo se un pozzetto del test (stimolato o con ESAT-6 o con CFP-10) aveva ≥10 spot (quando il pozzetto del controllo negativo aveva <5 spot) o almeno un numero di spot pari al doppio degli spot del pozzetto del controllo negativo (quando il pozzetto del controllo negativo aveva ≥5 spot). “N” = il T-Spot era interpretato come positivo se il pozzetto del Nil aveva 0–5 spot ed un pozzetto del test (stimolato o con ESAT-6 o con CFP-10) aveva 6 o più spot rispetto al pozzetto del Nil o se il pozzetto del Nil aveva 6–10 spot ed un pozzetto del test aveva almeno un numero di spot pari al doppio degli spot del pozzetto del controllo negativo; il test era indeterminato se il numero di spot nel pozzetto del Nil era >10 o se il numero di spot nel pozzetto stimolato con il mitogeno era <20 e nessuno dei pozzetti del test era positivo. †† Il test esatto di Fisher a due code è stato usato dai CDC per calcolare i valori di p. §§ Fonte: Chee CB, Gan SH, KhinMar KW, et al. Comparison of sensitivies of two commercial gamma interferon release assays for pulmonary tuberculosis. J Clin Microbiol 2008;46:1935–40. ¶¶ Non eseguito *** Fonte: Dominguez J, Ruiz-Manzano J, De Souza-Galvao M, et al. Comparison of two commercially available gamma interferon blood tests for immunodiagnosis of tuberculosis. Clin Vaccine Immunol 2008;15:168–71. ††† Non riportato §§§ Fonte: Detjen AK, Keil T, Roll S et al. Interferon-gamma release assays improve the diagnosis of tuberculosis and nontuberculous mycobacterial disease in children in a country with a low incidence of tuberculosis. Clin Infect Dis 2007;45:322–8. ¶¶¶ Fonte: Lee JY, Choi HJ, Park IN, et al. Comparison of two commercial interferon-gamma assays for diagnosing Mycobacterium tuberculosis infection. Eur Respir J 2006;28:24–30. **** Fonte: Meier T, Eulenbruch HP, Wrighton-Smith P, Enders G, Regnath T. Sensitivity of a new commercial enzyme-linked immunospot assay (T SPOT-TB) for diagnosis of tuberculosis in clinical practice. Eur J Clin Microbiol Infect Dis 2005;24:529–36. †††† Fonte: Goletti D, Carrara S, Vincenti D, et al. Accuracy of an immune diagnostic assay based on RD1 selected epitopes for active tuberculosis in a clinical setting: a pilot study. Clin Microbiol Infect 2006;12:544–50. §§§§ Fonte: Ferrara G, Losi M, D’Amico R, et al. Use in routine clinical practice of two commercial blood tests for diagnosis of infection with Mycobacterium tuberculosis: a prospective study. Lancet 2006;367:1328–34. ¶¶¶¶ Fonte: Jafari C, Ernst M, Kalsdorf B, et al. Rapid diagnosis of smear-negative tuberculosis by bronchoalveolar lavage enzyme-linked immunospot. Am J Respir Crit Care Med 2006;174:1048–54. ***** Fonte: Kang YA, Lee HW, Hwang SS, et al. Usefulness of whole-blood interferon-gamma assay and interferon-gamma enzyme-linked immunospot assay in the diagnosis of active pulmonary tuberculosis. Chest 2007;132:959–65. ††††† Fonte: Bosshard V, Roux-Lombard P, Perneger T, et al. Do results of the T-SPOT.TB interferon-gamma release assay change after treatment of tuberculosis? Respir Med 2009;103:30–4. §§§§§ Fonte: Wang JY, Chou CH, Lee LN, et al. Diagnosis of tuberculosis by an enzyme-linked immunospot assay for interferon-gamma. Emerg Infect Dis 2007;13:553– 8. ¶¶¶¶¶ Fonte: Janssens JP, Roux-Lombard P, Perneger T, Metzger M, Vivien R, Rochat T. Quantitative scoring of an interferon-gamma assay for differentiating active from latent tuberculosis. Eur Respir J 2007;30:722–8. ****** Fonte: Ozekinci T, Ozbek E, Celik Y. Comparison of tuberculin skin test and a specific T-cell-based test, T-Spot.TB, for the diagnosis of latent tuberculosis infection. J Int Med Res 2007;35:696–703. †††††† Fonte: Soysal A, Torun T, Efe S, Gencer H, Tahaoglu K, Bakir M. Evaluation of cut-off values of interferon-gamma-based assays in the diagnosis of M. tuberculosis infection. Int J Tuberc Lung Dis 2008;12:50–6. §§§§§§ Fonte: Goletti D, Stefania C, Butera O, et al. Accuracy of immunodiagnostic tests for active tuberculosis using single and combined results: a multicenter TBNETStudy. PLoS ONE 2008;3:e3417. [E-published]. Disponibile al sito http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0003417. ¶¶¶¶¶¶ Fonte: Liao CH, Chou CH, Lai CC, et al. Diagnostic performance of an enzyme-linked immunospot assay for interferon-gamma in extrapulmonary tuberculosis varies between different sites of disease. J Infect 2009;59:402–8. ******* Fonte: Kampmann B, Whittaker E, Williams A, et al. Interferon-gamma release assays do not identify more children with active tuberculosis than the tuberculin skin test. Eur Respir J 2009;33:1374–82. ††††††† Fonte: Higuchi K, Kawabe Y, Mitarai S, Yoshiyama T, Harada N, Mori T. Comparison of performance in two diagnostic methods for tuberculosis infection. Med Microbiol Immunol 2009:198;33–7. 20 MMWR 25 Giugno 2010 TABELLA 6. Specificità* del test QuantiFERON-TB Gold In-Tube (QFT-GIT) per nazione in cui è stato condotto uno studio – 4 nazioni, 2007-2008 Risultati del QFT-GIT BCG†-vaccinati N. vaccinati / N. soggetti valutati Nazione Soggetti Germania§§ Bambini di età 0-11 anni con linfadenite 0/23 Bambini di età 0-7 anni con infezione respiratoria 0/22 Germania§§ (%) (0) (0) HIV§-positivi N. + / N. soggetti testati NR¶¶ NR Negativi (%) Criteri interpretativi** NR A NR A N. + / N. risultati validi 19/19 21/21 Risultati del TCT¶ Indeterminati (%) (100) (100) N. + / N. soggetti testati ND*** ND (%) ND ND Negativi Cutoff N. + / N. soggetti testati (%) % TCTvs. % QFTGITp-value†† 5 mm 2/23 (9) <0.01 10 mm 5/23 (22) <0.01 5 mm 22/22 (100) 1.0 10 mm 22/22 (100) 1.0 Giappone††† Studenti adulti 140/168 (83) 0/168 (0) B 156/160 (99) 6/168 (4) ND ND ND ND Danimarca§§§ Studenti e personale di scuola superiore 38/124 (31) 0/124 (0) C 124/124 (100) 0 (0) 10 mm 116/124 (94) <0.01 Italia¶¶¶ In maggioranza adulti 1/14 (7) 0/14 (0) C 14/14 (100) 0/14 (0) NR 8/8 (100) ND * Fonte: Modificata da Pai M, Zwerling A, Menzies D. Systematic review: T-cell-based assays for the diagnosis of latent tuberculosis infection: an update. Ann Intern Med 2008;149:177–84 integrata con informazioni aggiuntive e confrontata con la specificità del TCT quando disponibile. † Bacillo di Calmette-Guerin. § Human immunodeficiency virus (virus dell’immunodeficienza umana). ¶ Test cutaneo tubercolinico. ** “A” indica che il QFT-GIT era interpretato come positivo se la risposta tubercolare (TB) era ≥0.35 UI/mL; la risposta al mitogeno non era misurata. “B” indica che il QFTGIT era interpretato come positivo se la risposta tubercolare era ≥0.35 UI/mL ed il Nil era ≤ 8.0 UI/mL, come indeterminato se il Nil ≥8.0 UI/mL o la risposta tubercolare era <0.35 UI/mL e la risposta al mitogeno era <0.5 UI/mL, e come negativo se la risposta tubercolare era <0.35 UI/mL, la risposta al mitogeno era ≥ 0.5 UI/mL, ed il Nil era ≤8.0 UI/mL. “C” indica che i criteri di interpretazione del QFT- GIT non erano dichiarati esplicitamente. †† Il test esatto di Fisher a due code è stato usato dai CDC per calcolare i valori di p. §§ Fonte: Detjen AK, Keil T, Roll S, et al. Interferon-gamma release assays improve the diagnosis of tuberculosis and nontuberculous mycobacterial disease in children in a country with a low incidence of tuberculosis. Clin Infect Dis 2007;45:322–8. ¶¶ Non riportato *** Non eseguito ††† Fonte: Harada N, Higuchi K, Yoshiyama T, et al. Comparison of the sensitivity and specificity of two whole blood interferon-gamma assays for M. tuberculosis infection. J Infect 2008;56:348–53. §§§ Fonte: Ruhwald M, Bodmer T, Maier C, et al. Evaluating the potential of IP-10 and MCP-2 as biomarkers for the diagnosis of tuberculosis. Eur Respir J 2008;32:1607–15. ¶¶¶ Fonte: Palazzo R, Spensieri F, Massari M, et al. Use of whole-blood samples in in-house bulk and single-cell antigen-specific gamma interferon assays for surveillance of Mycobacterium tuberculosis infections. Clin Vaccine Immunol 2008;15:327–37. Vol. 59 / RR-5 Recommendations and Reports 21 TABELLA 7. Specificità* del test T-SPOT.TB (T-Spot) per nazione in cui è stato condotto uno studio – 3 nazioni, 2006-2008 BCG†-vaccinati Risultati del T-Spot Negativi N. vaccinati / N. soggetti valutati Nazione Soggetti Germania§§ Bambini di età 0-11 anni con linfadenite 0/19 Bambini di età 0-7 anni con infezione respiratoria 0/21 Studenti di scuola superiore 131/131 Germania§§ Corea del Sud††† Stati Uniti§§§ Adulti con o senza pregressa malattia da MAC 0/18 (%) (0) (0) (100) (0) Status HIV§ NR¶¶ NR NR NR Criteri interpretativi** N. + / N. risultati validi A A B C 18/19 21/21 111/131 17/18 Risultati del TCT¶ Indeterminati Negativi (%) % TCTvs. % TSpotp-value†† 2/23 (9) <0.01 5/23 (22) <0.01 5 mm 22/22 (100) 1.0 10 mm 22/22 (100) 1.0 10 mm 103/131 (79) 0.26 15 mm 125/131 (95) <0.01 ND ND ND ND (%) N. + / N. soggetti testati (%) Cutoff N. + / N. soggetti testati (95) 4/23 (17) 5 mm 10 mm (100) (85) (94) 1/22 0/131 0/18 (5) (0) (0) * Fonte: Modificata da Pai M, Zwerling A, Menzies D. Systematic review: T-cell-based assays for the diagnosis of latent tuberculosis infection: an update. Ann Intern Med 2008;149:177–84 integrata con informazioni aggiuntive e confrontata con la specificità del TCT quando disponibile. † Bacillo di Calmette-Guerin. § Human immunodeficiency virus (virus dell’immunodeficienza umana). ¶ Test cutaneo tubercolinico. ** “A” indica che i criteri di interpretazione del T-Spot non erano dichiarati esplicitamente. “B” indica che il T-Spot era interpretato come positivo se un pozzetto del test (stimolato o con early secretory antigenic target-6 [ESAT-6] o con culture filtrate protein culture filtrate protein [CFP-10]) conteneva 5 o più spot rispetto al pozzetto del controllo negativo ed aveva almeno un numero di spot pari al doppio degli spot del pozzetto del controllo negativo ed il pozzetto del controllo negativo aveva ≤10 spot e come indeterminato se il pozzetto del controllo negativo aveva >10 spot. “C” indica che il T-Spot era interpretato come positivo se un pozzetto del test (stimolato o con ESAT-6 o con CFP-10) conteneva 6 o più spot rispetto al pozzetto del controllo negativo ed aveva almeno un numero di spot pari al doppio degli spot del pozzetto del controllo negativo e come indeterminato se non “positivo” ed il pozzetto stimolato con il mitogeno aveva <20 spot. †† §§ Il test esatto di Fisher a due code è stato usato dai CDC per calcolare i valori di p. ¶¶ Non riportato Fonte: Detjen AK, Keil T, Roll S, et al. Interferon-gamma release assays improve the diagnosis of tuberculosis and nontuberculous mycobacterial disease in children in a country with a low incidence of tuberculosis. Clin Infect Dis 2007;45:322–8. ††† Fonte: Lee JY, Choi HJ, Park IN et al. Comparison of two commercial interferon-gamma assays for diagnosing Mycobacterium tuberculosis infection. Eur Respir J 2006;28:24–30. §§§ Fonte: Adams LV, Waddell RD, von Reyn CF. T-SPOT.TB Test results in adults with Mycobacterium avium complex pulmonary disease. Scand J Infect Dis 2008;40:196–203. ¶¶¶ Mycobacterium avium complex. 22 MMWR 25 Giugno 2010 TABELLA 8. Sintesi dei risultati degli studi pubblicati che hanno valutato il test QuantiFERON-TB Gold In-Tube (QFT-GIT) e/o il test T-SPOT.TB (T-Spot) in contatti tubercolari, in confronto con il test cutaneo tubercolinico (TCT) quando disponibile, per ogni nazione in cui è stato condotto uno studio – 7 nazioni, 2006-2008 BCG-vaccinati* N. vaccinati / N. soggetti valutati (%) Cutoff del TCT Nazione Soggetti Risultati Sud Africa† Bambini di età 5-15 anni 115/174 (66) 10 mm I risultati del QFT-GIT e del TCT erano associati con l’età ma non con un recente o remoto contatto in ambito familiare. Nigeria§ Contatti e controlli di età 1-14 anni 1877207 (90) 10 mm I risultati del QFT-GIT e del TCT erano associati con la positività per bacilli alcool-acido resistenti del caso indice e con l’età per i controlli ed i bambini a contatto con soggetti con esame microscopico negativo. La discordanza TCT+/QFT-GIT- era più frequente nei controlli e nei bambini a contatto con soggetti con esame microscopico negativo. TCT-/QFT-GIT+ erano più frequenti nei bambini a contatto con soggetti con esame microscopico positivo. Danimarca¶ Contatti adulti non vaccinati con BCG 0/785 (0) 10 mm I risultati del TCT erano associati con l’età ma non con le stime di esposizione. I risultati del T-Spot erano associati con la stima di esposizione (tempo cumulativo trascorso nel supermercato). Il QFT-GIT (senza mitogeno) era maggiormente associato con il tempo cumulativo trascorso nel supermercato rispetto al T-Spot. Gambia** Contatti adulti e ragazzi di età ≥ 15 anni 84/194 (43) 10 mm Il TCT era più strettamente associato con il gradiente di esposizione rispetto al QFT-GIT (senza mitogeno). I contatti che dormivano nella stessa stanza, rispetto ai contatti che dormivano in case diverse, avevano un odd ratio per un TCT positivo di 4,8 (intervallo di confidenza [IC] al 95% = 1,3-17,1) rispetto a 3,8 (IC = 1,2-12,5) per il QFT-GIT. Svizzera†† Contatti adulti e ragazzi di età 16-83 anni 238/295 (81) 10 mm Entrambi i risultati del TCT e del T-Spot erano associati con l’età, il sesso, la vaccinazione con BCG e l’incidenza di tubercolosi nella nazione di provenienza, ma non con alcuno dei 5 punteggi di esposizione. Germania§§ Contatti adulti e bambini con TCT > 5 mm 453/812 (56) NA Entrambi i risultati del QFT-GIT e del T-Spot erano associati con l‘età, la positività dell’esame microscopico e la tosse del caso indice, con il tempo cumulativo di esposizione e con la nazionalità straniera. Non sono state valutate le associazioni con il TCT. Spagna¶¶ Adulti e bambini 128/270 (47) 5 mm I risultati del TCT erano associati con il BCG. I risultati del QFT-GIT e del T-Spot non erano associati con il BCG. Non è stata valutata l’associazione dei risultati dei test con l’incidenza di tubercolosi nella nazione di provenienza. * Bacillo di Calmette-Guerin. † Fonte: Tsiouris SJ, Austin J, Toro P et al. Results of a tuberculosis-specific IFN-gamma assay in children at high risk for tuberculosis infection. Int J Tuberc Lung Dis 2006;10:939–41. § Fonte: Nakaoka H, Lawson L, Squire SB, et al. Risk for tuberculosis among children. Emerg Infect Dis 2006;12:1383–8. ¶ Fonte: Arend SM, Thijsen SF, Leyten EM, et al. Comparison of two interferon-gamma assays and tuberculin skin test for tracing tuberculosis con tacts. Am J Respir Crit Care Med 2007;175:618–27. ** Fonte: Adetifa IM, Lugos MD, Hammond A, et al. Comparison of two interferon gamma release assays in the diagnosis of Mycobacterium tuberculo sis infection and disease in The Gambia. BMC Infect Dis 2007;7:122. †† Fonte: Janssens J, Roux-Lombard P, Perneger T, Metzger M, Vivien R, Rochat T. Contribution of a IFN-gamma assay in contact tracing for tubercu losis in a low-incidence, high immigration area. Swiss Med Wkly 2008;138:585–93. §§ Fonte: Diel R, Loddenkemper R, Meywald-Walter K, Gottschalk R, Nienhaus A. Comparative performance of tuberculin skin test, QuantiFERON- TB- Gold In Tube assay, and T-Spot.TB test in contact investigations for tuberculosis. Chest 2009;135:1010–8. ¶¶ Fonte: Dominguez J, Ruiz-Manzano J, De Souza-Galvao M, et al. Comparison of two commercially available gamma interferon blood tests for immunodiagnosis of tuberculosis. Clin Vaccine Immunol 2008;15:168–71. Vol. 59 / RR-5 Recommendations and Reports 23 TABELLA 9. Risultati del test QuantiFERON-TB Gold In-Tube (QFT-GIT) in soggetti immunodepressi in confronto ai risultati del test cutaneo tubercolinico (TCT), ove disponibili – 10 nazioni, 2006-2008 Risultati del QFT-GIT Positivi Status HIV* N. + / N. risultati validi Risultati del TCT Indeterminati N. + / N. soggetti testati Nazione Soggetti Danimarca§ 607 adulti 607 HIV+ 27/570 (4,7) 20/590 Cile** 116 adulti 116 HIV+ 17/115 (15) 0/115 (%) (%) Positivi N. + / N. soggetti testati Cutoff (%) % TCT+ vs. % QFT-GIT+ p-value† (3,4) ND ¶ ND ND ND (0) 5 mm 12/110 (11) 0,50 Stati Uniti†† 207 adulti 207 HIV+ 11/191 (6) 10/201 (5) 5 mm 13/201 (7) 0,94 Stati Uniti§§ 294 adulti 294 HIV+ 25/279 (9) 15/294 (5) 5 mm 19/205 (9) 0,99 Zambia¶¶ 112 adulti con TB, con diretto + su escreato 59 HIV+ 37/49 (76) 10/59 (17) 5 mm 26/47 (55) 0,06 37 HIV- 31/32 (97) 5/37 (14) 35/31 (81) 0,09 16 non testati 15/15 (100) 1/16 (6) 0/14 (0) <0,01 26 HIV+ 17/21 (81) 5/26 (0) 22/26 (85) 0,99 Sud Africa*** 154 adulti con TB, con esame colturale + 10 mm 15 HIV- 11/15 (73) 0/15 (16) 5 mm 15/15 (100) 0.09 113 non testati 72/95 (76) 18/113 (0) 10 mm 67/113 (59) 0,02 7/8 (88) 0/8 (0) 5 mm 8/8 (100) ND (5) 47/822 (6) 5 mm 23/34§§§ (74) ND Austria††† 8 adulti con TB al baseline 8 HIV+ Austria††† 822 adulti senza TB al baseline 822 HIV+ 37/775 Stati Uniti¶¶¶ 336 adulti 336 HIV+ 9/330 (3) 6/336 (2) 4 mm 7/278 (3) 0,92 Italia**** 69 candidati a terapia con TNFi†††† 69 HIV- 22/67 (33) 2/69 (3) 5 mm 18/69 (26) 0,49 Turchia§§§§ 69 candidati a terapia con TNFi 68 non noti 9/61 (15) 7/68 (10) 10 mm 37/61 (61) <0,01 Svizzera¶¶¶¶ 142 adulti con malattia autoimmune 142 non noti 17/134 (13) 8/142 (6) 5 mm 46/115 (40) <0,01 Perù***** 106 adulti con artrite reumatoide 106 non noti 45/104 (43) 2/106 (1) 5 mm 27/101 (27) 0,02 * Human immunodeficiency virus (virus dell’immunodeficienza umana). † Il test esatto di Fisher a due code è stato usato dai CDC per calcolare i valori di p. § Fonte: Brock I, Ruhwald M, Lundgren B, Westh H, Mathiesen LR, Ravn P. Latent tuberculosis in HIV positive, diagnosed by the M. tuberculosis Specific Interferon Gamma test. Respir Res 2006;7:56. ¶ Non eseguito. ** Fonte: Balcells ME, Perez CM, Chanqueo L et al. A comparative study of two different methods for the detection of latent tuberculosis in HIV-positive individuals in Chile. Int J Infect Dis 2008;12:645–52. †† Fonte: Jones S, de Gijsel D, Wallach FR, Gurtman AC, Shi Q, Sacks H. Utility of QuantiFERON-TB Gold in-tube testing for latent TB infection in HIV- infected individuals. Int J Tuberc Lung Dis 2007;11:1190–5. §§ Fonte: Luetkemeyer AF, Charlebois ED, Flores LL, et al. Comparison of an interferon-gamma release assay with tuberculin skin testing in HIV-infected individuals. Am J Respir Crit Care Med 2007;175:737–42. ¶¶ Fonte: Raby E, Moyo M, Devendra A, et al. The effects of HIV on the sensitivity of a whole blood IFN-gamma release assay in Zambian adults with active tuberculosis. PLoS ONE 2008;3:e2489. [E-pub]. Disponibile al sito http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0002489. *** Fonte: Tsiouris SJ, Coetzee D, Toro PL, Austin J, Stein Z, el-Sadr W. Sensitivity analysis and potential uses of a novel gamma interferon release assay for diagnosis of tuberculosis. J Clin Microbiol 2006;44:2844–50. ††† Fonte: Aichelburg MC, Rieger A, Breitenecker F, et al. Detection and prediction of active tuberculosis disease by a whole-blood interferon-gamma release assay in HIV-1-infected individuals. Clin Infect Dis 2009;48:954–62. §§§ Il test cutaneo tubercolinico veniva offerto solo ai soggetti con test QFT-GIT positivo. ¶¶¶ Fonte: Talati NJ, Seybold U, Humphrey B, et al. Poor concordance between interferon-gamma release assays and tuberculin skin tests in diagnosis of latent tuberculosis infection among HIV-infected individuals. BMC Infect Dis 2009;9:15. **** Fonte: Bocchino M, Matarese A, Bellofiore B, et al. Performance of two commercial blood IFN-gamma release assays for the detection of Mycobac- terium tuberculosis infection in patient candidates for anti-TNF-alpha treatment. Eur J Clin Microbiol Infect Dis2008;27:907–13. †††† Inibitore del tumor necrosis factor α. §§§§ Fonte: Cobanoglu N, Ozcelik U, Kalyoncu U, et al. Interferon-gamma assays for the diagnosis of tuberculosis infection before using tumour necrosis factoralpha blockers. Int J Tuberc Lung Dis 2007;11:1177–82. ¶¶¶¶ Fonte: Matulis G, Juni P, Villiger PM, Gadola SD. Detection of latent tuberculosis in immunosuppressed patients with autoimmune diseases: perfor- mance of a Mycobacterium tuberculosis antigen-specific interferon gamma assay. Ann Rheum Dis 2008;67:84–90. ***** Fonte: Ponce de LD, Acevedo-Vasquez E, Alvizuri S, et al. Comparison of an interferon-gamma assay with tuberculin skin testing for detection of tuberculosis (TB) infection in patients with rheumatoid arthritis in a TB-endemic population. J Rheumatol 2008;35:776–81. 24 MMWR 25 Giugno 2010 TABELLA 10. Studi pubblicati che hanno valutato il test T-SPOT.TB (T-Spot) in soggetti con immunodepressione in confronto al test cutaneo tubercolinico (TCT), quando disponibile – 8 nazioni, 2006-2008 Risultati del T-Spot Positivi Nazione Soggetti Sud Africa§ Sud Africa¶ Status HIV* N. + / N. risultati validi Risultati del TCT Indeterminati (%) N. + / N. soggetti testati (%) 20 adulti HIV+ 20 HIV+ 13/18 (72) 2/20 (10) 23 bambini HIV+ 23 HIV+ 12/23 (52) 0/23 (0) 160 adulti in una clinica per lo screening per HIV 74 HIV+ 38/73 (52) 1/74 (1) 86 HIV- 51/86 (59) 0/86 (0) 286 HIV+ 66/267 (25) 8/275 (3) 14/289 (5) 47/336 (14) 21/65 (32) 4/69 (6) 86/128 (67) 6†††/134 (5) 4/48 (8) 0/48 (0) Germania** 286 pazienti ambulatoriali HIV+ Stati Uniti†† 336 adulti HIV+ 336 HIV+ Italia§§ 69 HIV- candidati a terapia con TNFi¶¶ 69 HIV- Hong Kong*** 134 adulti con silicosi 134 non noti Germania§§§ 48 pazienti in lista d’attesa per trapianto di fegato 48 non noti Positivi Cutoff 5 mm N. + / N. soggetti testati (%) % TCT+ vs. % T-Spot+ p-value† 10/16 (63) 0,81 6/23 (26) 0,13 35/67 (52) 0,99 66/77 (86) <0,01 33/275 (12) <0,01 5 mm 7/278 (2,5) 0,21 5 mm 18/69 (26) 0,55 10 mm 92/134 (69) 0,90 5 mm 6/47 (13) 0,71 5 mm 5 mm Canada¶¶¶ 203 pazienti in emodialisi 203 non noti 72/189 (38) 14/203 (7) 10 mm 19/203 (9) <0,01 Italia**** 138 pazienti con malattia ematologica 138 HIV- 61/129 (47) 6/135 (4) 5 mm 24/122 (20) <0,01 Stati Uniti†††† 49 detenuti con storia di IVDU§§§§ (su 390 in totale nello studio) 49 non noti 17/49 (35) 0/49 (0) 10 mm 6/49 (12) 0,02 Grecia¶¶¶¶ 70 HIV- candidati a terapia con TNFi 70 HIV- 16/70 (23) 0/70 (0) 5 mm 27/70 (39) 0,07 * Human immunodeficiency virus (virus dell’immunodeficienza umana). † Il test esatto di Fisher a due code è stato usato dai CDC per calcolare i valori di p. § Fonte: Mandalakas AM, Hesseling AC, Chegou NN, et al. High level of discordant IGRA results in HIV-infected adults and children. Int J Tuberc Lung Dis 2008;12:417–23. ¶ Fonte: Rangaka MX, Wilkinson KA, Seldon R, et al. Effect of HIV-1 infection on T-Cell-based and skin test detection of tuberculosis infection. Am J Respir Crit Care Med 2007;175:514–20. ** Fonte: Stephan C, Wolf T, Goetsch U, et al. Comparing QuantiFERON-tuberculosis gold, T-SPOT tuberculosis and tuberculin skin test in HIVinfected individuals from a low prevalence tuberculosis country. AIDS 2008;22:2471–9. †† Fonte: Talati NJ, Seybold U, Humphrey B, et al. Poor concordance between interferon-gamma release assays and tuberculin skin tests in diagnosis of latent tuberculosis infection among HIV-infected individuals. BMC Infect Dis 2009;9:15. §§ Fonte: Bocchino M, Matarese A, Bellofiore B, et al. Performance of two commercial blood IFN-gamma release assays for the detection of Mycobacterium tuberculosis infection in patient candidates for anti-TNF-alpha treatment. Eur J Clin Microbiol Infect Dis2008;27:907–13. ¶¶ Inibitore del tumor necrosis factor α. *** Fonte: Leung CC, Yam WC, Yew WW, et al. Comparison of T-Spot.TB and tuberculin skin test among silicotic patients. Eur Respir J 2008;31:266–72. ††† §§§ Riclassificati con un secondo test. ¶¶¶ Fonte: Passalent L, Khan K, Richardson R, Wang J, Dedier H, Gardam M. Detecting latent tuberculosis infection in hemodialysis patients: a head-to-head comparison of the T-SPOT.TB test, tuberculin skin test, and an expert physician panel. Clin J Am Soc Nephrol 2007;2:68–73. **** Fonte: Piana F, Codecasa LR, Cavallerio P, et al. Use of a T-cell-based test for detection of tuberculosis infection among immunocompromised patients. Eur Respir J 2006;28:31–4. †††† Fonte: Porsa E, Cheng L, Graviss EA. Comparison of an ESAT-6/CFP-10 peptide-based enzyme-linked immunospot assay to a tuberculin skin test for screening of a population at moderate risk of contracting tuberculosis. Clin Vaccine Immunol 2007;14:714–9. §§§§ Intravenous-drug user (soggetti che fanno uso di sostanze stupefacenti per via endovenosa) ¶¶¶¶ Fonte: Vassilopoulos D, Stamoulis N, Hadziyannis E, Archimandritis AJ. Usefulness of enzyme-linked immunospot assay (elispot) compared to tuberculin skin testing for latent tuberculosis screening in rheumatic patients scheduled for anti-tumor necrosis factor treatment. J Rheumatol 2008;35:1271–6. Fonte: Lindemann M, Dioury Y, Beckebaum S, et al. Diagnosis of tuberculosis infection in patients awaiting liver transplantation. Hum Immunol 2009;70:24–8. Vol. 59 / RR-5 Recommendations and Reports 25 IGRA Expert Committee Members Membership as of August 2008 Chair: Neil Schluger, MD, Columbia University, New York, New York Moderator: John Seggerson, Stop TB USA, Atlanta, GA Members: Paul Barnicott, U.S. Air Force School of Aerospace Medicine, San Antonio, Texas; John Bernardo, MD, Boston University School of Medicine, Boston, Massachusetts; Henry M. Blumberg, MD, Emory University School of Medicine, Atlanta, Georgia; Helene Calvet, MD, Long Beach Dept. of Health and Human Services, Long Beach, California; Charles Daley, MD, National Jewish Medical and Research Center, Denver, Colorado; Susan Dorman, MD, Johns Hopkins University School of Medicine, Baltimore, Maryland; Edward Graviss, PhD, Baylor College of Medicine, Houston, Texas; Tiffany Harris, PhD, New York City Dept. of Health and Mental Hygiene, New York, New York; Philip Hill, MD, University of Otago School of Medicine, Dunedin, New Zealand; Masae Kawamura, MD, San Francisco Department of Public Health, San Francisco, California; Lisa Keep, MD, Uniformed Services Univ. of the Health Sciences, Bethesda, Maryland; Stephen Kralovic, MD, Cincinnati VA Medical Center, Cincinnati, Ohio; Michael Leonard, MD, Georgia Department of Human Resources, Atlanta, Georgia; David Lewinsohn, MD, PhD, Oregon Health and Sciences University, Portland VA Medical Center, Deborah Lewinsohn, MD, Oregon Health and Sciences University, Portland, Oregon; Kathleen Moser, MD, San Diego County Department of Health, Poway, California; Edward Nardell, MD, Brigham and Women’s Hospital, Boston, Massachusetts; Masa Narita, MD, Seattle and King County Public Health, Seattle, Washington; Richard O’Brien, MD, Foundation for Innovative New Diagnostics, Geneva, Switzerland; Randall Reves, MD, Denver Public Health Department, Denver, Colorado; Luca Richeldi, MD, PhD, University of Modena and Reggio Emilia, Modena, Italy; Kim Connelly Smith, MD, University of Texas Health Science Center, Jeffery Starke, MD, Texas Children’s Hospital, Baylor College of Medicine, Houston, Texas; David Warshauer, PhD, Wisconsin State Laboratory of Hygiene, Madison, Wisconsin; Gail Woods, MD, Central Arkansas Veterans Healthcare System, Little Rock, Arkansas. IGRA Expert Committee Presenters Membership as of August 2008 Members: Sandra Arend, MD, PhD, Leiden University Medical Center, Leiden, The Netherlands; John Bernardo, MD, Boston University School of Medicine, Boston, Massachusetts; Henry M.Blumberg, MD, Emory University School of Medicine, Atlanta, Georgia; Charles Daley, MD, National Jewish Medical and Research Center, Denver, Colorado; Roland Diel, MD, University of Dűsseldorf, School of Public Health, Dűsseldorf, Germany; Edward Graviss, MD, Baylor College of Medicine, Houston, Texas; Tiffany Harris, PhD, New York City Dept. of Health and Mental Hygiene, New York, New York; Anthony Hawkridge, MD, Aeras Global TB Vaccine Foundation, Cape Town, South Africa; Philip Hill, MD, University of Otago School of Medicine, Dunedin, New Zealand; Masae Kawamura, MD, San Francisco Department of Public Health, San Francisco, California; Deborah Lewinsohn, MD, Portland VA Medical Center, David Lewinsohn, MD, PhD, Oregon Health and Sciences University, Portland, Oregon; Hassan Mahomed, Mmed, University of Cape Town, Cape Town, South Africa; Freddie Poole, MS, Center for Devices and Radiological Health, Food and Drug Administration, Rockville, Maryland; Luca Richeldi, MD, PhD, University of Modena and Reggio Emilia, Modena, Italy; James Rothel, PhD, Cellestis Limited, Carnegie, Victoria, Australia; Neil Schluger, MD, Columbia University, New York, New York; John Seggerson, STOP TB USA, Atlanta, Georgia; Kim Connelly Smith, MD, University of Texas Health Science Center, Houston, Texas; Peter Wrighton-Smith, DPhil, Oxford Immunotec, Inc., Oxford, United Kingdom; Jean-Pierre Zellweger, MD, Swiss Lung Association, Lausanne, Switzerland; Kenneth Castro, MD, John Jereb, MD, Gerald Mazurek, MD, CDC, Atlanta, Georgia. Traduzione del testo inglese a cura di Dott.ssa Stefania Cerri Dipartimento ad Attività Integrata di Oncologia, Ematologia e Patologie dell’Apparato Respiratorio Clinica di Malattie dell’Apparato Respiratorio Azienda Ospedaliero-Universitaria di Modena MMWR The Morbidity and Mortality Weekly Report (MMWR) Series is prepared by the Centers for Disease Control and Prevention (CDC) and is available free of charge in electronic format. To receive an electronic copy each week, visit MMWR’s free subscription page at http://www.cdc.gov/mmwr/mmwrsubscribe.html. Paper copy subscriptions are available through the Superintendent of Documents, U.S. Government Printing Office, Washington, DC 20402; telephone 202-512-1800. Data presented by the Notifiable Disease Data Team and 122 Cities Mortality Data Team in the weekly MMWR are provisional, based on weekly reports to CDC by state health departments. Address all inquiries about the MMWR Series, including material to be considered for publication, to Editor, MMWR Series, Mailstop E-90, CDC, 1600 Clifton Rd., N.E., Atlanta, GA 30333 or to [email protected]. All material in the MMWR Series is in the public domain and may be used and reprinted without permission; citation as to source, however, is appreciated. Use of trade names and commercial sources is for identification only and does not imply endorsement by the U.S. Department of Health and Human Services. References to non-CDC sites on the Internet are provided as a service to MMWR readers and do not constitute or imply endorsement of these organizations or their programs by CDC or the U.S. Department of Health and Human Services. CDC is not responsible for the content of these sites. URL addresses listed in MMWR were current as of the date of publication. U.S. Government Printing Office: 2010-623-026/41257 Region IV ISSN: 1057-5987
Scaricare