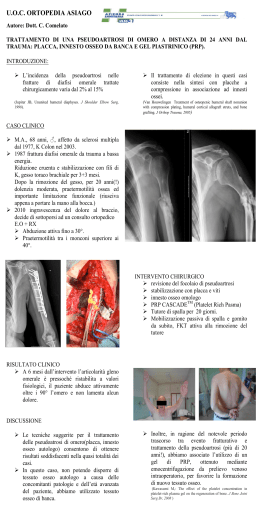
Lezione 1 Il tessuto osseo, osteogenesi, riparazione diretta ed indiretta; pseudo artrosi e ritardi di consolidazione trattamento. Giuseppe M. Peretti Istituto Ortopedico Galeazzi, Milan, Italy Università degli Studi di Milano, Italy Human morphology: general organization of bone tissue; the bone tissue as living ecosystem Giuseppe M. Peretti [email protected] The bone tissue - functions Mechanical function of support Mechanical function of protection of the internal organs Function of providing motion to the joints Storage site for calcium and phosphate (mineral homeostasis) Skeleton homeostasis Hematopoietic function 1 Long bones 2 The bone tissue Is alive!! Organic component of the bone matrix: • Osteocytes, osteoblasts, osteoclasts and osteoprogenitor cells • Collagen • Other organic proteins Mineral component: • Calcium and phosphate provide bone’s hardness • Bone tissue represents the storage site of many minerals and ions The bone tissue Is made of an organic component and an inorganic mineral component 3 The bone tissue The bone tissue Is made of an inorganic component (mineralized bone matrix) in which some cavities are present (lacunae), from which the interconnecting canaliculi originate. The lacunae contain the osteocytes; the canaliculi contain the cytoplasmic processes Other larger cavities contain blood vassels, nerves and bone marrow Types of bone tissues Lamellar bone 4 Types of bone tissues Lamellar bone Nonlamellar bone Lamellar bone Cortical or compact bone Spongy or trabecular bone Lamellar bone Compact or cortical bone 5 Lamellar bone Compact or cortical bone Spongy or trabecular bone Lamellar bone Spongy or trabecular bone Lamellar bone In the mammalian skeleton is largely the prevalent type in the postnatal life It possesses high mechanical potential in the resistance to pressure, traction and torsion, with a minimum weigh This is due both to the physical properties of the extracellular matrix and to its general architecture: the lamellar structure of the matrix In each lamella, the collagen fibers have generally a parallel orientation. This orientation is different to that of the fibers of an adjacent lamella The adjacent lamellae are connected by mineralized matrix, which is crossed by a randomly oriented collagen fibers 6 Lamellar bone In the mammalian skeleton is largely the prevalent type in the postnatal life It possesses high mechanical potential in the resistance to pressure, traction and torsion, with a minimum weigh This is due both to the physical properties of the extracellular matrix and to its general architecture: the lamellar structure of the matrix In each lamella, the collagen fibers have generally a parallel orientation. This orientation is different to that of the fibers of an adjacent lamella The adjacent lamellae are connected by mineralized matrix, which is crossed by a randomly oriented collagen fibers The concentric Haversian system (osteons) The concentric Haversian system (osteons) 7 The concentric Haversian system (osteons) The lamellar bone tissue Compact or cortical bone Spongy or trabecular bone 8 Spongy or trabecular bone tissue Constitutes the bulk of the short bones, of the epiphysis of the long bones and it is located in the central portion of the flat bones The trabeculae are arranged into a predominant direction in order to respond in each single skeleton portion to the mechanical stimuli which act on it Spongy or trabecular bone tissue Is formed by layers of lamellae arranged into trabeculae having different thickness and in some way anastomosed. The spaces within the meshwork are continuous and are occupied by marrow and blood vessels Nonlamellar bone tissue Interlacing arrangement of collagen fibers (woven bone; immature bone; bundle bone ) Parallel collagen fibers 9 Nonlamellar bone tissue with interlacing arrangement of collagen fibers (woven bone; immature bone; bundle bone) Random arrangement of collagen fibers It possesses lower mechanical strength It represent the mature skeleton of inferior vertebrate (amphibians) It is the initial bone of the Mammalian (fetal bones), which is lately substituted by lamellar bone It can persist in the adult • in the suture joints, where the periosteum firmly adheres to the bone • at the ligament or tendon insertion, close to the joint surfaces • to some extent, in correspondence to the cementum of the tooth It also forms in the conditions of rapid neo-deposition of bone, as in the fracture repair or in the Paget disease Nonlamellar bone tissue with parallel collagen fibers Characteristic of birds. Rare and transitory in mammalian: it can persist only in the insertion areas of tendons, originating from their mineralization Human morphology: The cells of the bone tissue Giuseppe M. Peretti [email protected] 10 The cells of the bone tissue Mesenchymal origin Osteoprogenitor cells Cells with mitotic capacity. These cells derive from the mesenchymal stem cells; they give rise to the osteoblasts Osteoblasts An osteoblasts is a cell that secretes osteoid or bone matrix 11 Osteoblasts An osteoblasts is a cell that secretes osteoid or bone matrix Osteoblasts Once the cells is surrounded with its secreted matrix, it is referred to as an osteocyte Osteoblasts The osteoblasts is a cell that secretes osteoid or bone matrix Goldner’s trichrome of osteoblasts Presence of a layer of unmineralized bone matrix (osteoid) between the cell membrane and the mineralized matrix 12 Osteocytes They originate from the osteoblasts Once the osteoblast is surrounded with its secreted matrix, it is referred to as an osteocyte Osteocytes The cell body is located in cavities of the matrix, called lacunae From the lacunae, thin branched canaliculi originate to all directions, which contain the cellular processes of the osteocytes The canaliculi are interconnected with other coming from the adjacent lacunae Some of these end to the bone tissue vascularized surfaces (Haversian canals and bone marrow spaces) Osteocytes possess a higher nucleus/cytoplasm ratio and a lower number of cytoplasmic organelles Osteocytes are located between lamellae and concentrically around the central lumen of the osteon 13 14 Osteoclasts The osteoclasts are bone-resorbing cells present on bone surface where bone is being re moved or remodeled (reorganized) or where bone has been damaged Osteoclasts Osteoclasts are large (20-100 microns) multinucleated cells They are derived from the fusion of mononuclear hemopoietic progenitor cells that give rise to granulacytes, monocytes and macrophages Monocytes are mononuclear; macrophages and osteoclasts are derived from the fusion of mononuclear cells They are located in bone resorption areas, called Howship’s lacunae Osteoclasts are highly polarized cells with scarce endoplasmic reticulum, reduced number of vesicles and well represented mitochondria They present a ruffled border activity Osteoclasts 15 Osteoclasts Osteoclast in Howship’s lacuna Osteoclasts Osteoclasts Ruffled border 16 Human morphology: the bone remodeling Giuseppe M. Peretti [email protected] Bone remodeling Growth of long bones modeling Growing shaft is modeled by: 17 Bone: Modeling and remodeling • remodeling – removes older bone and replaces with new bone – prevents accumulation of fatigue damage – draws calcium from bones to be used metabolically elsewhere – accomplished by teams of about 10 osteoclasts and several hundred osteoblasts that work together in “basic multicellular units” (BMUs) Bone: Modeling and remodeling • remodeling (cont.) – three stages in BMU’s lifetime (ARF) • Activation • Resorption • Formation – resorption in the form of a tunnel or ditch about 200 µm in diameter at a rate of 40 µm/day – mesenchymal cells differentiate into osteoblasts Remodeling in cortical bone Remodeling in trabecular bone 18 Bone: Modeling and remodeling • remodeling (cont.) – osteoblasts fill the tunnel with osteoid tissue at a rate of 0.5 µm/day – resorption lasts for 3 weeks – remodeling sequence lasts for 4 months – BMU’s replace 5% of cortical bone and 25% of trabecular bone each year Remodeling in cortical bone Remodeling in trabecular bone Remodeling in cortical bone 19 Bone: Modeling and remodeling • remodeling (cont.) – in trabecular bone – three stages in BMU’s lifetime (ARF) • Activation • Resorption • Formation – resorption in the form of ditch at a rate of 40 µm/day – mesenchymal cells differentiate into osteoblasts Remodeling in trabecular bone Ca 2+/PO4 collagen osteoclast osso Resorption area Bone resorption osteoblasts collagen+Ca/PO4 Bone deposition 20 Cutting cone Cutting cone 21 Human morphology: the osteogenesis Giuseppe M. Peretti [email protected] Formation of the Bony Skeleton • Begins at week 8 of embryo development • Intramembranous ossification – bone develops from a fibrous membrane • Endochondral ossification – bone forms by replacing hyaline cartilage Intramembranous Ossification 22 Stages of Intramembranous Ossification Stages of Intramembranous Ossification Stages of Intramembranous Ossification 23 Stages of Intramembranous Ossification Stages of Intramembranous Ossification • An ossification center forms within the connective tissue in the center of the membrane • Bone matrix is secreted • Immature bone and periosteum form • A bone collar forms made of compact bone; bone marrow forms Endochondral Ossification • Begins in the second month of development and forms all bones below the skull except for the clavicles • Uses hyaline cartilage “bones” as models for bone construction • Requires breakdown of hyaline cartilage prior to ossification 24 Stages of Endochondral Ossification Stages of Endochondral Ossification Secondary ossification center Epiphyseal blood vessel Deteriorating cartilage matrix Hyaline cartilage Spongy bone formation Primary ossification center Bone collar Articular cartilage Spongy bone Epiphyseal plate cartilage Medullary cavity Blood vessel of periosteal bud 1 Formation of bone collar around hyaline cartilage model. 2 Cavitation of the hyaline cartilage within the cartilage model. 3 Invasion of internal cavities by the periosteal bud and spongy bone formation. 4 Formation of the medullary cavity as ossification continues; appearance of secondary ossification centers in the epiphyses in preparation for stage 5. 5 Ossification of the epiphyses; when completed, hyaline cartilage remains only in the epiphyseal plates and articular cartilages Stages of Endochondral Ossification 25 Stages of Endochondral Ossification Stages of Endochondral Ossification • Initially, osteoblasts secrete osteoid, creating a bone collar around the diaphysis of the hyaline cartilage model • Cartilage in the center of the diaphysis calcifies and deteriorates, forming cavities • The periosteal bud invades the internal cavities and spongy bone forms around the remaining fragments of hyaline cartilage • The diaphysis elongates as the cartilage in the epiphyses continues to lengthen and a medullary cavity forms through the action of osteoclasts within the center of the diaphysis; The epiphyses ossify shortly after birth through the development of secondary ossification centers • Ossification of the epiphyses, with hyaline cartilage remaining only in the epiphyseal plates and articular surface Human morphology: bone fracture repair (reparative osteogenesis) Giuseppe M. Peretti [email protected] 26 What is a fracture? • SOFT TISSUE INJURY complicated by a broken bone By Bakota & Staresinic Mechanically overloadedBone fractures • Interruption of - Circulation - Force transmission • Bone tissue damage -Crack (gap) -Separation -Fragmentation -Impaction By Bakota & Staresinic Why does the broken bone heal? A broken bone heals because… it is broken! Mr. Alan Apley By Bakota & Staresinic 27 Bone Healing Result of complex interactions -Mechanical factors -Molecular and biological factors -cellular -local -systemic By Bakota & Staresinic How does the bone heal properly? • It needs: Favorable biological and mechanical environment By Bakota & Staresinic Proper bone healing • Needs: -Blood supply -Adequate mechanical stability -relative stability - with callus formation (secondary bone healing) -absolute stability –without callus formation (primary bone healing) By Bakota & Staresinic 28 Bone healing -relative stability - with callus formation (secondary bone healing) -absolute stability –without callus formation (primary bone healing) Stages in the secondary bone healing haematoma osteoblasts periosteum endosteum osteoblasts Inflammation phase Immediately following trauma, haematoma forms as a result of the rupture of the vessels located in bone, in the periosteum and around the fracture area. The bone at the fracture margins undergoes necrosis. Leukocytes, macrophages, mast cells and fibroblasts infiltrate the blood clot and provide for the removal of the necrotic bone. The exact mechanism which induces the fracture consolidation remains unknown mins - hrs Stages in the secondary bone healing Fibrous callus phase Organized clot for the presence of collagen fibers and vessels: Vessel neoformation, but PO2 remains low and the pH is acidic. Proliferation of bone precursor cells and osteoblasts from the cambium layer of the periosteum and from endosteum. Additionally, in the clot osteoblasts and chondroblastsappear of mesenchymal origen. Fibrous callus formation, made of osteoid, cartilage and collagen Cartilage osteoid Organized haematoma days- weeks 29 Stages in the secondary bone healing Fibrous bone Bone callus phase Mineralization of the osteoid and cartilage of the fibrous periostal external callus and endosteal internal callus and transformation into woven primary immature bone Cartilage weeks Stages in the secondary bone healing Remodeling phase The osteoclast and osteoblast activity transforms the woven immature bone into lamellar bone. Regain of the original shape of the bone segment; even an angulation could be partially or totally regained. The PO2 returns to normal Osteoclasts months - years 30 Stages in the secondary bone healing By Bakota & Staresinic Stages in the Healing of a Bone Fracture Remodeling phase The osteoclast and osteoblast activity transforms the woven immature bone into lamellar bone. Regain of the original shape of the bone segment; even an angulation could be partially or totally regained. The PO2 returns to normal Osteoclasts Bone healing -relative stability - with callus formation (secondary bone healing) -absolute stability –without callus formation (primary bone healing) 31 Primary-direct fracture healing • Direct bone healing • No callus • How? By Bakota & Staresinic Primary bone healing Primary bone healing Fracture line Area below If fracture segments are in compression in order to avoid any reciprocal movements, bone callus does not form. Necrotic bone in the fracture area does not get resorbed, but is substituted by the haversian systems Repair mechanism by primary bone healing Necrotic Osteoclast bone activity Neoformed Fracture vessels line Osteoid Newly formed lamella Osteoblasts Osteoclasts dig tunnels in the necrotic bone of the fracture area and, through the fracture line in the opposite bone segment: Osteoblasts invade these tunnels and deposit new lamellae, forming new osteons. Therefore, the bone continuity has regained Primary-direct fracture healing 32 Direct contact healing across fracture • Immobilised contact zone crossed by osteoclasts • Stiffness & strength simultaneously By Bakota & Staresinic Contact healing By Bakota & Staresinic Direct bone healing • Slow • ¼ remodelled after 3 months • 1 µm/day By Bakota & Staresinic 33 Primary bone healing vs secondary bone healing Fracture repair by primary bone healing X-Ray shows no callus f ormation Fracture repair by secondary bone healing X-Ray shows abundant callus f ormation Summary • Bone will heal naturally from indirect healing, but possibly non anatomically correct • Implants stabilize fractures to aid direct / indirect healing Molecules in fracture healing Mouse tibia fracture callus on day 7 Vortkamp A, Peretti GM et al. MOD 1998 34 Intramembranous Ossification Endochondral ossification Stages in the secondary bone healing Intramembranous ossification Mesenchymal cells periosteum endosteum osteoblasts haematoma osteoblasts Inflammation phase Immediately following trauma, haematoma forms as a result of the rupture of the vessels located in bone, in the periosteum and around the fracture area. The bone at the fracture margins undergoes necrosis. Leukocytes, macrophages, mast cells and fibroblasts infiltrate the blood clot and provide for the removal of the necrotic bone. The exact mechanism which induce the fracture consolidation remains unknown mins - hrs 35 Endochondral ossification Osteoblasts Chondrocytes Summary • Bone will heal naturally from indirect healing, but possibly non anatomically correct • Implants stabilize fractures to aid direct / indirect healing • Repair process is accomplished by the recapitulation of signals regulating embryonic bone formation Lezione 1 Pseudo artrosi e ritardi di consolidazione trattamento. Giuseppe M. Peretti Istituto Ortopedico Galeazzi, Milan, Italy Università degli Studi di Milano, Italy 36 Disturbi di consolidazione delle fratture • Ritardo di consolidazione • Non unione o Pseudoartrosi Ritardo di consolidazione • Frattura che non ha consolidato nel tempo normale per tipo e sede di frattura ed età del paziente op Per ritardo di consolidazione di una frattura si intende una frattura non consolidatasi in un ragionevole lasso di tempo (che varia da 16 a 18 settimane) in cui la guarigione progredisce più lentamente della media, a seconda dell’età del paziente e della frattura stessa. I primi a descrivere sistematicamente questa problematica furono Watson e Jones nel 1955 chiamandola lenta unione. In questa condizione la linea di frattura resta visibile radiograficamente ma non vi è una netta separazione dei frammenti, calcificazione o sclerosi. Tale condizione è comunque considerata come una variazione nel fisiologico processo riparativo. La non guarigione è sia di tipo clinico (dolore pressorio, sotto stress e al carico) che radiografico (assenza di callo “a ponte”, non scomparsa della linea di frattura in almeno due corticali su quattro) 37 Pseudoartrosi • Frattura non consolidata e non consolidabile nel tempo se non con l’ausilio di interventi chirurgici mirati By Bakota & Staresinic Con il termine pseudoartrosi si intende una non unione in atto da diversi m esi (più di 6) in cui spesso si forma una pseudo cavità articolare con versamento tra i monconi della frattura in corso di arresto del processo riparativo. Per poter affermare con sicurezza la presenza di una non unione è necessario che que sta venga documentata clinicamente e radiologicamente nel tempo per almeno tre mesi. La FDA americana in quadra la pseudoartrosi come l’esito di una frattura verificatasi almeno 9 mesi prima che non ha mostrato segni di pro gressione verso la guarigione per almeno 3 mesi consecutivi. Secondo Muller invece è il fallimento di guarigione di una frattura (es. tibia) dopo 8 mesi senza alcun tipo di trattamento effettuato Watson-Jones R, Bonin JG, King T et al. Medullary nailing of fractures after fifty years: with a review of the difficulties and complication after operation. J Bone Joint Surg Br 1950;32-B(4):694-729. USFDA. Guidance document for the preparation of investigational device exemptions and pre-market approval application for bone growth stimulator devices. Rockville, United States Food and Drug Administration 1988. Marsh D. Concepsts of fracture union, delayed union and nonunion. Clinical Orth Rel Research 1998;355S:S22-S30. Pseudoartrosi •I frammenti della lesione ossea risultano uniti da tessuto fibrocartilagineo delimitato da membrana sinoviale. •Rimangono ancora mobili l’uno rispetto all’altro venendo a creare una “falsa articolazione”, da cui deriva il termine che definisce la patologia. •Permangono deformità associate sul piano frontale, sagittale, assiale 38 Occasionalmente la formazione di tessuto fibroso e cartilagineo denso può stabilizzare la frattura creando una cosiddetta unione fibrosa che tuttavia non riesce mai a ripristinare la normale meccanica dell’osso. La pseudoartrosi si realizza in genere dopo una lesione traumatica a elevata energia, come una frattura esposta con perdita ossea segmentale ma può presentarsi anche in maniera imprevedibile dopo un trattamento apparentemente adeguato di una frattura semplice, teoricamente destinata alla guarigione. Nel 90%-95% dei casi le fratture guariscono senza problemi; le pseudoartrosi complicano una modesta percentuale di lesioni nelle quali il normale percorso evolutivo verso la riparazione ossea non risulta capace di compensare il danno biologico locale e meccanico che ha coinvolto il focolaio. Diagnosi • Clinica • Strumentale: - Radiografia - Tomografia Computerizzata - Risonanza Magnetica Diagnosi clinica • Dolore • Limitazione funzionale • Instabilità • Alterazioni cutanee 39 RX • Almeno 2 proiezioni (AP, Lat-Lat, assiale, ecc) Radiograficamente i monconi di frattura appaiono separati tra loro, con bordi arrotondati, levigati e sclerotici (eburneizzazione). La mobilità dei capi ossei può essere mostrata dalla fluoroscopia o da proiezioni radiografiche sotto stress. Uno studio radiografico accurato rappresenta un passaggio fondamentale nella diagnostica e nel follow-up dei ritardi di consolidazione delle fratture in cui l’interpretazione di criteri clinici e radiologici necessitano della collaborazione tra il radiologo e l’ortopedico. TC Schepers et al. Calcaneal nonunion: three cases and a review of the literature. Archives of Orthopaedic and Trauma Surgery Vol 128 -7 40 RM Albuquerque, Rodrigo Pires e et al. Artroplastia total do joelho em paciente com pseudoartrose de fratura de Hoffa: relato de caso. Rev. bras. ortop. 2011, vol.46, n.4, pp. 460-463. Cause di pseudoartrosi • • • Fattori biologici Fattori meccanici Fattori combinati Frost, H.M. The biology of fracture healing: an overview for clinicians. Part I and II. Clin Orthop Rel Res 1989;248:283-309. Cause di pseudoartrosi La comparsa di un’anomalia qualitativa o temporale nel processo di bone healing è di solito essenzialmente riconducibile a cause biologiche o meccaniche; raramente riconosciamo una sola componente, dal momento che, nella maggior parte dei casi, i due fattori interagiscono nel determinare una pseudoartrosi. In particolare Frost ha quantificato le cause che impediscono la consolidazione ossea in: • biologiche (20%) • meccaniche (50%) • combinate (30%) cause meccaniche e biologiche insieme. 41 Fattori biologici • • Fattori locali Fattori sistemici In generale diversi fattori biologici portano ad un’insufficiente attivazione del pool di cellule staminali osteoprogenitrici ed a mancata finalizzazione del processo osteogenetico per assenza di BMPs o fattori di crescita specifici per l’osteogenesi Fattori biologici • Fattori locali • • • caratteristiche della frattura infezioni patologie circolatorie distrettuali ed eventi traumatici Tra le cause biologiche locali riconosciamo: • caratteristiche della frattura: la sede diafisaria specie in segmenti con scarsa vascolarizzazione parostale, il tipo di frattura trasversa, la scomposizione della frattura, la plurifocalità della frattura nello stesso segmento osseo, la comminuzione e la presenza di ferite esposte • infezioni: predispongono a un rischio molto più elevato di pseudoartrosi determinando una risposta infiammatoria esuberante in grado di attivare i processi di riassorbimento osseo; • patologie circolatorie distrettuali artero-venose e linfatiche ed eventi traumatici a carico dei tessu ti locali e del periostio: rappresentano un’importante fattore di rischio in quanto la presenza di un ’adeguata vascolarizzazione locale è fondamentale per un corretto bone healing. Fattori biologici • • Fattori locali Fattori sistemici • • Alterata microcircolazione Alterato metabolismo osseo Tra le cause sistemiche riconosciamo una problematica data da tutte quelle patologie in cui vi sia: • alterata microcircolazione (es. diabete, età avanzata, fumo, alchool, condizioni generali scadenti o malnutrizione); • alterato metabolismo osseo (osteoporosi, terapia con corticosteroidi, malattie del metabolismo osseo, insufficienza renale, tumori, abuso di alcool). A queste situazioni si aggiungono fattori generali fisiologici dati dall’ avanzare dell’ età, ad esempio infatti lo spessore e la cellularità del periostio si riducono nel tempo. 42 Fattori meccanici • Malriduzione • Sintesi instabile • Sintesi troppo rigida • Sintesi non bilanciata • Inappropriato posizionamento dell’impianto Cause di mancata guarigione • • • Relative al paziente Relative alla frattura Relative al trattamento Cause di mancata guarigione • • • Relative al paziente Relative alla frattura Relative al trattamento a) Età: maggiore frequenza nell’anziano. b) Stati di denutrizione o cattiva alimentazione. c) Dipendenze: fumo, alcol. d) Malattie metaboliche: iperparatiroidismo, carenza vitaminica. e) Farmaci: chemioterapici, antiriassorbitivi 43 Cause di mancata guarigione • • • Relative al paziente Relative alla frattura Relative al trattamento a) Frammenti non a contatto: cattiva riduzione, interposizione di tessuti molli. c) Perdita di frammenti: fratture esposte con perdita di sostanza. d) Infezione e) Cattiva circolazione sanguigna: danno ai tessuti muscolari e cutanei circostanti Cause di mancata guarigione • • • Relative al paziente Relative alla frattura Relative al trattamento a) Riduzione inadeguata. b) Immobilizzazione insufficiente sia nei tempi che nei modi c) Improprio trattamento chirurgico: mezzi di sintesi inadeguati o male applicati Classificazioni • Infezione – Nonunion asettica – Nonunion settica • Sede – Diafisaria – Metafisaria • Intraarticolare • Extraarticolare • Callo osseo – Ipertrofico – Oligotrofico – Atrofico • Vitalità tessuto osseo 44 Nonunion ipertrofica • Attività biologica: presente • Stabilità meccanica: scarsa • RX: a) elephant foot b) horse hoof • Trattamento: – Garantire stabilità – Correggere deformità assiali eventuali – Non necessità di trapianto osseo AO Priciples of fractures healing Nonunion atrofica • • • • Attività biologica: scarsa Stabilità meccanica: assente Vascolarizzazione: presente Possibile assenza di trasmissione del carico • Trattamento: – Garantire stabilità – Trapianto osseo – Terapia biofisica – Biotecnologie AO Priciples of fractures healing Nonunion avascolare/non vitale • • • • Attività biologica: assente Stabilità meccanica: assente Vascolarizzazione: assente Riassorbimento e perdita d’osso • Trattamento: – Garantire stabilità – Trapianto osseo – Ricostruzioni complesse AO Priciples of fractures healing 45 Creazione di pseudoartrosi in modelli animali • Con interposizione di materiale estraneo • Con sanguinamento quotidiano • Con osteosintesi instabile • Senza osteosintesi • Con sottrazione di sostanza ossea • Con distrazione dei segmenti • Con asportazione del periostio Creazione di pseudoartrosi in modelli animali Patric Garcia et al. Development of a Reliable Non-Union Model in Mice. Journal of Surgical Research Volume 147, Issue 1, 1 June 2008, Pages 84–91 Criteri di trattamento • Causa del ritardo di consolidazione/pseudoartrosi • Sede e tipo di frattura • Sistema di fissazione utilizzato • Comorbidità 46 Criteri di trattamento Criteri di trattamento Calori GM et al: Classification of non-union: need for a new scoring system? Injury. 2008 Sep;39 Suppl 2:S59-63 The total score would then be multiplied by 2. We would then suggest that scores from 0 to 25 would be considered straightforward non-unions and should respond well to standard treatments. Scores from 26 to 50 would require more specialized care to be considered. For patients with scores from 51 to 75, specialized care and specialized treatments should be sought. Finally, patients with scores above 75 may be candidates for consideration for primary amputation. Nonunion asettica - Trattamento Obiettivi: • Eliminazione dolore • Recupero funzionalità • Consolidazione ossea Nella gran parte delle casistiche sono riportate elevate % di guarigione con intervento chirurgico ricostruttivo one-step con applicazione di bone graft autologo. Da favorire rispetto a: • Protesi • Amputazione • Artrodesi 47 Trattamento conservativo • Controllo del dolore (antidolorifici) • Riduzione dello stress meccanico (diminuzione del carico, apparecchio gessato) • Controlli RX seriati (3-6 settimane) • Terapia biofisica Trattamento chirurgico • Fornire stabilità • Correzione deformità • Ricostruzione • Applicazione stimolo biologico (fattori di crescita, BMPs, MSC, …) Stabilizzazione La stabilità meccanica permette la mineralizzazione dell’osteoide e della cartilagine del callo fibroso • Fissazione interna – Placca / viti – Chiodo endomidollare alesato bloccato • Fissazione esterna 48 Placca / viti • Compressione interframmentaria • Applicazione di ev stimolo biologico Indicazioni: • Nonunion metafisaria e diafisaria • Assenza di canale • Mezzi di sintesi da sostituire Kumar, 2013 Chiodo endomidollare • Chiodo EM alesato bloccato • Nonunion diafisaria arto inferiore • Ottima stabilità • Rapida mobilizzazione • Deambulazione precoce AO Priciples of fractures healing Liodakis, 2010 Fissazione esterna - Ilizarov • • • • Distrazione osteogenetica Associazione ev. con bone grafts Nonunion avascolare con difetti ossei > 4-5 cm Nonunion settica Zamani, 2009 49 Decorticalizzazione • Frammenti ossei ottenuti dalla porzione esterna della corticale diafisaria, attaccati al periostio • Area di decorticalizzazione estesa 2-4 cm prox/dist • Letto vascolarizzato per osso spongioso autologo • Nonunion atrofica e avascolare AO Priciples of fractures healing Scaffold (I) 1. Matrice ossea demineralizzata (DBM, collagene + proteine non collageniche) • Ottenuta dalla demineralizzazione della corticale di ossa lunghe • Potenziale osteogenico (BMPs, TGFβ e IGF) • Osteoconduttività; scarsa osteoinduttività • Carrier: sodio ialuronato Scaffold (II) 2. Sostituti di sintesi • Idrossiapatite, idrossiapatite corallina, tricalcio fosfato (TCP) e calcio fosfato bifasico (BCP = HA+TCP) • Osteoconduttività • Svantaggi: – Posizione difficilmente mantenuta – Lungo tempo per riassorbimento e completa sostituzione con osso – Impossibilità di colmare gap ossei importanti Ceramisys 50 Scaffold (III) 3. Sostituti biologici: • Allograft (morcellizzato, stecche); Xenograft (bovino, equino, suino) – – – • Reazioni immunitarie Osteoconduttività Non de-mineralizzazione Autograft – – Spongioso, corticospongioso Sito di prelievo: cresta iliaca anteriore, posteriore, grande trocantere, femore distale, tibia prossimale Cancellous Bone Autograft Osso spongioso autologo Gold standard per nonunion atrofiche, avascolari Proprietà: – Osteogenicità – Osteoinduttività – Osteoconduttività Svantaggi: • Morbidità nel sito di prelievo • Limitata disponibilità Ejiofor, 2013 Trattamento chirurgico alternativo Protesi, artrodesi: • Nonunion periarticolare • Bassa qualità ossea • Perdita di osso • Danno articolare irreparabile Amputazione: • Nonunion avascolare • Moncone distale di bassa qualità 51 Biotecnologie • Fattori di crescita – IGF, FGF, VEGF (rivascolarizzazione dei trapianti ossei allogenici) – BMPs – Platelet Rich Plasma • Cellule staminali mesenchimali • Terapia genica Fattori di crescita • • • • Di sintesi o di derivazione umana Costo elevato Crescita e differenziazione Target: cellula mesenchimale pluripotente Logothetis, 2005 rh-BMPs • • • • • Proteine morfogenetiche ossee Famiglia TGF- β > 40 tipi Carrier: matrice collagenica Rh-BMP-7 (OP-1); Rh-BMP-2 52 rh-BMP-7 • Induce la formazione di nuova matrice ossea (osteoinduzione) • Induce la differenziazione delle cellule osteoprogenitrici in precondroblasti e pre-osteoblasti • Dose definita e costante • Indicazioni: – Pseudoartrosi di tibia refrattarie all’autotrapianto o se l’autotrapianto non è effettuabile • Utilizzo off-label: • Pseudoartrosi in ogni distretto topografico oltre a quello diafisario tibiale • Trattamento delle necrosi avascolari epifisarie • Favorire l’osteointegrazione di innesti massivi di osso omologo rh-BMP-2 • Osteoinduttività • Indicazioni: chirurgia spinale e nel trattamento delle fratture acute tibiali Govender, 2002 BMPs - Applicazioni future • Accelerazione della guarigione in pazienti ad alto rischio di pseudoartrosi • Trattamento di pseudoartrosi ricalcitranti • Trattamento di ritardi di consolidazione per via percutanea, grazie a preparazioni iniettabili • Osteosintesi di rivestimento 53 Platelet-Rich Plasma (I) • Trombociti , PDGF, TGFβ1/β2, IGF-1/2, VEGF • Da sangue autologo o eterologo • Concentrazioni importanti per l’outcome ma poco riproducibili Platelet-Rich Plasma (II) • Fattori di crescita promotori della divisione cellulare • Non specifici per le cellule ossee • Apparentemente incapaci di promuovere la differenziazione delle cellule mesenchimali e di indurre la formazione di nuovo tessuto osseo. • Minore capacità di guarigione rispetto a BMP-7 e autograft Mesenchymal Stem Cells • Cellule progenitrici multi-potenti con proprietà osteogeniche • Sede: midollo osseo • Prelievo (open), isolamento, espansione in vitro, differenziazione oppure Aspirato midollare, centrifugazione, filtrazione • Impianto • Indicazioni: nonunion asettiche atrofiche della diafisi tibiale • Efficacia maggiore se > 60000 cell/µL e se associazione con BMPs 54 Terapia genica • Carrier virali, DNA electroporation • Geni necessari per formazione e maturazione di callo osseo • Target: cellule costituzionalmente deficitarie Terese Winslow, 2006 Terapia biofisica • Campi elettromagnetici pulsati • Campi elettrici ad accoppiamento capacitivo • Ultrasuoni pulsati a bassa intensità • Onde d’urto Campi elettromagnetici pulsati (I) In vitro: a) Promuovono espansione della popolazione cellulare b) Favoriscono la differenziazione in senso osteoblastico delle cellule staminali c) Aumentano la sintesi di BMPs d) Favoriscono la deposizione di matrice ossea In vivo: Aumento significativo della velocità di deposizione ossea 55 Campi elettromagnetici pulsati (II) Indicazione: nonunion da cause biologiche e combinate (in associazione a chirurgia) Controindicazioni: • Gap osseo maggiore di metà del diametro dell’osso lungo trattato • Mobilità in corrispondenza del sito della frattura • Eccessiva angolazione dei monconi ossei Onde d’urto Energia meccanica: onde sonore a bassa frequenza (30 mW/cm2) • Microfratture • Neovascolarizzazione • Proliferazione e attivazione di osteoblasti Nonunion settica - Trattamento Obiettivi: • Eradicazione infezione (chirurgia + antibiotici) • Creazione di un microambiente vitale (osso e tessuti molli) • Ricostruzione, riallineamento, stabilizzazione dei monconi di frattura Spesso procedure multi-step Non esiste il gold standard 56 Debridement AO Priciples of fractures healing Stabilizzazione • Fissazione esterna ‒ ‒ Ilizarov Sistema tubulare Permette anche correzione deformità e allungamento arto • Placca / viti, chiodo EM ‒ Rischio di re-infezione Ricostruzione ossea • Decorticalizzazione • Osso spongioso autologo • Distrazione osteogenetica (difetti ossei > 5 cm) • Trapianto osseo libero vascolarizzato (difetti ossei > 10 cm) AO Priciples of fractures healing 57 Comorbidità • Osteoporosi e invecchiamento • Diabete • Ipertensione • Insufficienza renale • Farmaci: antitumorali, antibiotici, steroidi, FANS, anticoagulanti Bisfosfonati • Promuovono la formazione di un callo osseo voluminoso e meccanicamente robusto ma determinano un ritardo nella fase di rimodellamento ritardo nella guarigione della frattura • Migliorano la tenuta dei mezzi di sintesi nell’osso osteoporotico maggiore stabilità della sintesi stessa e quindi della frattura, condizione essenziale per lo sviluppo di un processo di healing ottimale 58
Scaricare