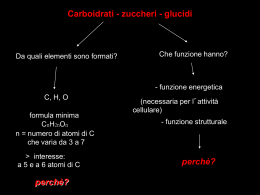
I carboidrati I carboidrati sono importanti per conservare l’energia, sia come sostanze nutrienti che come intermedi metabolici. Il ribosio e il deossiribosio (due carboidrati semplici o monosaccaridi) fanno parte della struttura portante del DNA e dell’RNA. I carboidratri (come polisaccaridi, polimeri che contengono più di 20 unità monosaccaridiche) sono elementi strutturali della parete dei batteri e delle piante. I carboidrati si trovano legati a proteine e lipidi. Fiocchi di cotone pronti per essere raccolti. La fibra del cotone è formata da cellulosa, un polisaccaride. I monosaccaridi (o zuccheri), i carboidrati più semplici, sono aldeidi o chetoni che hanno due o più gruppi ossidrilici. La formula empirica di tali composti è (CH2O)n. Per i più semplici dei monosaccaridi n = 3. Tali monosaccaridi sono detti triosi. Gliceraldeide (un aldotriosio) Diidrossiacetone (un chetosio) Diidrossiacetone (un chetoso) D-Gliceraldeide (un aldosoo) L-Gliceraldeide (un aldosoo) La gliceraldeide ha 1 atomo di carbonio asimmetrico La D e la L-gliceraldeide sono enantiomeri. Il diidrossiacetone non ha atomi di carbonio asimmetrici. Gli zuccheri con 4, 5, 6 e 7 atomi di carbonio sono chiamati rispettivamente tetrosi, pentosi, esosi ed eptosi. L’aldoesosio D-glucosio e il chetoesosio D-fruttosio sono i monosaccaridi più comuni in natura Gli aldopentosi D-ribosio e 2-deossi-D-ribosio sono componenti dei nucleotidi e degli acidi nucleici Una molecola con n centri chiralici può avere 2n stereoisomeri. La gliceraldeide ha 21 = 2 stereoisomeri; gli aldoesosi con 4 centri chiralici, hanno 24 = 16 stereoisomeri. Gli stereoisomeri dei monosaccaridi, qualunque sia la lunghezza della loro catena, possono essere divisi in due gruppi che differiscono per la configurazione intorno al centro chiralico più lontano dal gruppo carbonilico. Quelli che hanno una configurazione a livello di questo atomo di carbonio di riferimento identica a quella della D-gliceraldeide vengono detti isomeri D. Quelli con configurazione identica alla L-gliceraldeide sono gli isomeri L. D-Glucosio L-Glucosio La maggior parte degli zuccheri presenti negli organismi viventi sono isomeri D Struttura di tutti gli stereoisomeri degli aldosi della serie D che contengono da 3 a 6 atomi di carbonio Tre atomi di carbonio D -Gliceraldeide Quattro atomi di carbonio D -Eritrosio D-Treosio Cinque atomi di carbonio D-Ribosio D-Arabinosio D-Xilosio D-Lixosio Sei atomi di carbonio D-Allosio D-Altrosio D-Glucosio D-Mannosio D-Gulosio D-Idosio D-Galattosio D-Talosio Struttura di tutti gli stereoisomeri dei chetosi della serie D che contengono da 3 a 6 atomi di carbonio Tre atomi di carbonio Diidrossiacetone Quattro atomi di carbonio D-Eritrulosio Cinque atomi di carbonio D-Ribulosio D-Xilulosio Sei atomi di carbonio D-Psicosio D-Fruttosio D-Sorbosio D-Tagatosio Gli zuccheri che differiscono solo per la configurazione di un singolo centro asimmetrico sono detti epimeri. Il Glucosio e i suoi due epimeri Pochi zuccheri sono presenti in natura nella forma L L-Arabinosio Un’aldeide oppure un chetone possono reagire con un alcol in un rapporto 1:1 formando rispettivamente un emiacetale o un emichetale e creando un nuovo centro chiralico a livello del carbonio carbonilico. L’aggiunta di una seconda molecola di alcol produce un acetale o un chetale Quando il secondo gruppo alcolico fa parte di un’altra molecola di zucchero, si forma un legame glicosidico. Le forme predominanti del glucosio e del fruttosio in soluzione non sono catene aperte. Le forme a catena aperta ciclizzano generando anelli. α-D-Glucopiranoso D-Glucosio (forma a catena aperta) β -D-Glucopiranoso L’anello è detto piranoso in quanto è simile al pirano. Fruttosio Un chetone può interagire con un gruppo alcolico per formare un emichetale 2 5 D-Fruttosio (forma a catena aperta) α-D-Fruttofuranoso (una forma ciclica del fruttosio) Dalla ciclizzazione del fruttosio si possono formare due anomeri, qui è mostrato solo l’anomero α. L’anello a cinque elementi viene chiamato furanoso per la somiglianza con il furano. 1 2 6 1 5 3 5 2 4 4 2 5 3 6 α-D-Fruttofuranoso D-Fruttosio (forma a catena aperta) Il fruttosio può formare anche anelli piranosici: 1 2 3 4 5 6 6 ' 1 5 2 4 3 Il fruttosio può formare sia anelli a cinque elementi di tipo furanosico che anelli a sei elementi di tipo piranosico. In entrambi i casi sono possibili sia anomeri di tipo α che di tipo β. α-D-fruttofuranoso α-D-fruttopiranoso β-D-fruttofuranoso β-D-fruttopiranoso La forma piranosica è predominante nel fruttosio libero, la forma furanosica è presente nei suoi derivati Gli zuccheri a 5 atomi di carbonio come il D-ribosio ed il 2-deossi-D-ribosio formano anelli furanosici D-Ribosio 2-deossi-D-Ribosio Forma a sedia Forma a barca La forma a sedia del β-D-glucopiranoso è energeticamente più favorevole perché le posizioni assiali con maggiori impedimenti sterici sono occupate da atomi di idrogeno Forma a sedia Forma a barca Alcuni derivati degli esosi. Ammino-zuccheri, un gruppo -NH2 ha sostituito uno dei gruppi ossidrilici dell’esosio corrispondente Deossi-zuccheri, un -H sostituisce un -OH Gli zuccheri acidi contengono gruppi carbossilici (ossidazione del carbonio carbonilico C-1 o del C-6). Derivati fosforilati I monosaccaridi possono essere ossidati da agenti ossidanti blandi come gli ioni ferrico (Fe3+) e rameico (Cu2+). L’atomo di carbonio carbonilico viene ossidato in queste reazioni a gruppo carbossilico I monosaccaridi in grado di ridurre gli ioni ferrico e rameico sono detti zuccheri riducenti. Glucosio ossidasi D-Glucosio + O2 D-Glucono-δ-lattone + H2O2 La concentrazione di glucosio nel sangue può essere determinata direttamente misurando la quantità di H2O2 prodotta nella reazione catalizzata dalla glucosio ossidasi. Nella miscela di reazione viene aggiunto un secondo enzima, una perossidasi, che catalizza la reazione tra l’H2O2 e un composto incolore che viene trasformato in una sostanza colorata. La quantità di colore sviluppata viene misurata con uno spettrofotometro. I monosaccaridi possono legarsi l’uno all’altro mediante legami O-glicosidici per formare disaccaridi o polisaccaridi. emiacetale alcol β-D-Glucosio α-D-Glucosio idrolisi condensazione acetale emiacetale Maltosio α-D-glucopiranosil-(1Î4)-β-glucopiranosio Il legame O-glicosidico si forma quando un gruppo alcolico (-OH) di una molecola di zucchero reagisce con l’atomo di carbonio anomerico di un altro zucchero. L’atomo di carbonio anomerico può legarsi all’atomo di azoto di un’amina mediante un legame N-glicosidico. Legame N-glicosidico I legami N-glicosidici hanno una configurazione β in quasi tutte le biomolecole naturali I tre disaccaridi più comuni sono il saccarosio, il lattosio ed il maltosio Saccarosio Glc(α1Î2β)Fru Nel saccarosio gli atomi di carbonio anomerici del glucosio e del fruttosio sono legati con un legame α-glicosidico. L’idrolisi del saccarosio a glucosio e fruttosio è catalizzata dalla saccarasi. Lattosio (forma β) Gal(β1Î4) Glc L’idrolisi del lattosio a galattosio e glucosio è catalizzata dalla lattasi. Glc(α1Î4) Glc L’idrolisi del maltosio due molecole di glucosio è catalizzata dalla maltasi. La maggior parte dei carboidrati è presente in natura nella forma di polisaccaridi con una massa molecolare molto elevata. omopolisaccaridi Non ramificato Ramificato eteropolisaccaridi Due tipi di monomeri, non ramificato Diversi tipi di monomeri, ramificato Le cellula animali conservano il glucosio sotto forma di glicogeno. Il glicogeno è un polimero ramificato di glucosio. La maggior parte dei residui sono legati da legami glicosidici α−1,4 . Le ramificazioni sono formate da legami glicosidici α−1, 6 presenti circa ogni 10 unità di glucosio. Glicogeno Legame glicosidico α-1,6 tra due subunità di glucosio Legame glicosidico α-1,4 tra due subunità di glucosio Granuli di glicogeno La riserva di sostanze nutrienti nelle piante è l’amido L’amido contiene due tipi di polimeri del glucosio. Amilosio: polimero del glucosio non ramificato costituito da residui legati da legami α−1,4 . Amilopectina: polimero ramificato. Presenta un legame α−1,6 ogni 24-30 legami α−1,4. Simile al glicogeno ma con meno ramificazioni. Amilosio e amilopectina, i polisaccaridi costituenti dell’amido Estremità Estremità non riducente Estremità Estremità riducente Amilosio, un polimero lineare di molecole di D-glucosio unite con legame (α1Î4). Ramificazione Punto di Ramificazione (α1Î6) Catena principale Punto di ramificazione dell’amilopectina Amilosio Estremità riducenti Estremità non riducenti Amilopectina Interazione tra l’amilosio e l’amilopectina nei granuli di amido Granuli di amido Unità di glucosio unite con legami (α1Î4). Struttura dell’amido La cellulosa è un polimero del glucosio presente nelle piante e ha funzioni strutturali invece che di riserva di sostanze nutrienti La cellulosa è un polimero non ramificato formato da residui di glucosio legati tra loro da legami β−1,4 . La configurazione β permette alla cellulosa di formare catene molto lunghe e diritte Unità di glucosio unite con legami (β1Î4). Struttura della cellulosa I legami glicosidici determinano la struttura dei polisaccaridi Amido e glicogeno Lipidi Grassi e oli Fosfolipidi e steroli Principali forme di conservazione dell’energia in molti tipi di organismi costituiscono più della metà della massa delle membrane biologiche Altri lipidi hanno attività biologiche specifiche (Es.: ormoni steroidei, vitamine liposolubili). Lipidi Grassi e oli Sono composti altamente ridotti derivati dagli acidi grassi Gli acidi grassi sono acidi carbossilici con una catena idrocarburica composta da 4 a 36 atomi di carbonio. In alcuni acidi grassi la catena idrocarburica è completamente satura (non contiene doppi legami), in altri sono presenti uno o più doppi legami Le proprietà chimico-fisiche degli acidi grassi e dei composti che li contengono sono influenzate fortemente dalla lunghezza della catena idrocarburica e dal numero di doppi legami presenti nella molecola Gruppo carbossilico Catena idrocarburica Acidi grassi saturi Miscela di acidi grassi saturi ed insaturi I lipidi più semplici costruiti a partire dagli acidi grassi sono i triacilgliceroli (o trigliceridi). I triacilgliceroli sono composti da 3 acidi grassi ognuno legato con un legame estere con un gruppo ossidrilico di una molecola di glicerolo. I triacilgliceroli sono molecole non polari, idrofobiche e pertanto essenzialmente non solubili in acqua. Riserve di grassi nelle cellule. Sezione trasversale di un adipocita di porcellino d’india
Scaricare