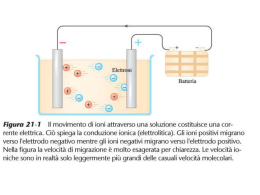
Elettrochimica Elettrochimica è lo studio delle reazioni chimiche che producono effetti elettrici E dell’opposto, cioè dei fenomeni chimici che sono causati dall’azione della corrente o del voltaggio Redox Reactions. Reduction Oxidation Oxidation: Reduction: •Gain of oxygen •Loss of oxygen •Loss of electrons •Gain of electrons Increase in oxidation number Decrease in oxidation number Reazioni Redox Ossidazione – Perdita di elettroni Riduzione – Acquisto di elettroni agente ossidante – sostanza che, riducendosi, causa ossidazione agente riducente – sostanza che, ossidandosi, causa riduzione Zn + Cu2+SO42- Zn2+SO42- + Cu n.o. 0 +2 RED1 OX2 +2 OX1 0 RED2 Zn2+/Zn = coppia coniugata redox 1 Cu2+/Cu = coppia coniugata redox 2 LE REAZIONI DI OSSIDORIDUZIONE SONO RICONDUCIBILI ALL’INTERAZIONE TRA DUE COPPIE OSSIDORIDUTTIVE CHE SCAMBIANO ELETTRONI. SIMILITUDINE CON REAZIONI ACIDO BASE (DUE COPPIE CONIUGATE ACIDO/BASE) Semireazione di ossidazione Zn(s) Zn+2(aq) + 2 eSemireazione di riduzione Cu+2(aq) + 2 e- Cu(s) Cu+2(aq) + Zn(s) Zn+2(aq) Cu(s) + Cella voltaica o galvanica Una reazione chimica modificata per generare corrente Celle e Reazioni di Cella Cella di Daniel Zn(s) + Cu+2(aq) Zn+2(aq) + Cu(s) Semireazione di ossidazione anodo Zn(s) Zn+2(aq) + 2 eSemireazione di riduzione catodo Cu+2(aq) + 2 e- Cu(s) Cella di Daniel Un elettrodo di rame immerso in una soluzione di solfato di rame (II) Un elettrodo di zinco immerso in una soluzione di solfato di zinco ZnZn+2+2 e- Cu+2+2 e-Cu Galvanic Cell: cariche elettriche ZnZn+2 Cu+2Cu Il ponte salino o disco poroso permette la migrazione degli ioni così che la soluzioni rimangono neutre : Galvanic Cells: gli elettroni ZnZn+2+2 e- Anodo: ossidazione Carica (+) Cu+2+2 e-Cu Catodo: riduzione Carica (-) Zn + Cu2+ Zn2+ + Cu Potenziale di cella Gli elettroni sono spinti dalla reazione di ossidazione ed accettati dalla reazione di riduzione. Questo genera corrente elettrica: potenziale di cella, o forza elettromotrice. Misurato in Volt Esso è positivo e misurabile sperimentalmente Misurato come la differenza di potenziale tra gli elettrodi di una cella elettrochimica Se misurato in condizione standard ( concentrazione, pressione, temperatura) si ottiene la E°, il potenziale standard della cella. “regole” delle celle elettrochimiche 1. All’anodo gli elettroni sono prodotti dall’ossidazione. 2. Al catodo gli elettroni sono reagenti per la riduzione. 3. Gli elettroni si muovono nei cavi allontanandosi dall’anodo 4. Gli anioni tornano verso il (–) per caricare l’ anodo. Potenziale di cella standard E°, la differenza di potenziale, in volts, tra gli elettrodi di una cella elettrochimica in condizioni standard (25oC, concentrazione degli ioni = 1 M, ed i gas alla pressione di 1 atm) Elettrodo standard ad idrogeno consiste in un elettrodo di platino coperto da una polvere sottile di platino intono a cui gorgoglia H2(g). Il suo potenziale è definito come 0 volts. Semicella a Idrogeno H2(g) = 2 H+(aq) + 2 ereazione reversibile 2H+(aq, 1M) + 2e- H2(g, 1 atm) E = 0 V Potenziale di elettrodo E’ utile considerare il potenziale di cella come la somma dei due potenziali di elettrodo: E° = E°(catodo) + E°(anodo) Per fare ciò si è definito come potenziale 0 quello dell’elettrodo H 2H+ (aq) + 2e- H2(g) + E° = 0.00 Per misurare il potenziale di un elettrodo (es. Zn) basta calcolare il potenziale della cella Zn//H Potenziale dello Zinco Pontenziale del Rame Gli elettrodi della pila Daniell Lo Zn riduce H+ H2 riduce il Cu2+ Quindi Zn riduce Cu2+ Calcolo potenziale di cella Il potenziale dell’elettrodo a Zn è potenziale di ossidazione = + 0.76 V Il potenziale della reazione opposta è di riduzione = -0.76 V E° (V) Reduction Reaction 2.87 F2(g) + 2e- 2F- 1.36 Cl2(g) + 2e- 2Cl1.07 Br2(l) + 2e- 2Br0.77 Fe3+ + e- Fe2+ 0.54 I2(s) + 2e- 2I0.34 Cu2+ + 2e- Cu(s) 0.15 Sn4+ + 2e- Sn2+ 0.00 2H+ + 2e- H2(g) -0.04 Fe3+ + 3e- Fe(s) -0.23 Ni2+ + 2e- Ni(s) E° standard +1.36 Cl2(g) + 2e– 2Cl- E° = 1.36 + 0.74 = 2.10 V 3 × [ Cl2(g) + 2e– 2Cl- ] 2 × [ Cr(s) Cr3+ + 3e– ] 3Cl2(g) + 2Cr(s) 6Cl- + 2Cr3+ -0.40 Cd2+ + 2e- Cd(s) -0.41 Fe2+ + 2e- Fe(s) -0.74 Cr3+ + 3e- Cr(s) –0.74 Cr3+ + 3e– Cr(s) -0.76 Zn2+ + 2e- Zn(s) -2.71 Na+ + e- Na(s) -2.76 Ca2+ + 2e- Ca(s) -2.92 K+ + e- K(s) Cl2 ha tendenza a ridursi > di Cr3+ Potenziali di elettrodo Per convenzione vengono sempre espressi come potenziali standard di riduzione Ox red Serie elettrochimica I potenziali standard di riduzione ordinano le sostanze in base alla loro tendenza a ridursi. Esprimono l’energia libera della semireazione in Volt Indicano anche il potere riducente o ossidante. Valori negativi sono associati ad alti poteri riducenti della forma ridotta (es. Zn) Valori positivi ad alto potere ossidante della forma ossidata (es. Cu2+) La serie elettrochimica è in ordine decrescente di potere ossidante Esempio se si vuole la riduzione di mercurio(II) in una cella voltaica, e la semireazione è: Quale reazione può essere usata all’anodo (ossidazione)? A, B Diagramma di Cella rappresentazione schematica di una cella elettrochimica che mostra la due semicelle connesse da un ponte salino e equivalente, come Zn(s)/ZnSO4(aq)//CuSO4(aq)/Cu(s) Zn(s)/Zn++//Cu++/Cu(s) anodo catodo Ox Red Reazioni di spostamento di Metalli • I solidi dei metalli più reattivi spostano gli ioni di metalli meno reattivi • La reattività relativa è basata sui potenziali delle semireazioni • I metalli con potenziali molto diversi reagiscono più vigorosamente esempio Ag+ + e- Ag E°= 0.80 V Cu2+ + 2e- Cu E°= 0.34 V Ag reagirà con Cu2+? yes, no Cu reagirà con Ag+? yes, no Energia libera di Gibbs e Potenziale di Cella Se la cella genera corrente (E) essa è spontanea (DG) dove DG = - nFE n => numero di elettroni scambiati F => constante di Faraday* E => potenziale di cella * F= 96485 Coulomb/mol Applicazioni delle Celle Electrochimiche Batterie: convertono l’energia chimica in elettricità Celle Primarie – celle elettrochimiche non-reversibili Celle Secondarie – celle elettrochimiche reversibili Applicazioni delle Celle Electrochimiche Celle Primarie "dry" cell e alkaline cell 1.5 v/cell mercury cell 1.34 v/cell fuel cell 1.23v/cell Celle Secondarie lead-acid (automobile battery) 2 v/cell NiCad 1.25 v/cell La dipendenza del potenziale dalla concentrazione dei reagenti/prodotti Equazione di Nernst E = E0 + RT ln [OX1] nF [RED1] R= costante dei gas, T= temp in K, n= numero di elettroni, F= costante di Faraday Convertendo il log naturale in decimale e quantificando le costanti, a 25 °C E = E0 + 0.059 log [OX1] n [RED1] E = E0 + 0.0257 ln [OX1] n [RED1] N.B. quando [OX] = [RED] E = Eo ESEMPIO: Quale è il potenziale di cella per la cella di Daniel quando [Zn+2] = 10 [Cu+2] ? Q = ([Zn+2]/[Cu+2] = (10 [Cu+2])/[Cu+2] = 10 Eo = (0.34 V)Cu + (-(-0.76 V))Zn n = 2, (2 gli elettroni scambiati) Ecella = Eocella - (0.0257/n)ln Q così Ecell = (1.10 - (0.0257/2) ln 10) V Ecell = (1.10 - (0.0257/2) 2.303) V Ecell = (1.10 - 0.0296) V = 1.07 V Celle a concentrazione • una cella il cui potenziale dipende solo da differenze di concentrazione. • Un compartimento contiene una soluzione concentrata, e l’altro una soluzione diluita. • Esempio: 0.025 M Cu e 1.50 M Cu2+. Celle a concentrazione • Le due semi-reazioni sono uguali, quindi Eº è zero . 0.02567 E E ln Q n [Cu2 ]dilute 0.02567 0V ln 2 [Cu2 ]concentrat ed 0.02567 0.025M 0V ln 2 1.50 M 0.0526 V Misura del pH 1. 2. Meter pH electrode reference 3. 4. Un elettrodo il cui voltaggio cambia col pH Un elettrodo di riferimento il cui voltaggio non cambia Un volt meter che converte i millivolts in unità pH. Un compensatore automatico di temperatura (optionale). il pH metro Corrosione e protezione dei metalli Fe2+ + 2OH– Fe(OH)2(s) Fe2O3 O2 + 2H2O + 4e– 4OH– Fe2+ anode cathode e– Iron Corrosione, la ruggine Zn Fe Cu Una barretta di ferro messa in un sistema semisolido (agar) che contiene fenoftaleina (Indicatore di pH) Fe (s) Fe+2 + 2 e- ½ O2 (g) + H2O (l) + 2 e- 2 OH- Elettrolisi • La disponibilità di elettricità permette di compiere reazioni opposte a quelle delle pile. • Si usa una cella in cui i due elettrodi sono nella stessa soluzione elettrolitica e si applica corrente ai due elettrodi Refining Elettrolitico del rame Cu(s) + Cu+2(aq) --> Cu+2(aq) + Cu(s) impuro puro anodo catodo Aspetti quantitativi dell’elettrolisi • 1 coulomb = 1 amp sec • 1 mole e- = 96,500 coulombs N° mol e- =Corrente(C/s)x tempo x1 mol e-/ 96,500 = Amp x sec /96.500 Esempio Quanti grammi di cromo possono essere deposti da una soluzione di Cr+6 in 45 minuti con una currente di 25 amp? (45 min) #g Cr = ------------ Esempio Quanti grammi di cromo possono essere deposti da una soluzione di Cr+6 in 45 minuti con una currente di 25 amp? (45 min)(60 sec) #g Cr = --------------------(1 min) Esempio Quanti grammi di cromo possono essere deposti da una soluzione di Cr+6 in 45 minuti con una corrente di 25 amp? (45) (60 sec) (25 amp) #g Cr = --------------------------(1) Esempio Quanti grammi di cromo possono essere deposti da una soluzione di Cr+6 in 45 minuti con una currente di 25 amp? definizione del coulomb (45)(60 sec)(25 amp)(1 C) #g Cr = ----------------------------(1) (1 amp sec) Esempio Quanti grammi di cromo possono essere deposti da una soluzione di Cr+6 in 45 minuti con una currente di 25 amp? Faraday’s constant (45)(25)(60)(1 C)(1 mol e-) #g Cr = ---------------------------------(1)(1)(96,500 C) Esempio Quanti grammi di cromo possono essere deposti da una soluzione di Cr+6 in 45 minuti con una currente di 25 amp? massa atomica (45)(60)(25)(1)(1 mol e-)(52 g Cr) #g Cr = ------------------------------------------(1)(1)(96,500) (6 mol e-) Esempio Quanti grammi di cromo possono essere deposti da una soluzione di Cr+6 in 45 minuti con una currente di 25 amp? (45)(60)(25)(1)(1 mol e-)(52 g Cr) #g Cr = ------------------------------------------(1)(1)(96,500)(6 mol e ) = 58 g Cr Well done! Potenziale Standard di Riduzione • Il potenziale della semireazione di riduzione, misurata in condizioni standard (25oC, concentrazione degli ioni = 1 M, ed i gas alla pressione di 1 atm) • Il potenziale di una cella può essere calcolato dai potenziali standard : E° = E+ + E– • Nella pila di Daniell se Zn2+ e Cu2+ sono 1 M, E° = 1.1 V Alcuni Potenziali Standard di Riduzione Li+ + e- Li Zn+2 + 2 e- Zn Fe+2 + 2 e- Fe 2 H+(aq) + 2 e- H2(g) Cu+2 + 2 e- Cu O2(g) + 4 H+(aq) + 4 e- 2 H2O(l) F2 + 2e- 2 FE° = E+ + E– = +0.337 + 0.763 = 1.10 V -3.045 V -0.763 V -0.44 V 0.00 V +0.337 V +1.229 V +2.87 V
Scarica