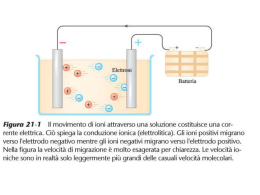
Lezione 11 Ossidoriduzione per via chimica In questo caso si ha il mescolamento dei reagenti e quindi il trasferimento diretto degli elettroni dalla specie che si ossida a quella che si riduce. Ad esempio se si immerge una lamina di rame in una soluzione con ioni Ag+: Cu + 2Ag+ Cu2+ + 2Ag Il rame passa in soluzione come Cu2+ mentre gli ioni Ag+ si depositano sul rame come argento metallico. Questa è anche una reazione di cementazione nel senso che l’argento tende a “cementare” tutta la superficie libera del rame e quando questo accade la reazione cessa perché cessa il contatto tra Cu e Ag+. Lavoro gravitazionale ed elettrico Lavoro gravitazionale estraibile Lg = m·g·Δh J = kg·m/s2·m Lavoro elettrico estraibile Le = q·ΔE = i·t·ΔV = -ΔG J = C·V = A·s·V Nota: La corrente elettrica è la quantità di carica (q) che passa in un circuito nell’unità di tempo, i = q / t [A = C / s] Origine della f.e.m. La forza elettromotrice (f.e.m.) è la causa della differenza di potenziale (ΔE) tra due punti di un circuito aperto o del flusso di corrente elettrica all'interno di un circuito chiuso. Rifacendosi al caso precedente, se io immergo del rame o dell’argento metallici in due soluzioni acquose separate e contenenti i rispettivi ioni (cioè un sale solubile del metallo corrispondente), si instaurano i seguenti equilibri dinamici. 1) Cu Cu2+ + 2e‾ 2) Ag Ag+ + e‾ A causa della diversa natura chimico fisica di Cu e Ag, l’equilibrio 1) è spostato a destra più dell’equilibrio 2). I metalli in tali soluzioni possiedono dunque entrambi una piccola carica negativa ma questa è superiore su Cu rispetto ad Ag (Cu tende a dissociarsi maggiormente di Ag ). Nasce così una differenza di potenziale. Se si chiude il circuito avviene il passaggio di corrente. Nota: nel caso della ossidoriduzione chimica si ha un cortocircuito! Ossidoriduzione per via elettrochimica In questo caso la reazione di ossidoriduzione è fisicamente divisa nelle due semireazioni di ossidazione e riduzione. Ad esempio: Cu Ag+ + e- Cu2+ + 2eAg ossidazione riduzione Le relative coppie di ossidoriduzione sono indicate come Cu++/Cu e Ag+/Ag (indicate sempre nel senso della riduzione), ove “/” simboleggia il cambiamento di fase. Tali reazioni avvengono in una cella elettrochimica, cioè in un sistema che non consente il contatto diretto tra i reagenti (evitando così il corto circuito e la cementazione) ma mantiene la continuità del circuito elettrico. A questo scopo una cella elettrochimica è divisa in due semicelle a soluzione acquosa separate con un setto poroso o con un ponte salino. Setto poroso o giunto interliquido Può essere costituito, ad esempio, da vetro sinterizzato o porcellana non smaltata. Esso divide una semicella dall'altra e, pur impedendo il repentino mescolamento tra le due soluzioni, lascia passare gli ioni che servono a mantenere neutre le due soluzioni. A causa della diversa mobilità ionica delle specie che riescono ad attraversarlo si può sviluppare una differenza di i potenziale addizionale in corrispondenza della – + giunzione. Per evitare questo potenziale detto potenziale di giunzione si usa un ponte salino. Cella elettrochimica (galvanica: Cu/Cu2+//Ag+/Ag) L’elettrodo di rame è immerso in una soluzione acquosa di CuSO4. L’elettrodo di argento è immerso in una soluzione acquosa di Ag2SO4. Nota: il setto poroso viene indicato con il simbolo “//” Ponte salino Il ponte salino è costituito generalmente da un tubo di vetro piegato a U contenente un'opportuna soluzione elettrolitica satura (KCl, K2SO4, KNO3, NH4NO3) liquida o gelificata. Il sale è scelto in modo che i suoi ioni abbiano grossomodo la stessa mobilità affinché i due potenziali di giunzione si annullino reciprocamente. È importante osservare che, per evitare il mescolamento per diffusione delle soluzioni, si devono tappare le i estremità del tubo a U di fatto con un setto poroso (un po' di cotone per parte può andare bene). Con il ponte salino la divisione fra le semicelle è totale. Cella galvanica: Cu/Cu2+//Ag+/Ag Nota: il ponte salino viene indicato con il simbolo “//” Cella elettrochimica La cella elettrochimica può essere: galvanica sede di redox spontanea (ΔG < 0; ΔE > 0 Le > 0) elettrolitica sede di redox non spontanea (ΔG > 0; ΔE > 0 Le < 0) Per definizione: anodo: elettrodo sede di ossidazione ( può consumarsi) catodo: elettrodo sede di riduzione ( può accrescersi) I cationi (+) sono sempre attratti verso il catodo. Gli anioni (–) sono sempre attratti verso l’anodo. Nota: La cella galvanica è nota anche come cella voltaica o pila o batteria. Cu/Cu2+//Ag+/Ag Ag/Ag+//Cu2+/Cu Per convenzione l’anodo è posto a sinistra. Nel caso della cella galvanica: f.e.m. = ΔEg = E2 – E1 = Ec – Ea Man mano che la pila funziona Ec diminuisce ed Ea aumenta fino a che la pila è scarica (Ec = Ea). Se a questa pila si applica una pila esterna il cui ΔEe ≥ – ΔEg (potenziale della pila “interna”) allora si forma una cella elettrolitica che può essere anche chiamata contropila (la pila cioè si ricarica). Verso della corrente nella cella elettrochimica Cella galvanica Cella elettrolitica anodo catodo catodo anodo Il flusso di corrente nasce quando si crea una differenza di potenziale elettrico ΔE (o potenziale di cella) che nel caso della cella galvanica è data dai differenti potenziali di riduzione delle specie coinvolte mentre nel caso della cella elettrolitica è data dalla batteria esterna. Nei conduttori solidi sono solitamente le cariche elettriche negative (e‾) a muoversi e il loro flusso è opposto nel verso a quello della corrente i. Nella soluzione a muoversi sono sia gli anioni (–) sia i cationi (+). – ΔEg = potenziale di decomposizione Potenziale gravitazionale (g·Δh) e h Considero un tubo cavo e rettilineo di lunghezza ignota che parta dal fondo del mare e prosegua verso il cielo. C Considero due punti qualsiasi (1 e 2) lungo questo tubo. La distanza tra questi due punti, Δh1-2, (sempre > 0) la posso misurare direttamente oppure la posso calcolare se A conosco le loro rispettive quote h1 e h2, ovvero le loro distanze rispetto ad un altro punto preso come riferimento. Considero il livello del mare come punto di riferimento (M) e impongo arbitrariamente la sua quota hM = 0. Se ad esempio la quota di A è hA = +10 m e quella di B M è hB = -3 m ΔhA-B = hA – hB = +10 – (-3) = +13 m, ΔhA-C = hC – hA = +15 – (+10) = +5 m, ΔhB-D = hB – hD = B -3 – (-9) = +6 m. Una massa m introdotta in qualsiasi punto del tubo si D muoverà spontaneamente per effetto di g dalla quota maggiore a quella minore. +15 +10 m 0 -3 -9 Corrispondenza tra h e E0 Ogni punto lungo il tubo corrisponde ad una delle possibili semicelle che si possono costruire, ciascuna caratterizzata da una propria reazione di riduzione e ciascuna presa nel proprio stato standard (P = 1 atm, T = 25°C, [ioni] = 1 M). Le quote dei punti (h) corrispondono ai potenziali standard di riduzione (E0). Il livello del mare, per cui h = 0 m, per definizione, corrisponde all’elettrodo standard ad idrogeno per cui E0 = 0 V. Come è possibile ordinare i punti in ordine crescente di h così è possibile ordinare tutte le possibili reazioni di riduzione di semicella secondo i valori crescenti di E0. Come una massa m tende spontaneamente a dirigersi da un h maggiore ad uno minore, così la carica positiva q (flusso di corrente i) si dirigerà spontaneamente dalle semicelle con E0 maggiore (catodo) a quelle con E0 minore (anodo). Nota: In una cella elettrochimica, se in una semicella avviene una reazione di riduzione (catodo), nell’altra avviene quella di ossidazione (anodo), ovvero l’inversa di quella di riduzione. Elettrodo standard a idrogeno (HSE) È uno storico elettrodo a gas, schematizzato Pt|H2 (1 atm)|H+ (1 M), al quale sono riferiti i potenziali standard calcolati di tutte le coppie redox note. Costruttivamente è formato da una lamina quadrata di platino ricoperto da un deposito di platino spugnoso immersa in una soluzione 1 M in ioni H+ (HCl 1 M) e sulla quale viene fatto gorgogliare idrogeno gassoso alla pressione di 1 atm. La reazione redox che sta alla base di questo elettrodo è 2H+(aq) + 2e‾ → H2(g). L'elettrodo standard a idrogeno assume convenzionalmente potenziale standard di riduzione eguale a zero a tutte le temperature. Serie elettrochimica di potenziali standard di riduzione (25°C) Semireazione Li+(aq) + e- Li(s) E° (V) -3,04 Semireazione 2H+(aq) + 2e- H2(g) E° (V) 0,000 K+(aq) + e- K(s) -2,931 Cu2+ (aq) + e- Cu+ +0,153 Ca2+(aq) + 2e- Ca(s) -2,868 SO42-(aq) + 4H+(aq) + 2e- H2SO3(aq) + H2O +0,17 Na+(aq) + e- Na(s) -2,71 Cu2+(aq) + 2e- Cu(s) +0,337 Mg2+(aq) + 2e- Mg(s) -2,372 NiO2(aq) + 4H+(aq) + 3e- Ni(OH)2(s) + 2OH-(aq) +0,49 Al+++(aq) + 3e- Al(s) -1,662 I2(s) + 2e- 2I-(aq) +0,54 2H2O(aq) + 2e- H2(g) + 2OH-(aq) -0,828 Fe3+(aq) + e- Fe2+(aq) +0,771 Zn2+(aq) + 2e- Zn(s) -0,763 Ag+(aq) + e- Ag(s) +0,800 Cr3+(aq) + 3e- Cr(s) -0,74 NO3-(aq) + 4H+(aq) + 3e- NO(g) + 2H2O +0,96 Fe2+(aq) + 2e- Fe(s) -0,447 Br2 (aq) + 2e- 2Br-(aq) +1,09 Cd2+(aq) + 2e- Cd(s) -0,403 O2(g) + 4H+(aq) + 4e- 2H2O +1,229 Co2+(aq) + 2e- Co(s) -0,28 Cl2 (g) + 2e- Cl-(aq) +1,36 Ni2+(aq) + 2e- Ni(s) -0,257 Au3+(aq) + 3e- Au(s) +1,498 Sn2+(aq) + 2e- Sn(s) -0,137 PbO2(s) + 4H+(aq) + 2e- Pb2+(aq) + 2H2O +1,46 Pb++ + 2e- Pb(s) -0,126 MnO4-(aq) + 8H+(aq) + 5e- Mn2+(aq) + 4H20 +1,51 2HOCl(aq) + 2H+(aq) + 2e- Cl2(g) + 2H20 +1,63 PbO2(s) + SO42-(aq) + 4H+ + 2e- PbSO4(s) + H2O +1,69 F2(g) + 2e- 2F- +2,87 P = 1 atm, [ioni] = 1 M Come usare i potenziali standard Più è alto il valore di E0 più la reazione ha la tendenza ad avvenire così come è scritta (cioè nel senso della riduzione). Se vengono accoppiate due reazioni in una cella galvanica, quella con E0 maggiore avviene al catodo così come è scritta mentre quella con E0 minore avviene all’anodo ma nel verso opposto a quello scritto (avviene cioè la reazione di ossidazione). Il ΔE0 della cella è E0 maggiore – E0 minore > 0. Nel caso di cella elettrolitica, una volta stabilite le possibili reazioni di riduzione al catodo (–) e di ossidazione all’anodo (+), al catodo avviene la riduzione con E0 maggiore tra le candidate, all’anodo avviene l’ossidazione con E0 minore relativa alle candidate. L’elettrolisi di una base forte porta alla dissociazione dell’acqua. Nel caso più generico di condizioni non standard bisogna sostituire ad E0 il corrispondente valore di E (vedi poi legge di Nernst). ΔE0 di una pila Cu – Ag? Se costruisco una cella galvanica Li – Co, quale semicella funge da catodo? Quale è il ΔE0? Quali metalli tendenzialmente non sono corrodibili dall’acido cloridrico? Una barretta di Pb è immersa in una soluzione contenente ioni Ag+ e Mg2+. Che cosa succede? Ad una soluzione acquosa di CoCl2 viene aggiunto Ni in polvere. Cosa succede? In una cella elettrolitica sono presenti le seguenti specie ioniche: H+, Cu2+, Zn2+, Al3+, Mg2+ in concentrazione 1M. Quale specie si scarica per prima al catodo? +0,80 – 0,337 = 0,463 V Co perché il suo E0 è maggiore; -0,28 – (-3,04) = 2,76 V quelli con E0 > 0 Ag+ si riduce e Pb si ossida niente quella con E0 maggiore: Cu Leggi di Faraday 1. La massa di sostanza che si deposita a un elettrodo è direttamente proporzionale alla quantità di carica elettrica che passa attraverso la cella elettrochimica 2. La massa di sostanza che si deposita a un elettrodo è direttamente proporzionale al suo equivalente chimico Riassumendo in un’unica legge: 3. Al passaggio di una mole di elettroni attraverso una cella elettrochimica, si libera un grammo equivalente di sostanza presso ciascun elettrodo Queste leggi riassumono la stechiometria dei processi elettrochimici e furono scoperte (1833) molto prima che fosse scoperto l’elettrone e che fosse compresa la base atomica dell’elettricità. Nota: si ricorda che un grammo equivalente (g/Eq) = M.M./nEq, e che il numero di equivaleni (nEq) di un ossidante/riducente è pari al numero di elettroni acquisiti/ceduti in una reazione redox. Dimostrazione della legge di Faraday La dimostrazione qui di seguito è riferita ad un caso particolare ma può essere facilmente generalizzata. Consideriamo ancora la cella galvanica Cu/Cu++/Ag+/Ag . Calcolare la massa di rame disciolta e quella di argento depositata al passaggio di 1 mole di elettroni. Cella galvanica Le semireazioni sono: Cu(s) Cu2+ + 2e‾ ossidazione anodo (–) Ag+ + e‾ Ag(s) riduzione catodo (+) Come in ogni reazione redox, le semireazioni vanno bilanciate (numero di e‾ prodotti da Cu = numero di e‾ consumati da Ag+) Cu(s) Cu2+(aq) + 2e‾ Cu + 2Ag+ + 2e‾ Cu2+ + 2e‾ + 2Ag 2Ag+(aq) + 2e‾ 2Ag(s) Questo significa che se passano 2 moli di e‾ si liberano 1 mole di Cu e 2 moli di Ag se passa 1 mole di e‾ si liberano 0,5 moli di Cu e 1 mole di Ag se passa 1 mole di e‾ si liberano 1 g.Eq di Cu e 1 g.Eq, di Ag. La carica dell’elettrone (e) ed il Faraday (F) Per applicare la legge di Faraday e poter fare calcoli quantitativi occorre conoscere la carica elettrica posseduta da una mole di elettroni, nota anche come costante di Faraday (F). La carica dell’elettrone, nota anche come carica elementare, è e = 1,602176487(40)·10-19 C La carica di una mole di elettroni è F = e·Na F = 1,602176487(40)·10-19 C 6,02214179(30)·1023 F = 96485,3415 C ≈ 96500 C Nota: I valori di e e di Na sono quelli forniti dal CODATA (Committee on Data for Science and Technology) nel 2006. In una cella galvanica Cu/Cu++/Ag+/Ag passa una corrente di 0,500 A per 101 minuti. Calcolare la massa di rame disciolta e quella di argento depositata. A pressione atmosferica e a 25°C in una cella elettrolitica contenente una soluzione acquosa di KOH passa una corrente di 7,2 A. Sapendo che si raccolgono agli elettrodo complessivamente 2,1 litri di gas, quanto tempo è durata l’elettrolisi? Una soluzione di un sale di bismuto viene elettrolizzata. Al catodo si depositano 19,5 g di bismuto, corrispondenti a 0,28 grammi equivalenti. Quale è il numero di ossidazione del bismuto nel sale? Una soluzione acquosa di un sale trivalente di ferro viene sottoposta ad elettrolisi. Se al catodo si depositano 5,20 g di ferro, quante moli di ossigeno si liberano all’anodo? Cu: 0,997 g; Ag: 3,39 g 25,6 min +3 0,07 mol Effetti della concentrazione ed equazione di Nernst Spesso si è interessati a celle in cui le concentrazioni e le pressioni non sono standard. Data una reazione redox che avvenga in una cella elettrochimica, il potenziale di semicella E e quello di cella ΔE sono rispettivamente: R T E E0 ln Q nF R T E E0 ln Q nF Se T = 25°C, sostituendo si può scrivere: 0,0592 E E0 log 10 Q n Ove n è il numero di elettroni trasferiti nella reazione globale così come scritta e Q è il quoziente di reazione di detta reazione. Nel caso ad esempio di: Cu/Cu2+/Ag+/Ag [Cu 2 ] Cu(s) Cu2+(aq) + 2e‾ n = 2; Q + 2Ag (aq) + 2e‾ 2Ag(s) [ Ag ]2 Cu + 2Ag+ Cu2+ + 2Ag 0,0592 E E0 log 10 Q n Sapendo che la f.e.m. standard di Cr|Cr3+||Ni2+|Ni vale 0,483 V, se [Cr3+] = 0,05 M e [Ni2+] = 0,01 M, calcolare la f.e.m. a 25 °C e 18°C. Calcolare il potenziale di una semicella costituita da un elettrodo di platino in una soluzione 0,2 M di permanganato di potassio, 0,05 M di cloruro manganoso e a pH = 3? 0,449 V; 0,447 V +1,23 V
Scaricare