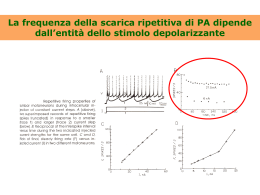
MISURA DEI SEGNALI INTRACELLULARI DI Ca2+ (Microscopia ad epiflurescenza) La fluorescenza Diagramma di Jablonsky Step 1 ECCITAZIONE: Quando un fluoroforo (una sostanza in grado di produrre il fenomeno della fluorescenza) assorbe un fotone di energia hnex passa dal livello fondamentale S0 ad un livello elettronico eccitato S1’ (detto singoletto). Step 2 STATO ECCITATO: Lo stato eccitato permane per un breve lasso di tempo (1-10 x 10-9 sec), durante il quale dissipa parte dell’energia assorbita a causa di moti vibrazionali, passando ad uno stato eccitato S1 (detto singoletto rilassato) a energia lievemente inferiore rispetto a S1’. Step 3 FLUORESCENZA: il fluoroforo ritorna al livello fondamentale So in seguito ad emissione di un fotone di energia hnem A causa della parziale dissipazione di energia durante lo stato eccitato, l’energia del fotone emesso è minore rispetto a quella del fotone assorbito, pertanto la lunghezza d’onda è maggiore. hnex – hnem = spostamento di Stokes Eex ≥ Eem I fluorofori per il Ca2 • Started with EGTA, the first chelator shown to have high selectivity for Ca2+ over Mg2+ (~105). • Binding of Ca2+ is 1:1. • BAPTA made by converting aliphatic amino groups of EGTA into aromatic amino groups. • BAPTA retains high selectivity for Ca2+ over Mg2+ Coloranti raziometrici: il Fura-2 Il FURA-2 manifesta la singolare caratteristica di subire uno spostamento dello spettro di assorbimento in funzione della [Ca2+] libero In assenza di Ca2+, il fura-2 presenta uno spettro di eccitazione piuttosto ampio, con un picco a circa 380 nm. Quando si lega al Ca2+, lo spettro di eccitazione si sposta ancora di più nell’UV: picco a 340 nm. In presenza di Ca2+, quindi, l’intensità della fluorescenza emessa dal fura-2 (misurata a 510 nm) aumenta se si eccita a 340 nm (F340) e diminuisce se si eccita a 380 nm (F380). Coloranti raziometrici: il Fura-2 Ne consegue che eccitando alternativamente alle lunghezze d’onda di 340 nm e 380 nm si raccoglie una coppia di segnali alla lunghezza d’onda di emissione di 510 nm per ogni punto sperimentale. Effettuando il rapporto dei due valori è possibile, quindi, ottenere una misura che è indipendente dalla concentrazione dell’indicatore nel campione. Coloranti a singola : il Fluo-3 Spettri di emissione del Fluo-3 ottenuti eccitando alla lunghezza d’onda di 488 nm e in presenza di diverse concentrazioni di Ca2+ libero CALIBRAZIONE RAZIOMETRICA • utilizzabile solo con indicatori che presentano shift dello spettro di eccitazione o emissione • intensità di fluorescenza misurata a due lunghezze d’onda (con variazioni opposte del segnale a seguito del legame con il Ca2+) • elimina le variabili legate a concentrazione dell’indicatore, percorso ottico, intensità di eccitazione, efficienza di rilevazione Il caricamento delle cellule: acid vs. ester • Free acid forms of BAPTAbased indicators are hydrophobic and do not cross the plasma membrane (can be loaded by microinjection or in a patch pipette). • Addition of AM ester groups shields polar features and permits indicators to readily permeate the cell membrane. • Once inside, intracellular esterases convert indicators to free acid form which remains trapped inside the cell. Il caricamento delle cellule: acid vs. ester PROBLEMI: compartimentazione idrolisi incompleta dell’AM estere perdita di fluoroforo Microscopia a fluorescenza Specchio dicroico Xeno Mercurio (o monocromatore) Elemento chiave di un microscopio a fluorescenza. Permette di separare la luce di eccitazione da quella di emissione. Esso, infatti, è in grado di riflettere la luce al di sotto di una certa lunghezza d’onda (lunghezza di taglio) e di essere trasparente alla luce con lunghezze d’onda superiori. La luce di eccitazione viene, quindi, riflessa verso il preparato, ma solo la luce emessa dal fluoroforo raggiunge gli oculari del microscopio. Microscopia a fluorescenza
Scaricare