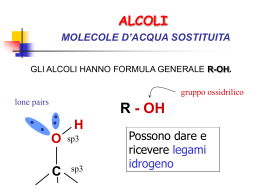
Propedeutica biochimica Alcoli Gli alcoli sono composti che presentano gruppi ossidrilici (GRUPPO FUNZIONALE) legati ad atomi di carbonio saturi, con ibridazione sp3 Nomenclatura degli alcoli Vengono innanzitutto classificati come primari , secondari e terziari a seconda di quanti atomi di carbonio siano legati al C che porta il gruppo ossidrilico. Le regole IUPAC per gli alcoli più semplici fanno riferimento all’alcano progenitore con le seguenti regole: Identificare la catena carboniosa più lunga contenente il gruppo ossidrilico e sostituire nel nome la –o, con –olo (se i gruppi sono >1, si fa precedere il suffisso olo da di, tri….) 2-propen-1-olo (detto alcol allilico) Numerare la catena in modo che il C con il gruppo alcolico abbia il numero più basso (detto alcol tert-butilico) anche se sono2-metil-2-propanolo presenti altri sostituenti e questi devono avere il numero più basso possibile a loro volta 1,2-etandiolo (detto glicole etilenico) 1,2,3-propantriolo (detto glicerolo) Propedeutica biochimica Proprietà fisiche e chimiche degli Alcoli In relazione ai corrispondenti alcani gli alcoli hanno p.ti ebollizione molto più alti: ciò dipende dalla formazione di legami idrogeno intermolecolari Hanno, come l’acqua, la caratteristica di essere leggermente acide (Ka simili alla dissociazione dell’acqua): in soluzione acquosa diluita, le molecole si dissociano in piccola quantità cedendo un protone all’acqua: R-O-H + H2O ↔ R-O- + H3O+ Preparazione di alcoli: 1) Per idratazione di un alchene 2) Per riduzione di composti carbonilici R-C =C-R + H-O-H → R-CH-C(OH)-R C = O + [H] (agente riducente) → C-OH H Aldeidi e chetoni per riduzione danno rispettivamente un alcol primario ed un alcol secondario Propedeutica biochimica Reazioni degli alcoli 1) Disidratazione [H+] R-CH2-CH2-OH → R- CH=CH2 + H2O alcool alchene [o] [o] 2) Ossidazione degli alcoli R- CH2OH → R-COH → R-COOH alcol primario R-CH-R’ │ OH Alcol secondario 3) Sintesi di esteri aldeide [o] → ac.carbossilico R- C- R’ ║ O chetone Gli alcoli terziari non reagiscono all’ossidazione Possono essere sintetizzati per mezzo di una reazione di sostituzione nucleofila acilica tra un acido carbossilico e un alcol con rilascio di acqua Propedeutica biochimica Fenoli Gruppo funzionale ossidrilico, legato all’anello aromatico Nomenclatura Segue le regole viste per il benzene e gli areni, solamente che la radice non è più – benzene, ma -fenolo idrossibenzene 1-idrossi-3-cloro benzene 1-idrossi-4-metil-benzene 1-idrossi-2,4-dinitrobenzene Proprietà fisiche dei fenoli Rispetto agli areni presentano un p.to di ebollizione più elevato, per la formazione di legami ad idrogeno Propedeutica biochimica Proprietà dei Fenoli Sono molto più acidi degli alcoli perché lo ione Fenossido è stabilizzato dalla risonanza dell’anello aromatico L’acidità dei fenoli può essere modificata in senso negativo o positivo, dalla presenza dei sostituenti: gruppi elettronaccettori stabilizzano l’anione fenosido mantenendo gli elettroni delocalizzati sull’anello con un aumento dell’acidità, mentre i gruppi elettrondonatori destabilizzano l’anione diminuendo l’acidità del composto Propedeutica biochimica Reazioni dei Fenoli 1) Reazioni di sostituzione elettrofila aromatica Il gruppo ossidrile è un sostituente orto-, para- orientante piuttosto forte, ciò li rende particolarmente reattivi nelle reazioni di alogenazione, nitrazione e solfonazione. Propedeutica biochimica 2) Ossidazione dei fenoli: CHINONI O ║ CH3 Vitamina K2 CH3 │ CH3 │ CH2- (CH = C – CH2 – CH2)5 – CH = C – CH3 ║ O CH3O CH3O O ║ CH3 Coenzima Q CH3 │ (CH2 – CH = C – CH2)n H ║ O I chinoni sono una interessante classe di molecole per la loro caratteristica di ossidoriduzione. Sono largamente utilizzati all’interno delle cellule, dove vengono chiamati UBICHINONI, per la loro ubiquità. Il loro ruolo è quello di trasferire elettroni associata alla produzione di energia metabolica Propedeutica biochimica Eteri Hanno un atomo di ossigeno legato a ponte tra due gruppi organici R-O-R’ Nomenclatura Nel caso degli eteri le regole IUPAC portano a due sistemi differenti di nomenclatura Gli eteri più semplici sono denominati preferenzialmente con il nome dei due residui organici a cui è aggiunto il termine etere Se nella molecola sono presenti più di un legame etereo o altri gruppi sostituenti, allora il gruppo etereo viene considerato come un alcossi- sostituente sulla catena principale Propedeutica biochimica Proprietà degli eteri I punti di ebollizione sono molto più bassi a parità di catena con gli alcoli ed i fenoli: non formano infatti legami idrogeno Reazioni degli eteri Gli eteri sono composti piuttosto inerti nei confronti di molti composti utilizzati in chimica organica: sono infatti utilizzati spesso come solventi inerti in molte reazioni. Vanno incontro a facile rottura in presenza di acidi forti (il più usato l’acido iodidrico HI) •• R – O – R’ •• HI → H2O, 100° •• I•• [R – O+ - R’] → R – OH •• │ alcool H + R’I Alogenuro alchilico Propedeutica biochimica Eteri ciclici: epossidi o ossirani Gli eteri ciclici ad anello con più di tre atomi (sono anelli eterociclici: perché l’ossigeno partecipa alla formazione dell’anello come il carbonio. Tale molecole hanno comportamneto simile agli eteri aciclici e vengono percò utilizzati principalmente come solventi inerti. Caso particolare per il loro comportamento chimico sono i composti con anello triatomico detti appunto EPOSSIDI o OSSIRANI che possono essere anche intramolecolari La torsione dell’anello a tre atomi rende tali molecole altamente reattive. Per la loro preparazione viene utilizzato un passaggio in cui sono sintetizzati composti detti aloidrine (composti con alogeno e gruppo ossidrilico su C adiacenti) HO Br (CH3)2C = C (CH3)2 2,3 dimetil -2-butene Br2, H2O → │ │ (CH3)2C- C(CH3)2 O NaOH → (CH3)2C – C(CH3)2 2,3-dimetil-2,3-epossibutano Propedeutica biochimica Reazioni di apertura dell’anello Reagiscono con gli acidi come gli eteri aciclici, solo che le condizioni sono più blande e danno composti con gruppi alcolici vicinali (glicoli) O H C–C H H Ossido di etilene HO H H3O+ → H H C–C H H OH 1,2-etandiolo Glicole etilenico Propedeutica biochimica Tioli R-SH Lo zolfo è l’elemento che si trova esattamente sotto l’ossigeno nella tavola periodica e molti composti organici hanno i il loro analogo in cui l’ossigeno è sostituito dallo zolfo. I tioli sono gli analoghi degli alcoli perciò la loro nomenclatura rimane regolamentata nel medesimo modo usando però il suffisso –tiolo in luogo di –olo. Il gruppo –SH viene anche indicato come gruppo mercapto. Hanno la caratteristica saliente è l’odore terribile. I tioli possono essere ossidati da reagenti blandi per dare disolfuri: 2 RSH ↔ R – S – S - R Propedeutica biochimica Aldeidi e chetoni R (R’ o) H C=O (gr. Carbonilico) Gruppo acile All’interno del radicale acile R può essere un alchile, un arile, un alchenile o un alchinile. Nel legame C =O del gruppo carbonile, il C ha ibridazione sp2 e forma legami , mentre il quarto elettrone di valenza rimane in un orbitale p. Tale orbitale si sovrappone all’orbitale p dell’ossigeno formando il doppio legame. La molecola è planare a livello del gruppo carbonilico, ed inoltre il legame C-O è polarizzato a causa della differenza di elettronegatività dei due elementi. Il C funge da sito elettrofilo (acido di Lewis), mentre l’O funge da sito nucleofilo (base di Lewis). Propedeutica biochimica Nomenclatura delle aldeidi Si ottiene il nome sistematico delle aldeidi sostituendo l’ultima lettera –o dell’alcano corrispondente con il suffisso -ale La catena più lunga scelta deve contenere il gruppo aldeidico –CHO ed il C carbonilico deve essere numerato 1. Per aldeidi più complesse in cu il gruppo –CHO è legato ad un anello, viene usato il suffisso carbaldeide Propedeutica biochimica Nomenclatura dei chetoni I chetoni vengono nominati sostituendo la lettera finale –o dell’alcano con il suffisso -one, fermo restendo che la catena più lunga scelta debba contenere il gruppo chetonico, il cui C carbonilico deve avere il numero più basso. Se sono presenti altri gruppi funzionali per cui il gruppo carbonilico deve essere considerato un sostituente, viene impiegato il prefisso -oxo Alcuni chetoni hanno mantenuto il nome comune: N.B. quando si considera il gr. –COR come sostituente si usa il termine acil, mentre per il gruppo –CHO prende il nome di formil e il gruppo –COAr di aroil Propedeutica biochimica Preparazione di aldeidi e chetoni Ricordiamo quanto detto trattando gli alcoli: Per ossidazione (sottraggo due H) di un alcol primario ottengo un’aldeide Per ossidazione (sottraggo due H) di un alcool secondario ottengo un chetone Reattività chimica 1) Ossidazione Le aldeidi sono rapidamente ossidate ad acidi carbossilici, mentre i chetoni si ossidano solamente in condizioni particolarmente drastiche. Tale differenza è legata alla presenza dell’H nel gruppo aldeico, che è assente in quello chetonico. Propedeutica biochimica 2) Addizione nucleofila (nucleofili, -OH, -H-, carbanioni, acqua, ammoniaca, alcoli) Le aldeidi in generale sono più reattive dei chetoni per motivi di ingombro sterico, sia per l’assetto elettronico. Il legame C =O risulta più polarizzato e il carbocatione che si forma nelle aldeidi e stabilizzato da un unico gruppo alchilico anziché da due. Interesse biochimico E’ una reazione acido –catalizzata che dà un composto intermedio costituito da un idrossi-etere detto semiacetale Propedeutica biochimica Idrocarburi policiclici aromatici (IPA) naftalene
Scaricare