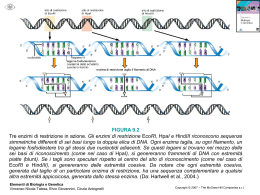
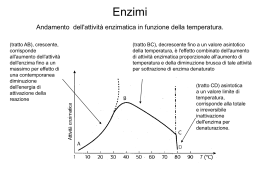
UNIVERSITÀ DEGLI STUDI DI SIENA a.a. 2007-08 curriculum: molecolare ciclo: XXIII dottorando/a: Cecilia Pozzi docente tutor: Prof. Stefano Mangani Dipartimento di afferenza: Dipartimento di Chimica Titolo del progetto di ricerca: Studi strutturali e funzionali delle interazioni fra enzimi di eucarioti e proteine accessorie o peptidi RELAZIONE 1° ANNO di DOTTORATO La timidilato sintasi è un’enzima dimerico conivolto nella biosintesi del DNA in quanto catalizza la metilazione riduttiva del 2’-desossiuridina-5’-monofosfato (dUMP) a 2’-desossitimidina-5’- monofosfato (dTMP), usando N5,N10- metilenetetraidrofolato come cofattore. A causa della loro funzione questi enzimi sono importanti target nella chemioterapia antitumorale (TS umana) e antibatterica (TS batterica). Gli studi strutturali in corso sull’enzima timidilato sintasi umana (hTS) hanno come finalità la progettazione di nuove molecole che impediscano la formazione della struttura quaternaria di hTS, dato che esso è in grado di esplicare la sua funzione solo in forma di dimero stabile. Analizzando la struttura all’interfaccia del monomero di hTS è stata progettata una libreria di peptidi di varia lunghezza che potessero legarsi in tale regione rendendo impossibile la formazione dell’oloenzima attivo. Dai saggi d’inibizione dell’attività enzimatica è risultato che alcuni peptidi hanno attività inibitorie incoraggianti; si è cercato quindi di determinare la struttura dei complessi enzima-peptide al fine di dare una conferma strutturale all’attività inibitoria osservata. Gli studi strutturali in corso su hTS sono rivolti inoltre alla progettazione di molecole ad attività inibitoria aventi struttura analoga ai substrati naturali dell’enzima. Si è cercato quindi di determinare la struttura di complessi hTSinibitori folato analoghi e dUMP analoghi. Effettuata la determinazione della struttura cristallografica si è evidenziato un problema conformazionale dell’enzima dovuto allo switch del loop catalitico in una posizione non esposta nel sito catalitico quindi ritenuta inattiva. Tale cambiamento conformazionale sembra essere dovuto alle condizioni di cristallizzazione che prevedono la presenza di elevata quantità di sale nella soluzione precipitante; questa considerazione è sostenuta anche da dati riportati in letteratura secondo cui la presenza di alte concentrazioni da sale stabilizza la forma inattiva di hTS. L’esposizione della cisteina catalitica sulla superficie del sito catalitico è fondamentale per poter osservare interazioni con gli inibitori che ci si proponeva di co-cristallizzare e per i quali non è stato quindi possibile valutare la regione di binding con l’enzima. Sono stati quindi effettuati studi di dicroismo circolare per valutare eventuali effetti di tale sale sulla struttura secondaria dell’enzima. Parallelamente a ciò si è cominciato a cercare nuove condizioni di cristallizzazione che prevedano la presenza, nella soluzione precipitante, di basse concentrazioni saline al fine di evitare l’induzione di una conformazione inattiva dell’enzima. Target del nostro progetto di ricerca sono anche le timidilato sintasi batteriche e la loro inibizione attraverso molecole ad attività antibiotica. A tale proposito si sta procedendo alla determinazione della struttura cristallografica delle timidilato sintasi di Enterococcus faecalis (EfTS) e di Pneumocystis carinii (PcTS) nella loro forma APO e in complessi con inibitori. Gli inibitori attualmente oggetto di studio sono strutture folato analoghe che hanno presentato buone attività inibitorie verso gli enzimi di interesse. Per tali molecole si cerca quindi di determinare la struttura cristallografica del complesso termario TS-dUMP-inibitore al fine di valutare i principali punti di interazione con l’enzima. Le informazioni ricavabili dall’analisi delle strutture cristalline costituiranno la base per una successiva ottimizzazione dei lead ottenuti, per giungere quindi alla progettazione di molecole ad attività inibitoria crescente. Presenze a Congressi e Scuole: • International school of crystallography - 40th course: “From molecules to medicines: interacting crystallography in drug discovery” 29 May - 8 June 2008, Erice, Italy • 1st SIMP-AIC Joint meeting “Learning from and for the Planet Earth – Structures and models in Earth, Materials and Life Sciences” 7-12 September 2008, Sestri Levante, Italy
Scaricare