Molti prodotti di uso comune contengono ACIDI e BASI.
I detergenti da bagno contengono sia HCl che NaOH; la
maggior parte dei detergenti per il vetro contiene
Ammoniaca acquosa. Molti medicinali sono ACIDI e BASI:
l’Aspirina e la Vitamina C sono ACIDI; le comuni pastiglie
antiacido contengono il CaCO3, i lassativi Mg(OH)2, entrambi
BASI.
2
6y
3
ACIDI e BASI
La parola “ACIDO” deriva dal latino acidus = aspro (era usato
originariamente per l’aceto, poi per sostanze che avevano un
sapore aspro e capacità di corrodere).
Il termine “ALCALE” deriva da una parola araba usata per
indicare le ceneri ottenute dalla combustione di certe piante; la
potassa (K2CO3) è un prodotto di questo processo e poiché le
soluzioni acquose di potassa sono saponose al tatto e hanno
sapore amaro, questo termine fu usato per sostanze con
queste proprietà.
Definizione di ARRHENIUS (1859-1927)
Un acido è una sostanza che produce protoni (H+ o ioni
idrogeno) quando si scioglie in acqua.
Una base è una sostanza che produce ioni idrossido (OH-)
quando si scioglie in acqua.
HCl(aq)→H+(aq) + Cl-(aq)
NaOH(aq)→Na+(aq) + OH-(aq)
Le proprietà caratteristiche di ACIDI e BASI sono dovute alla
presenza in soluzione di questi ioni e la forza di un acido o di
una base dipende dalla quantità degli ioni presenti.
Acido + Base → Sale + Acqua (Reazione di neutralizzazione)
HCl(aq) + NaOH(aq) )→Na+(aq) + Cl-(aq) + H2O(l)
4
1.
La definizione di Arrhenius è limitata solo alle soluzioni
acquose poiché fa riferimento agli ioni (H+ e OH-)
provenienti dall’acqua.
2.
Il semplice protone non idrato non esiste in soluzione
acquosa. La diffrazione dei raggi X indica che il protone è
meglio rappresentato dal cluster H+(H2O)4 o H9O4+ dove è
associato con 4 molecole di H2O mediante legame
idrogeno. Si rappresenta normalmente lo ione H+(aq) come
H3O+, lo ione idronio. Analogamente la tipica struttura
dello ione idrossido acquoso è OH(H2O)3- o H7O4- e le altre
teorie usano la designazione OH-(aq).
Teoria di BR∅NSTED-LOWRY (1859-1927)
Un acido è una sostanza capace di donare un PROTONE ad
un’altra sostanza:
HNO3 (aq) + H2O(l ) → H3O + (aq) + NO-3 (aq)
Una base è una sostanza capace di accettare un PROTONE da
un’altra sostanza:
NH3 (aq) + H2O(l ) → NH+4 (aq) + OH− (aq)
Acidi come HCl, HNO3 e CH3CO2H (ac. Acetico), capaci di
donare un protone, sono detti monoprotici; gli altri acidi,
5
capaci di donare due o più protoni, sono detti poliprotici
(H2SO4, H2CO3, H3PO4).
Gli anioni degli acidi poliprotici, SO42-, PO43-, CO32-, che
possono accettare più di un protone sono basi poliprotiche.
Molecole o Ioni che possono comportarsi sia da ACIDI che da
BASI sono SOSTANZE ANFIPROTICHE o ANFOTERE:
+
−
HCl (aq) + H2O (l ) → H3O (aq) + Cl (aq)
acido
base
→
NH+4 (aq) + OH− (aq)
NH3 (aq) + H2O (l ) ←
base
acido
Una reazione acido-base consiste nel trasferimento di un
protone da un acido ad una base:
acido1+base2
base1+acido2
6
l’acido1 cedendo il protone si trasforma nella sua base
coniugata (b.c.), mentre la base2 acquistando il protone si
trasforma nell’acido coniugato (a.c.).
HCl ha una forte tendenza a donare un protone e formare la
sua base coniugata Cl-, quindi è un ACIDO FORTE; la reazione
di dissociazione in H2O procede completamente verso destra.
base più forte
di Cl -
HCl(aq) + H2O(l )
→ H3O + (aq) +
Cl − (aq)
Base più debole
di H 2 O
Tanto più un acido ha tendenza a cedere protoni, tanto meno la
sua base coniugata ha tendenza ad accettarli.
La ionizzazione di HCl è il risultato della competizione tra le
molecole d’H2O e ioni Cl- per il protone; H2O è una base più
7
forte di Cl- e, quando è presente in eccesso, prende i protoni
da HCl, lasciandolo completamente ionizzato.
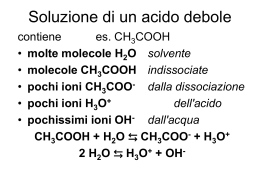
L’acido acetico, CH3CO2H è un’acido debole, cioè in H2O si
ionizza in misura molto piccola. All’equilibrio la soluzione
contiene per lo più CH3CO2H e solo una piccola quantità di
ione acetato e idronio; l’equilibrio è spostato verso l’acido e la
base più deboli:
CH3CO2H(aq) +
Base più debole
di CH 3 CO2 -
H2O(l )
→
←
Acido più debole
di H 3 O +
Acido più forte
di CH 3 CO2 H
H3O + (aq) + CH3CO2 − (aq)
Base più forte
di H 2 O
In generale tutte le reazioni di trasferimento di protone
procedono prevalentemente dalla coppia acido-base più forte a
quella più debole.
FORZA RELATIVA di ACIDI e BASI
La
rispettiva
forza
di
un
acido
(base)
può
essere
quantitativamente espressa con una costante di equilibrio
detta costante di dissociazione acida (basica), Ka (Kb).
Per un generico acido HA si può scrivere:
Base 2
→
+
Base1
−
HA(aq) + H2O(l ) ← H3O (aq) + A (aq)
Acido 1
Acido 2
[H3O + ][A- ]
Kc =
[HA][H2O]
8
l’H2O, funzionando da solvente, è in forte eccesso, quindi la
sua concentrazione può ritenersi costante e pari a quella
dell’acqua pura:
[H2O ] =
1000gL−1
18gmol
−1
= 55.6molL−1
Combinando la costante [H2O] con Kc:
[H3O + ][A- ]
K a = K c [H2O] =
[HA]
Si può scrivere un’espressione d’equilibrio analoga per una
BASE DEBOLE B in H2O:
Acido 2
→
+
Base2
−
B(aq) + H2O(l ) ← BH (aq) + OH (aq)
Base 1
Acido 1
[BH+ ][OH- ]
=costante di dissociazione basica
Kb =
[B]
I valori di Ka e Kb offrono un criterio quantitativo per
classificare gli acidi e le loro basi coniugate (TABELLA).
9
10
Forza Acido
Ka
Forza b.c.
Kb
Forte
>1
Molto debole
< 10-16
Debole
da 1 a 10-16
Debole
da 1 a 10-16
Molto debole
< 10-16
Forte
>1
1.
Un valore grande di Ka indica che all’equilibrio sono
favoriti i prodotti; viceversa un valore piccolo di Ka indica
che sono favoriti i reagenti;
2.
Più debole è l’acido più forte è la sua base coniugata.
ACIDI FORTI e effetto livellante del SOLVENTE
Sono ACIDI FORTI (completamente dissociati in H2O) HCl, HBr
e HI, e gli ossiacidi (acidi contenenti ossigeno) HNO3, H2SO4 e
HClO4.
H3O+ è l’acido più forte che può esistere in acqua; tutti gli acidi
con maggiore tendenza di H3O+ a donare protoni sono ionizzati
al 100%.
HClO 4 (aq) + H2O(l ) → H3O + (aq) + ClO-4 (aq)
HCl(aq) + H2O(l ) → H3O + (aq) + Cl- (aq)
Poiché in acqua gli acidi forti si convertono completamente in
H3O+ e nell’appropriato anione, sembrano avere tutti la stessa
forza acida (non si può definire una Ka perché la reazione è
completa). Questo fenomeno è noto come livellamento della
forza degli acidi a quella di H3O+.
11
Cambiando solvente (es NH3, Et2O) si dovrà confrontare la
tendenza a donare protoni con la Ka del solvente protonato
(NH4+).
In
etere
etilico,
Et2O,
mentre
HClO4
è
ancora
completamente dissociato, HCl lo è solo parzialmente:
Et2OH+ (l) + Cl-(solv)
HCl(solv) + Et2O (l)
In questo modo si può distinguere la forza relativa degli ACIDI.
ACIDI DEBOLI
In soluzione acquosa sono parzialmente dissociati. Possono
essere:
1. molecole neutre come CH3CO2H (acido acetico, Ka=1.8×10-5),
HCN
(acido
Ka=4.0×10-10),
cianidrico,
H2CO3
(acido
carbonico, Ka=4.2×10-7), etc.
→
HCN(aq) + H2O(l ) ← H3O + (aq) + CN- (aq)
2. cationi come NH4+ (ione ammonio, Ka=5.6×10-10):
→
NH4+ (aq) + H2O(l ) ← H3O + (aq) + NH3 (aq)
3. anioni come H2PO4- (di-idrogeno fosfato, Ka=6.2×10-8), l’acido
presente nel lievito chimico in polvere
→
H2PO 4− (aq) + H2O(l ) ← H2PO24- (aq) + H3O + (aq)
12
BASI FORTI e effetto livellante del SOLVENTE
Sono BASI FORTI (completamente dissociati in H2O) gli
idrossidi e gli ossidi dei metalli dei gruppi 1A e 2A (alcalini e
alcalino-terrosi) con NaOH e KOH più comuni.
OH- è la base più forte che può esistere in acqua; tutte le basi
più forti di OH- sono quindi completamente dissociate in
acqua.
O2- (aq) + H2O(l ) → 2OH- (aq)
CaO(s) + H2O(l ) → Ca(OH)2 (s)
calce spenta
L’acqua livella la forza delle basi a quella di OH-.
BASI DEBOLI
In soluzione acquosa sono parzialmente dissociate. Possono
essere:
4. molecole neutre come NH3 (ammoniaca, Kb=1.8×10-5), C5H5N
(piridina, Kb=1.5×10-9) etc.
→
NH3 (aq) + H2O(l ) ← NH+4 (aq) + OH- (aq)
5. anioni come CN- (cianuro, Kb=2.5×10-5), la base coniugata
dell’HCN
→
CN- (aq) + H2O(l ) ← HCN(aq) + OH- (aq)
CN- ha una forza basica intermedia tra NH3 e CO32- e quindi
reagisce con l’acqua rendendo basica la soluzione.
13
In generale, la base coniugata di un’acido debole reagisce con
l’acqua rendendo basica la soluzione!
Acidi
Forti
+
Livellati
H3O
Acidi
Deboli
H2O
Basi
Deboli
OH-
Ba si
Forti
Livellate
La costante di ionizzazione dell’H2O, Kw.
L’ H2O si autoionizza, trasferendo un protone da una molecola
d’acqua ad un’altra e formando uno ione idronio e uno ione
idrossido:
→
2H2O(l ) ← H3O + (aq) + OH- (aq)
L’equilibrio è spostato a sinistra poiché OH- è una base più
forte di H2O e H3O+ è un’acido più forte di H2O. La costante di
equilibrio Kc è:
Kc =
[H3O + ][OH- ]
[H2O]2
14
Nell’acqua pura o nelle soluzioni diluite (<0.1M), [H2O] può
essere considerata costante (55.6 molL-1) e quindi [H2O]2 viene
incluso nella Kc:
K c [H2O]2 = [H3O + ][OH- ] = K w
Kw è conosciuta come “costante di ionizzazione dell’acqua”.
In acqua pura, T=25°, [H3O+] = [OH-]. Misure di conducibilità
elettrica in acqua pura mostrano che:
[H3O+] = [OH-] = 1.0 ×10-7 M
K w = [H3O + ][OH- ] = 1.0 × 10-14
si dice che l’acqua pura è neutra.
L’aggiunta di un acido aumenta la [H3O+] così come l’aggiunta
di una base aumenta la [OH-].
• Soluzione neutra [H3O+] = [OH-] = 1.0 ×10-7 M.
• Soluzione acida [H3O+] > [OH-];
[H3O+] > 1.0 ×10-7 M e [OH-] < 1.0 ×10-7 M.
• Soluzione basica [H3O+] < [OH-];
[H3O+] < = 1.0 ×10-7 M e [OH-] > 1.0 ×10-7 M.
15
Relazione tra le costanti di ionizzazione di un acido e
della sua base coniugata.
Se consideriamo la Ka e la Kb di un acido e della sua base
coniugata:
HA+H2O
H3O++A-
A-+H2O
[H3O + ][A- ]
Ka =
[HA]
K a × Kb =
Kb =
[H3O + ][A- ][HA][OH- ]
[HA][A- ]
HA+OH-
[HA][OH- ]
[A - ]
= [H3O + ][OH- ] = K w
Ka × Kb = Kw
TANTO PIÙ FORTE È UN ACIDO, TANTO PIÙ DEBOLE È LA
SUA BASE CONIUGATA.
La scala del pH
È possibile esprimere la [H3O+] con una nuova funzione che
eviti l’uso di numeri molto piccoli o in forma esponenziale.
Viene usata una notazione logaritmica, la scala del pH, per
esprimere l’acidità o basicità delle soluzioni. Il pH di una
soluzione è il logaritmo negativo in base 10 di [H3O+]:
16
pH = −log[H3O + ] ♦
pOH = −log[OH− ]
In acqua pura, T=25°C, [H3O+] = [OH-] = 1.0 ×10-7 M:
pH = −log(1.0 × 10- 7 ) = 7.00
pOH = −log(1.0 × 10- 7 ) = 7.00
K w = [H3O + ][OH- ] = 1.0 × 10 −14
− log([H3O + ][OH- ]) = − log(1.0 × 10 −14 )
− log([H3O + ]) + -log([OH- ]) = 14.00
pH + pOH = 14.00
La somma del pH e pOH di una soluzione acquosa a 25°C deve
essere uguale a 14.
La relazione tra acidità, basicità e pH o pOH è illustrata
graficamente nel seguente diagramma:
♦
In generale pX = -logX, dove X può essere una qualunque grandezza
misurabile.
17
18
Calcolo del pH di ACIDI (BASI) FORTI DILUITI
Gli ACIDI e le BASI FORTI sono completamente dissociati nel
campo delle concentrazioni ordinarie (fino a ∼ 1M) per cui il
calcolo del pH è immediato:
+ ] = 0.1M
[H3Oaq
HCl(aq) = 0.1 M
pH = 1
− ] = 0.1M
[OHaq
NaOH(aq) = 0.1 M
pH = 13
Quando aumenta la diluizione, la concentrazione di [H3O+] e
[OH-] che provengono dall’autodissociazione dell’acqua (e che
sono sempre presenti) possono non essere più trascurabili nel
calcolo del pH.
Calcolare il pH di una soluzione di HCl(aq) 1.0 ×10-9 M
1.
2H2O(l)
2.
c0-x
OH-(aq) + H3O+(aq)
x
cHCl+x
3.
Kw = [H3O+] [OH-] = (x+1.0 ×10-9)(x)
4.
x + 1.0 ×10 x - Kw = 0
2
-9
x≈1.0 ×10-7 M
x1,2
pH≈7
- b ± b 2 - 4ac
=
2a
19
Calcolo del pH di ACIDI (BASI) DEBOLI
La conoscenza delle costanti di equilibrio di ACIDI e BASI
DEBOLI permette di calcolare il pH di una soluzione di un
acido o base debole.
Esempio. Calcolare il pH di una soluzione di CH3COOH 0.1 M
(Ka=1.8×10-5 M).
1.
2.
CH3COOH(aq) + H2O(l)
CH3COO-(aq) + H3O+(aq)
+
[CH3COO ][H3O ]
−5
Ka =
= 1.8 × 10
[CH3COOH]
3.
Equazione bilancio di massa: c0 = [CH3COOH] + [CH3COO-]
4.
Equazione bilancio di carica: [H3O+] = [CH3COO-]
+ 2
[H3O ]
K =
a
+
c - [H3O ]
0
trascurando H3O+ rispetto a c0*
pH = ½ pKa – ½ logc0 = 2.9
[H3O + ]
quantità di acido dissociato
× 100 =
%dissociazione =
× 100
c
concentrazione iniziale di acido
0
*
Questa approssimazione è valida tutte le volte che [HA]0 > o = 100 Ka
20
In generale se l’acido debole non è ionizzato più del 10% per il
calcolo del pH si può usare l’espressione semplificata:
[H3O + dalla dissociazi one dell' acido debole][base coniugata]
Ka =
[acido debole]iniziale
Determinazione del pH
Il pH di una soluzione può essere determinato in modo
approssimato mediante l’uso di un indicatore. Gli INDICATORI
sono
ACIDI
(BASI)
DEBOLI
che
hanno
BASI
(ACIDI)
CONIUGATE di colore diverso da quello degli ACIDI (BASI).
HIn + H2O
H3O+ + In-
Se si aggiunge un ACIDO, secondo il principio di Le Chatelier,
l’equilibrio si sposta a sinistra; viceversa se si aggiunge una
base.
K a(HIn) =
+
[In ][H3O ]
[HIn]
[In- ]
pH = pK a(HIn) + log
[HIn]
[HIn]
+
[H3O ] = K a(HIn)
[In ]
quando [HIn]=[In-]
21
l’indicatore è per metà nella sua forma acida e per metà nella
sua forma basica (colore intermedio)
pH = pK a(HIn) + log 1 = pK a(HIn)
Il pH a cui un indicatore cambia colore dipende dal suo pKa.
Quando [HIn] ≥ 10[In- ] si apprezza il colore della forma acida;
se [In- ] ≥ 10[HIn] il colore che si apprezza è quello della forma
basica. La variazione visibile di colore avviene nell’intervallo:
pH = pK a(HIn) + log 10 = pK a(HIn) ± 1
22
FENOLFTALEINA, Ka=3.0×10-10
PORPORA
OH
O
pKa=9.5
HO
C
O
C
O
+ H2O
+
H 3O +
HO
C
O
C
O
INCOLORE
È una mescolanza di vari indicatori che cambia colore in modo
continuo in un ampio intervallo di pH. La cartina indicatrice è
impregnata con un indicatore universale.
Per una misura accurata del pH si deve usare il pHmetro uno
strumento che misura la differenza di potenziale tra la
soluzione in esame e una soluzione standard a pH noto.
23
PROPRIETÀ ACIDO-BASE DEI SALI: IDROLISI
Un sale in soluzione acquosa è completamente dissociato in
ioni idratati.
Se i cationi e gli anioni sono rispettivamente gli acidi e le basi
coniugate di basi e acidi forti, non hanno alcuna tendenza a
competere con l’acqua per il protone e quindi il pH non viene
modificato:
NaCl(s ) → Na + (aq ) + Cl- (aq )
one
{ Dissociazi
+}
Idratazione
Quando invece i cationi e gli anioni sono gli acidi e le basi
coniugate di basi e acidi deboli, allora possono competere con
l’acqua per il protone. Si osserva variazione di pH (IDROLISI).
Si ha una reazione di IDROLISI *, quando un sale, sciolto in
acqua, produce delle variazioni nelle concentrazioni di H3O+ e
OH- dell’acqua.
IDROLISI ACIDA: pH<7
1. I cationi (acidi coniugati) di basi deboli sono acidi deboli
NH4Cl(s ) → NH4+ (aq ) + Cl- (aq )
→
NH4+ (aq) + H2O(l ) ← H3O + (aq) + NH3 (aq)
Ka =
[H3O + ][NH3 ]
[NH+4 ]
=
[H3O + ][NH3 ][OH- ]
[NH4+ ][OH- ]
=
Kw
= Kh
Kb
Il pH della soluzione risultante è acido.
*
La parola “IDROLISI” significa “rottura di una sostanza in pezzi” (-lisi) mediante
acqua (idro-).
24
2. Gli ioni metallici idratati in cui il metallo ha carica positiva 2
o maggiore e quindi alto potere polarizzante (alta carica/
piccolo raggio).
3+
→
2+
3+
→
[Al(H2O)6 ](aq) + H2O(l ) ← H3O + (aq) + [Al(H2O)5 OH](aq)
2+
[Fe(H2O)6 ](aq) + H2O(l ) ← H3O + (aq) + [Fe(H2O)5 OH](aq)
La carica sullo ione metallico attrae elettroni dai legami OH,
rendendo gli idrogeni più acidi di quanto non siano nelle
molecole d’acqua libere.
Gli unici ioni metallici idratati che non si comportano da acidi
e danno soluzioni neutre in acqua sono:
Li+ , Na + , K + , Rb + , Cs + , Mg2 + , Ca 2 + , Sr 2 + , Ba 2 + , Ag+
Tutti gli altri ioni metallici idratati danno in acqua soluzioni
acide.
IDROLISI BASICA: pH>7
1. Gli anioni (basi coniugate) di acidi deboli sono basi deboli
CH3COONa( s ) → CH3COO- (aq ) + Na + (aq )
→
CH3COO- (aq ) + H2O(l ) ← CH3COOH(aq) + OH− (aq)
Kh =
[CH3COOH][OH- ]
[CH3COO- ]
=
[CH3COOH][OH- ][H3O + ]
[CH3COO- ][H3O + ]
=
Kw
= Kb
Ka
25
Altri anioni con proprietà basiche sono CN-, CO32-, F-, S22. Gli anioni contenenti idrogeno che derivano da acidi
poliprotici quali HCO3-, HPO42- per i quali Kb > Ka
Esempio. Calcolare il pH di una soluzione di CH3COONa 0.15 M
(Ka=1.8×10-5 M).
CH3COO-(aq) + H2O(l)
CH3COOH(aq)+ OH-(aq)
K
[CH3COOH][OH ]
[OH- ]2
=
= w
K =
h
[CH3COO ]
c 0 - [OH- ] K a
trascurando OH- rispetto a c0*
pOH = ½ pKw – ½ pKa – ½ logc0
pH = ½ pKw + ½ pKa + ½ logc0 = 8.96
*
Questa approssimazione è valida tutte le volte che [HA]0 > o = 100 Ka
26
SOLUZIONI TAMPONE
Una soluzione che ha la capacità di mantenere un pH
sostanzialmente costante anche quando si aggiungono piccole
quantità di acidi o basi si chiama soluzione tampone. Le
soluzioni tampone sono costituite da un ACIDO DEBOLE + un
SALE dell’acido debole, o una BASE DEBOLE + un SALE della
base debole in quantità approssimativamente uguali.
CALCOLO del pH di una SOLUZIONI TAMPONE
Si consideri una soluzione che contiene sia CH3COOH che la
sua base coniugata, CH3COO- , 0.05M.
CH3COOH(aq) + H2O(l)
CH3COO-(aq) + H3O+(aq)
[CH3COO- ][H3O + ]
Ka =
= 1.8 × 10 −5
[CH3COOH]
ci
ceq
CH3COOH(aq) + H2O(l)
0.05
0.05-x
CH3COO-(aq) + H3O+(aq)
0.05
0.05+x
Ka =
x
(0.05 + x)(x)
= 1.8 × 10 −5
(0.05 − x)
L’acido acetico è debole, quindi x è piccolo rispetto a ci = 0.05
M; per il Principio di Le Chatelier, gli ioni CH3COO- reprimono
la dissociazione di CH3COOH per cui x si può trascurare.
27
(0.05)(x)
= 1.8 × 10 −5 M
(0.05)
x = [H3O+]=1.8×10-5
pH=4.74
In generale
HA+H2O
H3O++A
[H3O + ][A- ]
Ka =
[HA]
[H3O + ] = K a
[HA]
[A - ]
[A - ]
pH = pK a + log
[HA]
eq
Le concentrazioni di equilibrio di HA e A- non sono molto
diverse dalle concentrazioni iniziali dell’acido debole (ca) e del
sale con la sua base coniugata (cs). Quindi
cs
ca
Equazione di Henderson-Hasselbach
pH = pK a + log
Un tampone ha la massima capacità di opporsi a variazioni di
pH quando sia l’ACIDO che il SALE con la sua BASE
CONIUGATA sono presenti in quantità circa uguali
ca=cs ⇒ pH = pKa
28
CAPACITÀ TAMPONANTE.
È la quantità di acido o base che si deve aggiungere per
ottenere una variazione di pH significativa; dipende da ca e cs.
Tanto maggiore è la capacità tamponante, tanto migliore è il
tampone. Di solito ca e cs sono nell’intervallo 0.1-1M.
Il tampone per un dato intervallo di pH viene scelto sulla base
del pKa dell’acido debole:
1. per tamponare una soluzione a pH ≅ 5, si può scegliere un
tampone CH3COOH- CH3COONa (pKa=4.74);
2. per tamponare una soluzione a pH ≅ 9, si può scegliere un
tampone NH3- NH4Cl (pKa(NH4+)=9.25);
3. per tamponare una soluzione a pH ≅ 7, si può scegliere un
tampone H2PO4- - HPO42- (pKa2=7.21). *
In ogni caso le variazioni di pH in una soluzione tampone sono
molto inferiori che in acqua per aggiunta della stessa quantità
di acido o base.
Esempio: si aggiungano 0.001 mol di HCl ad 1 L di H20 e soluzione
tampone CH3COOH- CH3COONa 1 M.
molHCl
H2O
0
pH = ½ pKw = 7
1×10-3
pH = -log[H3O+] = 3
*
CH3COOH/ CH3COONa
c
pH = pK a + log s = pK a = 4.74
ca
1 - 0.001
pH = pK a + log
≅ pK a
1 + 0.001
Il pH del sangue (≅ 7.4) è mantenuto costante da diverse coppie coniugate
ACIDO-BASE H2PO4-/ HPO42-, H2CO3/ HCO3-
29
NEUTRALIZZAZIONE
La reazione spontanea tra un acido e una base produce acqua
e ioni:
HA(aq) + BOH(aq) → B + (aq) + A - (aq) + H2O(l )
la reazione netta è:
H+ (aq) + OH- (aq) → H2O(l )
poiché una mole di H+ reagisce con una mole di OH- si
definiscono per comodità gli equivalenti:
1 equivalente di acido = quantità che libera 1 mole di H+
1 equivalente di base = quantità che libera 1 mole di OHSi definisce NORMALITÀ (N) il n° di equivalenti di soluto per
litro di soluzione. Esprimendo la concentrazione in questo
modo, VOLUMI UGUALI di soluzioni aventi la stessa normalità
contengono lo stesso numero di ioni OH- e H+:
HCl, NaOH
H2SO4, Ca(OH)2
1eq=1mol
1eq=½ mol
Quando la reazione acido-base avviene tra un’acido forte e una
base forte, la soluzione risultante è neutra e la reazione si
chiama NEUTRALIZZAZIONE
H+ (aq) + Cl - (aq) + Na + (aq) + OH- (aq) → Na + (aq) + Cl - (aq) + H2O(l )
NaCl
(sale neutro)
30
TITOLAZIONI ACIDO-BASE
È un metodo utilizzato per ricavare la concentrazione (titolo)
incognita di un acido (o base) aggiungendo volumi noti di base
(o acido) a titolo noto fino a neutralizzazione. A questo punto,
detto punto di equivalenza, il numero di equivalenti di acido e
base sono uguali. Per cogliere il punto di equivalenza si usa un
indicatore acido/base di pKIn opportuno.
Titolazione di un acido forte con una base forte:
50.0 mL di HCl 0.1 M con NaOH 0.1 M.
1. pH iniziale prima dell’aggiunta di base. [H3O+]=0.1M⇒pH=1
2. pH dopo un qualunque volume di base aggiunta fino al punto di
equivalenza:
[H3O + ] =
moli iniziali di acido - moli totali di base aggiunta
volume dell' acido + volume della base aggiunta
se si aggiungono 10 mL di NaOH
H3O + (aq) + OH- (aq) → 2H2O(l )
moliHCl iniziali=0.005;
[H3O + ] =
moliNaOH aggiunte=0.001;
0.005 - 0.001
0.004 mol
=
= 0.0667 M
50 mL (HCl) + 10mL (NaOH)
0.060 L
1000
pH = 1.18
3. pH al punto di equivalenza: pH = 7.00 a 25°C
31
4. pH dopo il punto di equivalenza:
in soluzione non è rimasto acido ma solo NaCl (sale neutro),
pertanto il pH dipende da [OH-] proveniente da NaOH aggiunto
[OH− ] =
moli di base in eccesso
volume totale (acido + base aggiunta)
se si aggiunge 1 mL di NaOH
[OH− ] =
(0.001L)(0.1M)
0.0500L acido + 0.0510L
= 9.9 × 10 - 4 M
base
pOH = 3.00; pH = 11.00
La rappresentazione grafica della variazione di pH in funzione del
volume (mL) di base (acido) aggiunto è detta curva di titolazione.
32
Vi è un rapido cambiamento del pH della soluzione in prossimità del
punto di equivalenza e qualunque indicatore con un pKa compreso
tra 4 e 11 è adatto per rilevarlo.
Titolazione di un acido debole con una base forte:
Consideriamo la curva di titolazione di 100.0 mL di CH3COOH 0.1
M con NaOH 0.1 M.
CH3COOH(aq) + OH- (aq) → CH3COO- (aq) + H2O(l )
1. pH iniziale prima dell’aggiunta di base:
pH = ½ pKa – ½ logca = 2.88
2. pH a metà della titolazione; in ogni punto tra l’inizio della
titolazione (CH3COOH) e il punto di equivalenza (CH3COONa)
33
siamo in presenza di un acido debole e del sale con la sua base
coniugata:
pH = pK a + log
[CH3COONa formato] (c s )
[CH3COOH rimanente](c a )
a metà titolazione
ca=cs ⇒ pH = pKa = 4.74
3. pH al punto di equivalenza: tutto l’acido è trasformato in sale il
cui anione ha carattere basico
→
CH3COO (aq ) + H2O(l ) ←
CH3COOH(aq) + OH− (aq)
pH = ½ pKw + ½ pKa + ½ logc0 = 8.96
In questo caso il punto di equivalenza non coincide con il
punto di neutralizzazione
4. pH dopo il punto di equivalenza:
la soluzione contiene CH3COONa + la quantità di base aggiunta in
eccesso dopo il punto di equivalenza. La [OH-] proveniente
dall’idrolisi dello ioe acetato è trascurabile, pertanto il pH dipende
da [OH-] proveniente da NaOH aggiunto
[OH− ] =
moli di base in eccesso
volume totale (acido + base aggiunta)
se si aggiunge 1 mL di NaOH
[OH− ] =
(0.001L)(0.1M)
0.0500L acido + 0.0510L
= 9.9 × 10 - 4 M
base
pOH = 3.00; pH = 11.00
34
ACIDI POLIPROTICI
Sono acidi che possono donare più di un protone
→
H2CO3 (aq) + H2O(l ) ← H3O + (aq) + HCO-3 (aq) K a1 = 4.3 × 10- 7
→
HCO-3 (aq) + H2O(l ) ← H3O + (aq) + CO23- (aq)
K a2 = 5.6 × 10-11
Ka = Ka1 × Ka2
H2SO4
prima dissociazione completa; ossoacido biprotico;
H2S
idracido biprotico;
H3PO4
ossoacido triprotico
In generale Ka1 > Ka2 >> Ka3. Le dissociazioni successive alla
prima sono più difficili perché si deve allontanare un protone
carico positivamente da una specie carica negativamente.
SALI ACIDI
Sono i sali di un acido che non ha ceduto tutti i protoni
salificabili: Ca(H2PO4)2, diidrogenofosfato di calcio; Ca(HPO4),
idrogenofosfato di calcio.
SALI BASICI
Sono i sali di una base dove non tutti gli ioni OH- sono stati
neutralizzati: Mg(OH)Cl, idrosso-cloruro di magnesio.
35
RELAZIONE FORZA-STRUTTURA
I valori di pKa per gli acidi (e pKb per le basi) dipendono da
numerosi fattori:
1. Polarità del legame H-A.
H
A H
+
H3O + A-
O
H
La formazione del legame a idrogeno è più probabile se il
legame A-H è polare, per cui quanto più il legame H-A è polare,
tanto maggiore è la forza dell’acido HA. L’elevata polarità del
legame OH rende acidi gli idrogeni dei gruppi –OH presenti in
molte molecole (H3PO3, CH3COOH).
2. Forza del legame H-A. Un acido è tanto più forte quanto più
il legame H-A risulta debole. Sebbene il legame H-F sia il più
polare, HF in acqua è un acido debole (pKa=3.45) mentre tutti
gli acidi alogenidrici HX sono forti. Questo comportamento
anomalo è dovuto alla particolare forza del legame H-F (569
kJ/mol, contro 431 kJ/mol per HCl, 366 kJ/mol per HBr e 297
kJ/mol per HI), che rende difficile la cessione del protone.
FORZA degli OSSOACIDI
Esistono due importanti regole empiriche che forniscono
indicazioni sulla forza degli ossoacidi del tipo XOn(OH)m, quali
H2SO4 (SO2(OH)2), H3PO4 (PO(OH)3), HClO4 (ClO3(OH)).
1. Il rapporto tra le Ka successive Kn/Kn-1 ≅ 10-4, 10-5
36
2. Ka1 dipende da n, numero di atomi di ossigeno in più rispetto
a quelli del gruppo OH. Questo si spiega considerando che
più grande è il numero (n+1) di atomi di ossigeno nella base
coniugata [XOn+1(OH)m-1]-, maggiore è la delocalizzazione e
più stabile l’anione.
n
K1
Forza Acido
3
molto grande
molto alta
2
≈102
alta
1
10-2-0-3
media
0
10-7.5-0-9.5
debole
Se H3PO3 fosse descrivibile come P(OH)3, la sua Ka1 sarebbe
≈10-8. Invece sperimentalmente si trova che Ka1≈10-2 e che solo
due idrogeni sono acidi: la sua struttura è HPO(OH)2, con un
atomo di idrogeno direttamente legato al fosforo. Anche per
H3PO2, Ka1≈10-2 e la sua struttura è H2PO(OH).
Nel caso di H2CO3 il valore misurato di Ka1 è ≈10-6 , mentre il
valore atteso per una struttura CO(OH)2 sarebbe ≈10-2. Questo
succede perché solo una molecola su 480 reagisce per
formare acido carbonico, mentre la maggior parte è sotto
forma di CO2 idratata. Il vero valore di pKa1 è 3.7 che è vicino al
valore atteso.
37
Periodicità di comportamento chimico nei composti binari:
a) dell’Idrogeno (χ=2.1)
aumento carattere protonico
LiH
BeH2
B2H6
CH4
NH3
H2O
HF
NaH
MgH2
(AlH3)n
SiH4
PH3
H2S
HCl
KH
CaH2
Ga2H6
GeH4
AsH3
H2Se
HBr
RbH
SrH2
InH3
SnH4
SbH3
H2Te
HI
CsH
BaH2
TlH3
PbH4
BiH3
H2Po
HAt
IDRURI IONICI
IDRURI COVALENTI
La polarità del legame M-H dipende dalla differenza di
elettronegatività tra M e H:
HF → H+
ACIDO;
CsH → H:-
BASE
Reazione tipica degli idruri in acqua:
H :- +H2O → OH− + H - H
descrivibile o come reazione acido/base o redox.
38
a) dell’Ossigeno (χ=3.5)
Consideriamo gli ossidi degli elementi del III° Periodo nel n° di
ossidazione più elevato:
basi
Na2O
anfotero
MgO
Al2O3
Carattere ionico
∆χ
2.6
acidi
SiO2
P4O10
SO3
Cl2O7
1.0
0.5
carattere covalente
2.3
2.0
1.7
1.4
Reazioni tipiche in acqua:
Na2O(aq) + H2O(l ) → 2Na + (aq) + 2OH− (aq)
SO3 (aq) + H2O(l ) → 2H3 O + (aq) + SO24- (aq)
Al2O3 (aq) + H2O(l ) → insolubile
Gli ossidi anfoteri sono praticamenti insolubili in acqua, ma si
sciolgono in acidi e basi.
BeO(s) + 2H3 O + (aq) → Be 2 + (aq) + 3H2O(l )
BeO(s) + 2OH- (aq) → Be(OH)24- (aq)
OSSIDI ANFOTERI
BeO
Al2O3
Ga2O3
GeO2
SnO2
Sb2O5
PbO2
Bi2O5
39
La reazione tra gli ossidi e l’acqua porta alla formazione di
composti contenenti gruppi ossidrilici.
NaOH
Mg(OH)2
Al(OH)3
Si(OH)4
OP(OH)3 O2S(OH)2 O3ClOH
Se il legame tra l’elemento e l’ossigeno è di tipo ionico (∆χ ≥ 2)
è favorita la dissociazione basica; se è covalente (∆χ < 0.4),
quella acida; se il legame è fortemente polare si può osservare
un comportamento acido o basico in dipendenza dal pH
(anfotero).
M-O-H
basi
acidi
Al(OH)3 (s) + OH− (aq) → [Al(OH)4 ]− (aq)
Al(OH)3 (s) + 3H3O + (aq) → Al3 + (aq) + 6H2O(l )
Quando un elemento (es. Cr: +2, +3, +6) ha diversi stati di
ossidazione i suoi ossidi possono avere carattere basico
(CrO), anfotero (Cr2O3), acido (CrO3) in accordo col carattere
ionico o covalente del legame.
40
Teoria di LEWIS (1930)
Un acido di Lewis è una sostanza che può accettare una
COPPIA DI ELETTRONI;
Una base di Lewis è una sostanza che può donare una COPPIA
DI ELETTRONI.
La specie chimica prodotta si dice ADDOTTO o COMPLESSO
acido-base.
A + B: → B: A
Acido
Base
Addotto
Sono acidi di Lewis:
1. Il protone;
2. I cationi metallici sono in grado di legarsi con la coppia
elettronica messa a disposizione da una base:
I legami O-H delle molecole d’acqua legate al berillio sono
polarizzate rendendo il rilascio del protone più facile Lo ione
complesso [Be(H20)4]2+ si comporta in acqua
41
3.
Scaricare