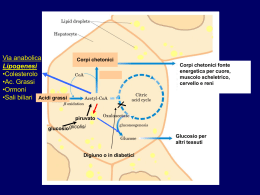
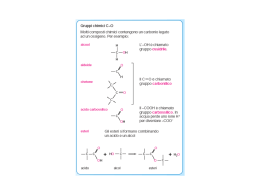
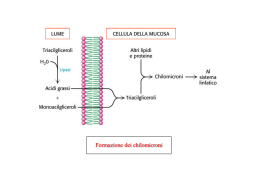
Metabolismo dei lipidi Abbiamo già visto che il metabolismo energetico con produzione di ATP , avviene in seguito alla demolizione di zuccheri (glicolisi), lipidi, e in piccolissima percentuale delle proteine. I lipidi vengono introdotti nel nostro organismo attraverso la dieta giornaliera vengono digeriti in corrispondenza del duodeno e la porzione dell’intestino tenue. Ricordiamo che il duodeno è la porzione dell’intestino tenue che fa seguito allo stomaco con il quale entra in comunicazione, in corrispondenza del piloro, valvola dello stomaco. Il duodeno con la sua tipica forma ad ansa accoglie la testa del pancreas in corrispondenza di due papille, la papilla maggiore e quella minore. Il pancreas è una ghiandola mista costituita per il 99% da ghiandole esocrine e l’1% da ghiandole endocrine. Nel primo caso le cellule pancreatiche sono ricche di granuli di zimogeno e di reticolo endoplasmatico, in quanto producono una grande quantità di enzimi detti “pancreatici” appartenenti al gruppo della lipasi e proteasi. Gli enzimi pancreatici man mano che vengono prodotti vengono riversati in due piccoli condotti chiamati : dotto di Wirsung che si riversa nella papilla maggiore del duodeno; dotto di Santorini che si riversa nella papilla minore insieme al dotto coledoco proveniente dal fegato che trasporta la bile,che contiene i Sali biliari e ha pH uguale a 9 cioè altamente basico. Le lipasi hanno il compito di demolire i lipidi formando delle piccole micelle che, arrivate all’intestino tenue in corrispondenza dei villi intestinali, vengono trasformate in chilomicroni che vengono convogliati o riassorbiti dai vasi chiliferi del sistema linfatico, che a loro volta si riversano nel dotto toracico che trasporta la linfa del tronco bracciocefalico, chiamato in questo modo perché da qui abbiamo due ramificazioni arteriose: una che va verso il braccio e l’altra verso la testa (carotide). I lipidi arrivati nel sangue vengono trasportati verso gli adipociti, cellule voluminose deputate all’accumulo di sostanze di riserva. Stru ttu ra m ol eco la re d i u n c hilo mic rone, il “m ez zo di tra spo rto” dei lipid i asso rbiti nell ’in testino Nel momento in cui i muscoli vengono sottoposti ad un’attività fisica “importante” devono avere a disposizione una grande quantità di energia sotto forma di ATP , che deve essere rilasciata in tempi brevissimi. È in questo modo che inizia il metabolismo dei lipidi. Ricordiamo che i lipidi dal punto di vista chimico sono costituiti da molecole di glicerolo esterificate da acidi grassi (mono,di,tri acetilglicerolo). I lipidi, in presenza di acqua e di idrolisi, vengono idrolizzati per liberare glicerolo e acidi grassi. Il glicerolo all’interno dell’adipocita va a trasformarsi in gliceraldeide cedendo due atomi di idrogeno e questa si inserisce nel meccanismo della glicolisi trasformandosi in 1,3 di fosfoglicerato, e continua il percorso di demolizione della glicolisi, nel citoplasma in assenza di ossigeno. Assorbimento dei lipidi della dieta La maggior parte dei lipidi della dieta è costituita da triacilgliceroli che devono essere degradati ad acidi grassi per poter essere assorbiti a livello intestinale . Le lipasi sono enzimi intestinali secreti dal pancreas che, grazie all’azione Assorbimento dei lipidi presenti nella dieta dei vertebrati dei sali biliari, degradano i triacilgliceroli consentendone l’assorbimento. I sali biliari, sintetizzati nel fegato a partire dal colesterolo, contengono molecole anfipatiche indispensabili per solvatare le molecole lipidiche ed esporle all’azione degli enzimi digestivi. Nelle cellule della mucosa intestinale, i triacilgliceroli sono risintetizzati e "impacchettati" in particelle lipoproteiche di trasporto, note come chilomicroni, che attraverso il circolo ematico e linfatico trasportano i lipidi della dieta a tutti i distretti dell’organismo. Mobilizzazione degli acidi grassi dai depositi metabolici Prima di poter essere utilizzati come combustibili, i triacilgliceroli devono essere idrolizzati per rilasciare gli acidi grassi mediante una reazione sottoposta a controllo ormonale. L’intero processo, noto come lipolisi, ha origine dalla stimolazione di specifici recettori posizionati sulla membrana degli adipociti Gli acidi grassi rilasciati nel torrente ematico ad opera di lipasi tissutali, si legano all’albumina sierica che funge da trasportatore, mentre il glicerolo viene captato e metabolizzato dal fegato Metabolismo lipidico dopo la lipolisi Nel fegato, il glicerolo può essere convertito in piruvato attraverso la glicolisi o in glucosio attraverso la gluconeogenesi. Nei tessuti extra-epatici, gli acidi grassi liberati dalla lipolisi sono utilizzati come combustibili metabolici per fornire energia Il glic erolo ottenuto per azione delle lipa si, viene fosforilato a glicer olo 3-fosfato, ossidato a fosfodiossia cetone, isomer izza to a glic eraldeide 3fosfato e introdotto nella glicolisi. Nei tessuti extraepatici l’acido grasso, entrato nel citosol dal sangue, è destinato alla ossidazione nella matrice mitocondriale. Prima del suo ingresso nella matrice, l’acido grasso deve subire una serie di tre reazioni. La prima è catalizzata dall’acil-CoA sintetasi. La reazione è fortemente esoergonica (-34 KJ/mole) e si compie con formazione di un intermedio acil-adenilato e di pirofosfato, eccellente gruppo uscente che viene immediatamente idrolizzato a 2 molecole di Pi favorendo la reazione nel verso del prodotto Ingresso dell’acil-CoA nel mitocondrio Nella seconda reazione, l’ acil-CoA, che non può attraversare la membrana mitocondriale interna, è substrato dell’enzima carnitina aciltransferasi I localizzato sul lato esterno della membrana interna che trasferisce l’acile alla carnitina. L’acil-carnitina attraversa così la membrana per diffusione facilitata dal trasportatore acil-carnitina/carnitina. Nella terza reazione, la carnitina aciltransferasi II localizzata sul lato interno della membrana provvede a riformare acil-CoA per reazione con CoA-SH. Per quanto ci è dato sapere, e si vocifera, la scoperta del ruolo della carnitina e la sua somministrazione ai calciatori della nazionale italiana, avrebbe contribuito non poco alla conquista del titolo mondiale nel 1982. Trasporto nei mitocondri Per attraversare la membrana mitocondriale interna, gli acidi grassi a lunga catena attivati vengono enzimaticamente coniugati alla carnitina mediante una reazione reversibile di transesterificazione. La carnitina è un alcol che può formare un legame estere ad elevato contenuto energetico con la funzione acilica degli acidi grassi attivati. La reazione di transesterificazione è catalizzata da specifiche aciltransferasi. Una translocasi trasporta il complesso acil carnitina all’interno del mitocondrio e permette di riciclare la carnitina Degradazione ossidativa degli acidi grassi La degradazione ossidativa degli acidi grassi attraverso il processo della βossidazione converte le molecole in una serie di unità acetiliche attivate (acetil-CoA), che possono essere ossidate nel ciclo dell’acido citrico Tutte le reazioni della βossidazione avvengono nella matrice mitocondriale e consentono, mediante specifici trasportatori, come il NADH ed il FADH2, di incanalare gli elettroni derivanti dall’ossidazione dei substrati direttamente nella catena di trasporto degli elettroni. β-ossidazione degli acidi Gli acil-CoA vengono degradati attraverso una serie di 4 reazioni sequenziali che compongono ciascun ciclo di β-ossidazione 1. Ossidazione catalizzata da una acil CoA deidrogenasi FAD-dipendente con formazione di un trans-Δ2-enoil CoA; 2. Idratazione dell’enoil CoA con formazione del 3-idrossiacil CoA ad opera della enoil CoA idratasi; 3. Ossidazione del 3-idrossiacil CoA a 3-chetoacil CoA, catalizzata da una specifica deidrogenasi NAD+-dipendente; 4. Scissione del 3-chetoacil CoA ad opera del gruppo –SH di una seconda molecola di CoA e formazione di acetil-CoA e di una nuova molecola di acilCoA accorciata di due atomi di carbonio. Questa reazione è catalizzata dalla β-chetotiolasi. Bilancio energetico La degradazione ossidativa del palmitato richiede sette cicli di β-ossidazione e genera: 8 molecole di acetil-CoA; 7 molecole di FADH2; 7 molecole di NADH. Per fosforilazione ossidativa si formano 2,5 molecole di ATP per ogni molecola di NADH riossidata, e 1,5 molecole di ATP per ogni molecola di FADH2 riossidata. La successiva ossidazione di ciascun acetil-CoA nel ciclo dell’acido citrico produce ulteriori 10 molecole di ATP. Pertanto, l’ossidazione completa del palmitato produce 106 molecole di ATP Degradazione ossidativa degli acidi grassi insaturi La ossidazione di acidi grassi monoinsaturi e polinsaturi, sia endogeni che assorbiti dalla dieta, richiede passaggi addizionali e strategie catalitiche differenti garantite dalla presenza di due proteine enzimatiche mitocondriali, una cis-Δ3-enoil-CoA isomerasi ed una 2,4-dienoil-CoA riduttasi. L’ossidazione degli insaturi richiede altre due reazioni Quando l’insaturazione è presente su un atomo di carbonio dispari, è necessaria l’azione catalitica della sola isomerasi. Se invece il doppio legame è presente su un atomo di carbonio pari, si rende necessaria l’azione sequenziale prima della riduttasi e poi della isomerasi. Successivamente, la degradazione ossidativa delle catene carboniose prosegue in maniera canonica. Sintesi dei corpi chetonici L’acetil-CoA formato nel corso della βossidazione degli acidi grassi entra nel ciclo dell’acido citrico solo se il metabolismo glucidico e lipidico sono ben bilanciati. Nel corso del digiuno o di una intensa attività fisica, i lipidi mobilizzati nei tessuti adiposi ad opera del glucagone e dell’adrenalina, rispettivamente, sono convertiti nelle cellule epatiche in derivati idrosolubili, noti come corpi chetonici. Questi composti si formano in tre tappe nei mitocondri epatici a partire dalle unità bicarboniose di acetil-CoA quando l’ossalacetato viene utilizzato per il processo di gluconeogenesi I corpi chetonici sono una forma idrosolubile di unità acetiliche e rappresentano una importante fonte energetica per molti tessuti (Figura 18). Nel corso del digiuno, questi composti soddisfano infatti fino al 75% del fabbisogno energetico di alcuni tessuti, come cuore e muscolo. Il glucosio rimane invece il combustibile preferito dal cervello e dai globuli rossi, sebbene in condizioni di digiuno il cervello si adatti all’utilizzo dei corpi chetonici. Metabolismo dei corpi chetonici Specifici enzimi extra-epatici degradano i corpi chetonici riformando le unità bicarboniose di acetil-CoA di cui sono costituiti. Sebbene in condizioni fisiologiche, come il digiuno, la concentrazione ematica dei corpi chetonici può significativamente aumentare, in alcune condizioni patologiche elevate concentrazioni di questi composti possono condurre a morte. La più comune di queste patologie è la chetosi diabetica, che si riscontra nei pazienti affetti da diabete mellito insulino-dipendente. La mancanza di insulina provoca una marcata produzione di corpi chetonici a livello epatico, mentre la mobilizzazione degli acidi grassi dai depositi adiposi non viene interrotta. Il risultato è una acidosi di grado elevato che, se non trattata, può compromettere vitali funzioni tissutali, soprattutto nel sistema nervoso centrale. Seguono coma diabetico e morte. Regolazione del metabolismo lipidico Bassi livelli di glucosio nel sangue inducono la secrezione di due ormoni, l'adrenalina ed il glucagone che, stimolando specifici recettori tissutali a sette eliche trans-membranarie accoppiati a proteine G, determinano la mobilizzazione dai siti di accumulo e la successiva ossidazione degli acidi grassi. L'insulina ha invece azione opposta. Questo ormone si lega a recettori Risposte dell’organismo agli stress metabolici: il digiuno e il diabete specifici ad azione tirosin-chinasica che favoriscono il processo di biosintesi degli acidi grassi. Un aumento dei livelli ematici di glucosio causa un aumento della secrezione pancreatica di insulina che, con la sua azione, facilita il passaggio del glucosio all'interno delle cellule. Il glucosio in eccesso viene convertito in glicogeno e depositato come riserva nei muscoli e nel fegato. A livello epatico, aumentati livelli di glucosio causano un accumulo di malonil-SCoA, substrato di partenza per la sintesi endogena degli acidi grassi, che a sua volta inibisce l’enzima carnitina aciltransferasi, rallentando la velocità di ossidazione dei lipidi. BIOSINTESI DEGLI ACIDI GRASSI La biosintesi degli acidi grassi avviene principalmente nel citoplasma delle cellule del fegato (epatociti) a partire dai gruppi acetile (acetil CoA) generati all'interno del fegato. Dato che tali gruppi possono derivare dal glucosio è possibile convertire i carboidrati in grassi. Tuttavia non è possibile convertire i grassi in carboidrati poiché l'organismo umano non possiede quegli enzimi necessari per convertire l'Acetiil-SCoA derivato dalla β-ossidazione in precursori della gluconeogenesi. Come abbiamo detto nella parte introduttiva mentre la β-ossidazione avviene all'interno della matrice mitrocondriale, la biosintesi degli acidi grassi avviene nel citosol. Abbiamo altresì affermato che per formare un acido grasso occorrono gruppi acetili che vengono prodotti all'interno della matrice mitocondriale. Occorre pertanto un sistema specifico in grado di trasferire l'acetil CoA dal mitocondrio al citoplasma. Questo sistema, ATP dipendente, utilizza il citrato come un trasportatore di acetile. Il citrato dopo aver trasportato i gruppi acetili nel citoplasma li trasferisce al CoASH formando l'acetil-SCoa. L'inizio della biosintesi degli acidi grassi avviene grazie ad una reazione chiave di condensazione dell'acetil-SCoA con l'anidride carbonica a formare Malonil-SCoA. La carbossilazione dell'acetil CoA avviene ad opera di un enzima importantissimo l'acetil CoA carbossilasi. Questo enzima, ATP dipendente, è pesantemente regolato da attivatori allosterici (insulina e glucagone). La sintesi di acidi grassi non si serve del CoA ma di una proteina trasportatrice di gruppi aciclici detta ACP che trasporterà, appunto, tutti gli intermedi della biosintesi degli acidi grassi. Esiste un complesso multienzimatico chiamato acido grasso sintasi che attraverso una serie di reazioni porta alla formazione di acidi grassi a non più di 16 atomi di carbonio. Gli acidi grassi a catena più lunga ed alcuni acidi grassi insaturi vengono sintetizzati a partire dal palmitato per azione di enzimi chiamati elongasi e desaturasi. REGOLAZIONE DELL'OSSIDAZIONE E DELLA BIOSINTESI DEGLI ACIDI GRASSI Bassi livelli di glucosio nel sangue stimolano la secrezione di due ormoni, l'adrenalina ed il glucagone che con la loro azione favoriscono l'ossidazione degli acidi grassi. L'insulina ha invece azione opposta e con il suo intervento stimola la biosintesi degli acidi grassi. Un aumento del glucosio ematico causa un aumento della secrezione di insulina che con la sua azione facilita il passaggio del glucosio all'interno delle cellule. Il glucosio in eccesso viene convertito in glicogeno e depositato come riserva nei muscoli e nel fegato. Un aumento del glucosio epatico causa l'accumulo di malonil-SCoA che inibisce la carnitina aciltransferasi rallentando la velocità di ossidazione degli acidi grassi.
Scaricare