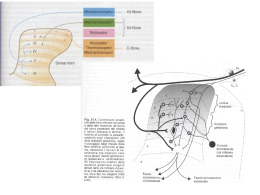
Gestione del dolore come gestire gli analgesici oppiacei Diritto a non soffrire di dolore inutile Dolore come V° parametro vitale Monitorizzare appropriatamente il dolore Legge n. 38 del 15 Marzo 2010 Oppiaceo / Oppioide Oppiaceo morfina ed altri alcaloidi naturali derivati dall’oppio (codeina, tebaina) Oppioide molecola di origine endogena o sintetica con stessi effetti degli oppiacei (beta-endorfina, leu-enkefalina, meta- enkefalina, dinorfina) Narcotici Sostanza che induce il sonno, in senso lato, sostanza da “ addiction” Struttura del recettore accoppiato alla proteina-G Via ascendente del dolore Meccanismo di azione degli Oppiacei OPPIOIDI + OPPIOIDI I peptidi oppioidi endogeni inibiscono la trasmissione e l’elaborazione degli impulsi dolorifici sia a livello del midollo spinale che delle vie nervose sopraspinali Gli analgesici oppioidi sono agonisti dei recettori per i peptidi oppioidi endogeni Tipologia dei Recettori analgesia sovraspinale, euforia, depressione respiratoria, miosi, dipendenza fisica analgesia spinale, miosi, disforia e sedazione Probabilmente mediano analgesia spinale ed attività dei recettori µ MoA degli oppioidi La morfina, ed altri farmaci oppioidi, mimano gli oppioidi endogeni A livello neuronale presinaptico riducono l’afflusso di ioni calcio mediante la chiusura dei canali voltaggio dipendenti nelle afferenze nocicettive primarie con diminuzione del rilascio di neurotrasmettitori A livello postsinaptico aumentano la fuoriuscita di ioni potassio con iperpolarizzazione dei neuroni sensibili agli stimoli nocicettivi, localizzati nel corno dorsale MoA degli oppioidi Effetto analgesico periferico, sulle afferenze nocicettive primarie In base all’attività intrinseca si classificano: AGONISTI AGONISTI PARZIALI ANTAGONISTI Agonismo Recettoriale puro e parziale Antagonismo Recettoriale Effetto di un agonista per i recettori oppiacei EFFETTI CENTRALI Analgesia Euforia Sedazione, Depressione respiratoria Nausea e vomito Miosi Effetto antitosse Diminuzione della pressione arteriosa e frequenza cardiaca Effetto di un agonista per i recettori oppiacei EFFETTI PERIFERICI Stipsi (recettori presenti nel tratto GI) Contrazione e spasmo dello sfintere vescicale Contrazione delle vie biliari Analgesia dei tessuti infiammati Effetto di un agonista per i recettori oppiacei EFFETTI COLLATERALI Gastrointestinali Psichici Respiratori Cardiocircolatori Genitourinari Sistemici Classificazione recettoriale Principio attivo Recettore Attività farmacologica Morfina µ [k] (δ) Agonista Codeina µ [k] Agonista Petidina µ [k/δ] Agonista µ/k Agonista µ Agonista Ossicodone Fentanile Buprenorfina µ/k Agonista parziale µ Pentazocina µ/k Agonista κ, antagonista µ Tramadolo [µ] Analgesico oppioide atipico Naloxone [µ] Antagonista Per evitare rischi, ricordare – Gli oppiacei sono FARMACI analgesici ad azione centrale che agiscono su specifici recettori endogeni – L’interazione farmaco recettore produrrà una serie di effetti clinici dipendenti dalla affinità farmaco-recettore Potenza farmacologica E’ funzione della dose di farmaco che mira ad un determinato effetto clinico (ad es. l’analgesia) La potenza dipende: Superamento della barriera emato-encefalica, Affinità tra oppioide e recettore Attività intrinseca (capacità di esprimere l’effetto clinico desiderato) Classificazione per affinità / potenza Oppiacei potenza durata Morfina 1 4 Codeina 0.1 4 6 8 Ossicodone 0.8 6 Fentanyl 30 0.3 Buprenorfina 10 8 Tramadolo 0.1 6 Metadone NB: dal punto di vista farmacologico la definizione di oppiaceo “debole” e “forte” è arbitraria ed è in funzione della dose dell’oppiaceo. Ad es. 1mg di morfina per os può essere meno efficace di 60 mg di codeina somministrati per la stessa via Biodisponibilità (per os) Morfina: 30-40% Ossicodone: 60-80% Fentanyl: 10-25% Tramadolo: 70-100% Buprenorfina: 15-20% Idromorfone < 30% Metadone: 90% Distribuzione del farmaco E’ quel processo dinamico che permette al farmaco di diffondere nei vari tessuti e di raggiungere il sito specifico di azione Riguarda e determina quindi sia l’effetto terapeutico che la velocità di eliminazione VOLUME DI DISTRIBUZIONE =V = dose assunta /concentrazione plasmatica Il legame del farmaco con le proteine plasmatiche modifica significativamente il processo di distribuzione dei farmaci Legame del farmaco alle proteine plasmatiche Alterazione del legame del farmaco alle proteine plasmatiche Metabolismo degli oppiacei Metabolismo epatico Escrezione renale Le malattie epatiche non influiscono in modo significativo sulla farmacocinetica degli oppioidi, se non in caso di insufficienza epatica importante Le malattie renali richiedono la necessità di valutare attentamente l’utilizzo degli oppioidi Metabolismo degli oppiacei Il fegato interviene nella metabolizzazione: alchilazione, Coniugazione idrolisi Sono coinvolti i sistemi citocromiali (CYP 450) o il sistema UGM Occorre ricordare che – La terapia necessita un monitoraggio per verificare che non intervengano variazioni cinetiche anche dopo l’avvio della terapia – Il farmaco (l’agonista) stimola il recettore endogeno e quest’ultimo può reagire in maniera diversa per una predisposzione genetica (up regulation, down regulation) VIE DI SOMMINISTRAZIONE Orale Trans-mucosale orale / nasale / rettale Trans-dermica Intradermica - Sottocutanea Endovenosa Intrarachidea ……. La via orale Non invasiva Semplice ed accettata dal malato Indicata come ideale dalle linee guida internazionali e dall’OMS per il trattamento antalgico con oppiacei Biodisponibilità ridotta rispetto alle vie parenterali (first pass epatico) Non può essere usata nei pazienti con impossibilità a deglutire La via nasale Permette un più basso dosaggio rispetto alla via orale Veloce via di assorbimento Evita il first pass epatico Rapido passaggio della BEE Non invasiva e di facile accesso anche per il paziente La via transdermica Non invasiva I farmaci utilizzati devono essere molto liposolubili e a basso peso molecolare Solo fentanyl e buprenorfina sono ad oggi disponibili Prima della diffusione sistemica il farmaco si accumula a livello cutaneo per cui si verifica un ritardo di diverse ore (anche più di 12 ore) prima di ottenere una concentrazione plasmatica efficace Ricordare che esistono sistemi citocromiali nel sottocutaneo Vantaggi Svantaggi economica, comoda, non invasiva Onset entro 20 – 40 minuti rapido onset (2-5 minuti ) invasiva, non sempre praticabile Praticabile dal paziente Lento onset e cinetica imprevedibile Transmucosale orale (fentanyl) comoda, non invasiva, rapido onset analgesico (10 – 15 minuti) Limitata praticabilità in pazienti con gravi mucositi o xerostomia Transmucosale nasale (fentanil) comoda, non invasiva, rapido onset (5 minuti) Sgocciolamento delle soluzioni acquose (maggiore stabilità della dose erogata con le formulazioni a base di pectina) Orale (ad es morfina, ossicodone, ecc) Endovenosa /sottocutanea (morfina, ecc) Transcutanea (ad es fentanil)) CODEINA Profarmaco (metil mofina) Bassa affinità per i recettori μ Potenza farmacologica 10 volte inferiore alla morfina Buona disponibilità per os (media 40%); Emivita circa 2,5 ore (mediana) Metabolismo epatico: 6 metaboliti attivi (morfina e codeina 6glucuronide); Nel metabolismo della codeina è coinvolto il CYP2D6 Eliminazione urinaria “Effetto tetto” per dosi complessive giornaliere di 360 mg Stessi eventi avversi degli oppiacei TRAMADOLO Debole attività agonista oppioide (recettore µ) Inibizione re-uptake Serotonina e Noradrenalina Potenza farmacologica: 1/5-1/10 della Morfina Biodisponibilità orale: 70-100% Emivita: 5-7 h 11-22 metaboliti attivi (CYP2D6 / CYP2D4) ; 10 % caucasici scarsi metabolizzatori: maggior rischio di effetti collaterali) Metabolismo epatico / Eliminazione renale “Effetto tetto” per dosi complessive giornaliere di 400-600 mg. OSSICODONE affinità recettoriale per recettori μ e κ Struttura simile alla codeina, ma con attività analgesica superiore Biodisponibilità (60-87%), maggiore nelle donne Equianalgesia ossicodone morfina orale va da 1-1,5:1 a 2:1 Emivita 3.5 - 4 ore Assenza di metaboliti con attività farmacologica significativa (CYP3A4/5) Eliminazione urinaria Assenza di effetto tetto sinergia con paracetamolo (325mg per compressa) MORFINA Alta affinità per i recettori µ [k] (δ) Bassa riserva recettoriale Biodisponibilità per os circa 33% con onset 20-30 minuti Tempo di emivita: 2-3 ore Il metabolismo prevalentemente epatico, dove si coniuga con l’acido glicuronico con 2 metaboliti, M-3-G e M-6-G Eliminazione per via renale Assenza di “effetto tetto” BUPRENORFINA Agonista parziale con elevata affinità per i recettori μ Antagonista sui recettori k (25-50 volte più potente della morfina, ma meno efficace). sostanza lipofila, a basso peso molecolare Metabolismo CYP2C8, CYP3A5/7 e UGT1A1 effetti collaterali, parzialmente reversibili con naloxone. Somministrato con un agonista puro può antagonizzare gli effetti dell’agonista A dosaggi terapeutici non ha effetto tetto: tale effetto compare a dosaggi > 4 mg/die IDROMORFONE Agonista i recettori μ e k più potente della morfina, ma con effetto analgesico meno duraturo Biodisponibilità inferiore al 30%, assorbimento piccolo intestino Metabolizzato a livello epatico esteso primo metabolismo epatico; non produce metaboliti attivi (metabolita 3-glicuronide è inattivo) FENTANYL Agonista puro dei recettori μ Azione analgesica 75-125 volte maggiore della morfina Elevata lipofilia con rapido passaggio della barriera ematoecefalica ed elevata rapidità d’azione (30’’ ev) e limitata durata (30-60’ ev) Assenza di effetto tetto Al contrario della morfina, fentanil e principalmente metabolizzato dall’enzima CYP450 3A4 responsabile della metabolizzazione di oltre il 35% dei farmaci attualmente disponibili Catabolismo epatico senza formazione di metaboliti attivi: norfentanil (maggiore) e despropionilfentanil, idrossifentanil e idrossinorfentanil (minori) Se somministrato per via trans dermica per raggiungere lo steady state sono necessarie fino a 24 h METADONE Azione agonista sui recettori μ e δ (isomero destrogiro) Azione antagonista sui recettori NMDA (entrambe le forme isomeriche) Alta biodisponibilità orale (40%-99%) Picco plasmatico raggiunto in circa 4 ore Effetto analgesico precoce grazie alla elevata lipofilia Assenza di effetto tetto La C max si mantiene costante per molte ore Emivita plasmatica fino a 75 ore Metabolismo epatico per demetilazione (senza metaboliti attivi) Eliminazione anche attraverso la via renale Prodotto Indicazioni Jurnista OxyContin MS Contin Oramorph Co-efferalgan Trattamento del dolore severo Trattamento del dolore intenso Remissione dei dolori prolungati, gravi e ribelli Dolori cronici intensi e/o resistenti agli altri antidolorifici Trattamento delle esacerbazioni transitorie di dolore nei pazienti oncologici adulti (Breakthrough Pain Dolore Episodico Intenso - DEI) Trattamento delle esacerbazioni transitorie di dolore nei pazienti oncologici adulti (Breakthrough Pain Dolore Episodico Intenso - DEI) Trattamento delle esacerbazioni transitorie di dolore nei pazienti oncologici adulti (Breakthrough Pain Dolore Episodico Intenso - DEI) Trattamento delle esacerbazioni transitorie di dolore nei pazienti oncologici adulti (Breakthrough Pain Dolore Episodico Intenso − DEI) Trattamento del dolore cronico da cancro e del dolore ribelle che necessita di un'analgesia a base di sostanze oppiacee. Trattamento del dolore oncologico di intensità da moderata a severa e del dolore severo che non risponde agli analgesici non oppioidi. Dolore severo cronico, che può essere trattato adeguatamente solo con analgesici oppiacei Dolore severo cronico, che può essere trattato adeguatamente solo con analgesici oppiacei Trattamento del dolore da moderato a grave in corso di malattie muscolo-osteoarticolari non controllato da (FANS)/paracetamolo utilizzati da soli Trattamento sintomatico del dolore da moderato a severo che non risponde al trattamento con analgesici non oppioidi utilizzati da soli. Tachidol Trattamento sintomatico delle affezioni dolorose acute e croniche anche accompagnate da iperpiressia Contramal Stati dolorosi acuti e cronici di diverso tipo e causa e di media e grave intensità, come pure in dolori indotti da interventi diagnostici e chirurgici. Trattamento sintomatico del dolore acuto da lieve a moderato Trattamento sintomatico del dolore acuto da lieve a moderato Actiq PecFent Effentora Abstral Durogesic Transtec Matrifen Quatrofen Depalgos Patrol Kolibri Interazioni farmacologiche effetti dell’induzione / inibizione enzimatica sulla farmacocinetica Concentrazione plasmatica Rischio di tossicità (inibizione enzimatica) Inefficacia (induzione enzimatica) Massima dose tollerata Finestra terapeutica Minima dose efficace tempo P. Geppetti , S Benebei Clin Drug Invest. 2009; 29 (1): 9-16 Parametri utili per la gestione farmacologica del dolore Criteri farmacologici – Biodisponibilità / metabolizzazione Variabilità individuale della farmacocinetica Dosaggio personalizzato – Affinità recettoriale / potenza analgesica Risposta individuale no n prevedibile – Presenza di “effetto tetto” Prevedere la necessità di ruotare a farmaco più efficace – Vie di somministrazione / tecniche farmaceutiche Formulazioni ad immediato rilascio per avviare la terapia Formulazioni a lento rilascio per il trattamento di mantenimento Parametri utili per la gestione dell’oppiaceo Criteri clinici – Indicazioni delle schede tecniche Molti farmaci non sono indicati nell’età pediatrica Farmaci a lento rilascio non devono essere masticati – Interazioni farmacologiche Predisposizione genetica Minima dose interagente Minima dose tollerata – Risposta analgesica individuale Necessità di un avvio graduale dell’oppiaceo Per evitare rischi, ricordare I FANS causano un danno d’organo diretto Gli oppiacei inducono stipsi, nausea, sonnolenza, depressione del SNC, ecc vomito, tolleranza, Tali effetti sono correlati al meccanismo di azione generico dei farmaci oppiacei Parametri utili per la gestione dell’oppiaceo Criteri farmacologici – Avviare con la terapia con oppiaceo a basse dosi e/o in combinazione con paracetamolo – Avviare la terapia con farmaci ad immediato rilascio fino alla stabilizzazione del dolore prima di passare ad oppiacei a lento rilascio (mantenimento) – Ruotare l’oppiaceo piuttosto che aumentare le dosi di oppiaceo – Cambiare la via di somministrazione piuttosto che aumentare la dose sopra quella massima tollerata STRATEGIA PER IL CONTROLLO DEGLI EFFETTI COLLATERALI Riduzione della dose Idratazione Sospensione di 1-2 somministrazioni Eliminazione o riduzione di farmaci concomitanti che interagiscono con gli oppioidi Somministrazione di farmaci sintomatici per gli effetti indesiderati Cambiamento della via di somministrazione Rotazione degli oppioidi Utilizzo farmaci antagonisti ROTAZIONE DEGLI OPPIOIDI Rotazione= passaggio da un oppioide ad un altro, quando il grado di analgesia ottenuto è limitato dalla comparsa di effetti avversi. Questo approccio si basa sull’osservazione che la risposta del pz varia da oppioide a oppioide, sia per quanto riguarda l’analgesia che per gli effetti avversi. La rotazione degli oppioidi si basa sulla tabelle di equianalgesia, che forniscono valori, basati sull’evidenza scientifica, delle potenze relative dei differenti oppioidi. Solitamente, quando si passa dall’oppioide A al B è prudente diminuire la dose del secondo oppiaceo Effetti degli oppioidi Alcuni effetti sono legati all’inizio del trattamento, o in caso di aumento di dose Altri effetti sono più tipici dell’uso prolungato (mantenimento) Effetti iniziali nausea, vomito sedazione secchezza delle fauci stipsi prurito Effetti nel mantenimento I stipsi sedazione (minore) secchezza delle fauci allucinazioni mioclonie Effetti tardivi alterazioni cognitive disforia depressione respiratoria ritenzione urinaria edema polmonare miosi Nausea e vomito Trattamento farmacologico / recettore coinvolto: metoclopramide (D2-5HT4), cisapride (5HT4) domperidone (D2 periferici), aloperidolo (D2) fenotiazine (D2, muscarinici, H1, 5HT2) setronici (5HT3) steroidi (?) Modificazione via di somministrazione o oppioide Stipsi da oppioidi - lattulosio: effetto osmotico, aumenta il contenuto idrico delle feci (voluminose e morbide) - senna: stimola il plesso mioenterico, induce la peristalsi - idratazione TOLLERANZA La tolleranza farmacologica è una diminuzione degli effetti oppioidi causata da una esposizione ripetuta al farmaco con bisogno di aumentare la dose di oppioide per mantenere il medesimo grado di analgesia DIPENDENZA FISICA l’interruzione improvvisa dell’esposizione cronica a questi farmaci può esitare nello sviluppo dei sintomi di una sindrome d’astinenza, tra i quali è incluso il dolore. la sindrome d’astinenza può essere provocata dalla somministrazione di naloxone o di oppioidi con azione antagonista/agonista a pazienti con dipendenza da oppioide con azione agonista pura. ADDICTION Addiction = dipendenza fisica e psichica L’addiction è un ‘alterazione cronica neurobiologica, influenzata da fattori genetici, psicosociali ed ambientali. La comparsa dell’ addiction durante la terapia con oppioidi può essere attribuita ad un errato controllo dell’uso del farmaco, ad un uso compulsivo, all’uso continuato nonostante gli effetti nocivi e al craving. Craving = impegno di tutte le energie fisiche e mentali del paziente nella ricerca ossessiva del farmaco Protocollo terapeutico con oppioidi Terapia Step by Step Paziente naive agli oppiacei e con dolore lieve moderato p Primo ste step Secondo p Terzo ste Razionale della combinazione farmacologica Combinazione tra due farmaci con effetti – Additivi – sinergici (di potenziamento) Razionale della combinazione farmacologica Miaskowski C et Al, Pain 1992; 49: 137-144 Paracetamolo Inibisce una cox centrale Stimolazione delle vie serotoninergiche inibitorie discendenti Stimolazione dei recettori CB1 Gatti A. Sabato E, Di Paolo AR, Mammucari M, Sabato AF Clin. Drug Invest 2010 ; 30 (2):3-14 Razionale della combinazione farmacologica Gatti A. Sabato AF, Carucci A, Bertini L, Mammucari M, Occhioni R Clin. Drug Invest 2009; 29 (1):31-40 Razionale della combinazione farmacologica Gatti A. Sabato AF, Carucci A, Bertini L, Mammucari M, Occhioni R Clin. Drug Invest 2009; 29 (1):31-40 Razionale della combinazione farmacologica 10 p< 0.0005 9 8 Basale 2 settimane 4 settimane 7,7 6,5 7 5,6 6 5 6,6 6,4 5,1 4,4 4 4,7 4,4 3,8 3,3 2,6 3 2 1 D ol or e at tu a le m ed io D ol or e do M in or Pe gg io r do lo re lo re 0 Gammaitoni (2003) Razionale della combinazione farmacologica 10 Basale 2 settimane 4 settimane p< 0.0004 9 8 7 6,2 6 5 5,2 4,6 4,5 4 6,1 6 3,4 3,6 3,3 2,6 3 4,3 3,5 3,6 3,2 2,4 3,6 2,8 2,7 2 1 er e o G us to di vi v So nn zio ne Re la la vo ra tiv a ità M ov i or e Um m en to At tiv At tiv ità ge ne ra l i 0 Gammaitoni (2003) Tempi di azione della terapia e relativi usi nella pratica clinica 3. Somministrazione Nasale per il doore grave e imprevedibile 1. Terapia del dolore cronico con dose fissa ad orari fissi 2. Terapia con oppiaceo forte per os Dolore di base Tempo Usare i farmaci ad azione centrale secondo le schede tecniche
Scaricare