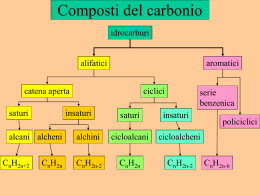
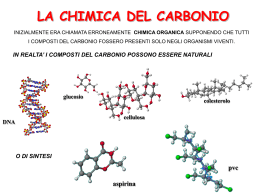
LA CHIMICA DEL CARBONIO E’ QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI)… …O ESSERE PRODOTTI DI SINTESI (MATERIE PLASTICHE, PRODOTTI FARMACEUTICI, SOSTANZE ALIMENTARI, CARBURANTI) aspirina anfetamina pvc CARBONIO IL CARBONIO È IL PRIMO ELEMENTO DEL IV GRUPPO DELLA TAVOLA PERIODICA: CONFIGURAZIONE ELETTRONICA s2p2 POSSIBILITÀ DI FORMARE 4 LEGAMI COVALENTI PUO’ DARE DOPPI LEGAMI C=C E I TRIPLI LEGAMI C≡C, C≡C ANCH’ESSI MOLTO DIFFUSI, SONO MOLTO STABILI. LE IBRIDAZIONI DEGLI ORBITALI s E p L’IBRIDAZIONE sp3 CARATTERISTICA DEGLI ALCANI, I 109° TRA GLI ORBITALI CONSENTONO AGLI ATOMI DI CARBONIO SOLO LEGAMI SEMPLICI (σ) GLI ORBITALI IBRIDI HANNO ENERGIA INTERMEDIA, MAGGIORE DELL’ORBITALE 2s E INFERIORE ALL’ORBITALE 2p L’IBRIDAZIONE sp2 e sp Formazione del doppio legame ATOMI DI CARBONIO CON IBRIDAZIONE sp2 POSSONO FORMARE FRA LORO DOPPI LEGAMI (CARATTERISTICI DEGLI ALCHENI) ALCHENI GLI IBRIDI sp CONSENTONO DI FORMARE LEGAMI TRIPLI (CARATTERISTICI DEGLI ALCHINI) ALCHINI Formazione del triplo legame GLI IDROCARBURI CONTENGONO SOLO CARBONIO ED IDROGENO VENGONO DISTINTI IN TRE CLASSI 1. SATURI: SOLO LEGAMI SEMPLICI C-C SE SATURI ED ACICLICI: ALCANI SE SATURI E CICLICI: CICLOALCANI 2. INSATURI: CON LEGAMI MULTIPLI C=C, C=C C≡C 3. AROMATICI: CICLICI ED INSATURI- SIMILI AL BENZENE. ALCANI (ibridazione sp3) FORMANO UNA SERIE OMOLOGA, IN CUI OGNI TERMINE DIFFERISCE DAL SUCCESSIVO PER UNA QUANTITÀ COSTANTE (-CH2-). HANNO FORMULA GENERALE CnH2n+2. Formazione del legame σ tra ibridi sp3 (etano): etano butano TABELLA DEI PRIMI DIECI ALCANI NON RAMIFICATI CICLOALCANI I CICLOALCANI SONO IDROCARBURI SATURI I CUI ATOMI DI CARBONIO FORMANO ALMENO UN ANELLO. UN ESEMPIO È IL CICLOESANO: ciclo-propano ciclo-butano ciclo-pentano ciclo-esano ALCHENI o idrocarburi etilenici o olefine (ibridazione sp2) • HANNO ALMENO UN DOPPIO LEGAME • HANNO FORMULA GENERALE Etene CnH2n ALCHENI CICLICI ALCHINI (ibridazione sp) • IIBRIDIZZAZIONE DEGLI ORBITALI DI TIPO sp • HANNO ALMENO UN TRIPLO LEGAME • HANNO FORMULA GENERALE CNHN Etino ALCOLI e FENOLI GLI ALCOLI HANNO FORMULA GENERALE R-OH UNA MOLECOLA D’ACQUA SOSTITUITA. CLASSIFICAZIONE I LEGAMI IDROGENO • • • I PUNTI DI EBOLLIZIONE E FUSIONE DEGLI ALCOLI SONO MOLTO PIU’ ALTI DEGLI IDROCARBURI CORRISPONDENTI. IL LEGAME O-H E’ FORTEMENTE POLARIZZATO E L’H HA UNA PARZIALE CARICA POSITIVA CHE GLI CONSENTE DI STABILIRE INTERAZIONI DEBOLI DI TIPO PONTE-H CON LE MOLECOLE VICINE. VICINE QUESTO SPIEGA LA MISCIBILITA’ DEGLI ALCOLI PIU’ LEGGERI CON L’ACQUA IL COENZIMA Q È IL FONDAMENTALE TRASPORTATORE MOBILE DI ELETTRONI DELLA CATENA RESPIRATORIA DI TUTTI GLI ORGANISMI AEROBI. LA VITAMINA E LA VITAMINA E (α-TOCOFEROLO) TOCOFEROLO È UNO DEI PIÙ IMPORTANTI ANTIOSSIDANTI PROVENIENTI DALLA DIETA ESSENDO DI NATURA LIPIDICA, OLTRE CHE FENOLICA PROTEGGE I LIPIDI DELL’ORGANISMO DALL’OSSIDAZIONE ALDEIDI e CHETONI contengono il gruppo CARBONILE • Nelle aldeidi è su un carbonio primario • Nei chetoni è su un carbonio secondario Il gruppo carbonile Il legame C=O è molto polarizzato: ed il C è soggetto ad attacchi nucleofili • La polarità delle meolecole ne diminuisce la volatilità rispetto agli alcani corrispondenti Le molecole non possono fare legami H ma possono riceverli (ad esempio dall’acqua) ACIDI CARBOSSILICI Acidi carbossilici alifatici: Acidità Gli acidi carbossilici si dissociano nell'acqua per formare un anione carbossilato e uno ione idronio. Occorre ricordare che, quanto più è grande il valore di Ka, o più piccolo il valore di pKa, tanto più forte è l'acido: Esteri Derivano dagli acidi per sostituzione del gruppo OH con un gruppo OR e danno origine al profumo di molti frutti e fiori. La nomenclatura è analoga a quella dei sali: prima si mette il nome della componente acida, con la desinenza -ico cambiata in -ato, poi quello del radicale R del gruppo -OR. Ammidi Le ammidi, fra i derivati degli acidi carbossilici, sono quelli meno reattivi e sono largamente diffuse in natura. Le ammidi più importanti sono le proteine. Le ammidi hanno geometria piana e, sebbene il legame carbonio-azoto venga comunemente scritto come legame semplice, la rotazione risulta parzialmente impedita. La risonanza fa si che il legame carbonio-azoto si comporti come legame doppio. Quindi l'azoto, il carbonio carbonilico e gli atomi ad essi legati giacciono sullo stesso piano. legame semplice carbonio-azoto (che è di circa 1,47A). Come si può dedurre dalla forma di risonanza dipolare, le ammidi sono composti altamente polari e danno forti interazioni di tipo ponte H. La geometria delle ammidi e la possibilità di instaurare ponti H sono alla base delle strutture secondarie e terziarie di tutte le proteine e quindi delle loro funzioni specifiche. Ammine vengono classificate come • Ammine primarie • Ammine secondarie • Ammine terziarie • Gli elettroni dell'atomo di N sono ibridati sp3, e la molecola ha forma piramidale. COMPOSTI AROMATICI • SONO STRUTTURE (ES. BENZENE) BENZENE CHE SI TROVANO IN MOLTI COMPOSTI CON AROMA • COSTITUITI DA ANELLI A 6 ATOMI DI CARBONIO NEI QUALI LEGAMI DOPPI SI ALTERNANO A LEGAMI SEMPLICI. SEMPLICI SEBBENE INSATURI HANNO UN COMPORTAMENTO CHIMICO DIVERSO DAGLI ALCHENI. ALCHENI POLICICLICI AROMATICI E CANCRO • PRESENTI NEL CATRAME E NEL CARBON FOSSILE MA ANCHE NELLA FULIGGINE E NEL FUMO DELLE SIGARETTE, OPPURE NELLA CARNE COTTA ALLA GRIGLIA. • L’ORGANISMO TENTA DI ESPELLERLI CON LE URINE OSSIDANDOLI PER RENDERLI PIÙ SOLUBILI. QUESTI PRODOTTI D’OSSIDAZIONE SONO I VERI RESPONSABILI DEL CANCRO. CANCRO Termina Da capo Cattedra di Chimica Università di Brescia Torna Torna
Scaricare